乳状液的结构、种类及在递送脂溶性生物活性物质方面的应用
王爱华
(湖北省农业科学研究院质量标准与检测技术研究所,武汉 430064)
脂溶性生物活性物质(Lipophilic bioactive compounds,LPBC)具有多种生物活性功能,如抗氧化、抗癌、降血脂、提高人体免疫力等。典型的LPBC 如多不饱和脂肪酸(PUFA)、脂溶性维生素、类葫芦卜素、植物甾醇、辅酶Q10、姜黄素等[1-3]。这些化合物含有多个不饱和双键而表现出不稳定,主要表现在食品加工、运输和储存过程中,受到物理(光、氧、温度、湿度和盐离子浓度等)、化学和酶降解等因素的影响,容易发生氧化、降解作用,可能导致异味、变色甚至生成致癌残留物[4]。此外,LPBC在经过口腔、胃肠道消化过程中受到pH、盐离子浓度、各种酶和自身水解物的影响导致其不稳定,使其生物利用率大大降低,且易与其他成分发生作用。
LPBC 具有水溶性低、易氧化、易分解和生物利用率低等特性,限制了其在食品工业中的应用。人们在寻找各种途径来提高LPBC 的稳定性及生物利用率。构建乳状液体系可以有效的递送LPBC 并维持其稳定性,直到其以可控的方式释放出来,并在目标部位激活(由于有些化合物的早期释放,LPBC 在与食物成分混合时就失去了活性),从而做到有效释放和靶向输送[5]。
乳状液输送系统可用来提高LPBC 的稳定性并解决潜在的生物利用率问题。乳状液特别适合保护和输送LPBC,不同形式的乳状液可参与复杂的食物系统。研究证明,乳状液是营养素的良好输送系统,可防止其降解,将其分散在水介质中,控制其释放,最终提高其生物利用率。成功开发具有理想功能要求的输送系统取决于乳状液的结构(如液滴大小、界面电荷、界面组成、界面厚度和乳液黏度)以及营养素与乳状液之间的相互作用[5,6]。用于输送LPBC的乳状液形式多样,如多层乳状液、复合乳状液、Pickering 乳状液、固体脂质颗粒、凝胶乳状液和结构化乳状液,具有改善的动力学稳定性,在更复杂的环境中是很好的输送系统[7]。它们保护LPBC免受食物加工和贮存的不良环境条件(如pH、温度、离子强度和酶活性的变化)影响,提高其生物利用率。
本研究综述了不同乳状液的种类、界面结构及在递送LPBC 方面的应用。介绍了多层乳状液、多重乳状液、凝胶乳状液、Pickering 乳状液和固体脂质颗粒等几种新型结构乳状液,以及它们在消化道输送食物营养素方面的优势。
1 LPBC 的来源及特性
1.1 LPBC 的来源及生物活性
LPBC 主要是非极性物质,难溶于水,易溶于有机溶剂[8],是被人体消化吸收后能发挥一定生物效应的化合物。常见的LPBC 有PUFA、β 胡萝卜素、姜黄素、甾醇、脂溶性维生素(维生素A、维生素D、维生素E、维生素K)、辅酶Q10 等(表1),已构建了多种类型的基于乳状液的递送系统[7,9-19]。LPBC 主要来源于动植物,其中β-CE、姜黄素和植物甾醇等主要来源一些植物的根茎和果实,PUFA 主要来源一些植物种子和海产品(图1)。

表1 常用的LPBC 及功能特性
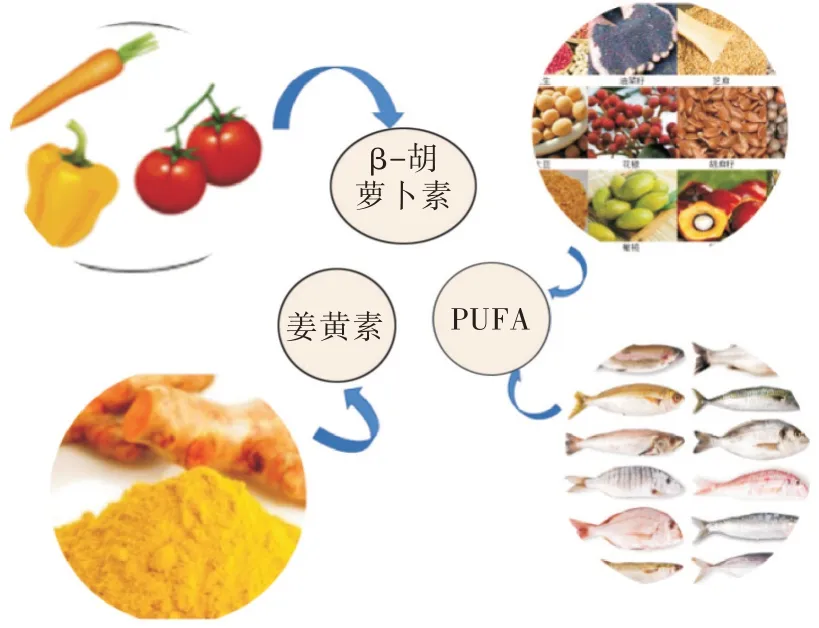
图1 常见的LPBC 来源
1.2 LPBC 的特性
LPBC 的分子量分布主要在200~1 000 kDa,由疏水性片段的长链烷基和亲水基团的羟基和羧基组成[20]。LPBC 在食物体系中可以强化功能性成分,如脂溶性维他命、PUFA、β-CE、姜黄素、辅酶Q10 和风味成分等,开发具有特殊营养功能和感官特性的新功能食品。LPBC 大部分难溶于水,对热、光、氧等敏感,易氧化分解,这限制了其在食品工业中的应用(图2),提高LPBC 的稳定性及生物利用率至关重要。在食品工业中,多层乳状液、多重乳状液、凝胶乳状液、Pickering 乳状液和固体脂质颗粒等可作为营养成分递送系统,通过界面和水相将LPBC 与油滴结合,形成水包油(O/W)或油包水(W/O)型乳状液,从而提高LPBC 的稳定性、分散水溶性、加工性、适口性和生物利用率[21-24]。通过在水相、油相和界面进行特殊设计乳状液体系,使乳状液在通过口腔、胃和肠道过程中LPBC 能稳定和顺利释放,实现可控释放。
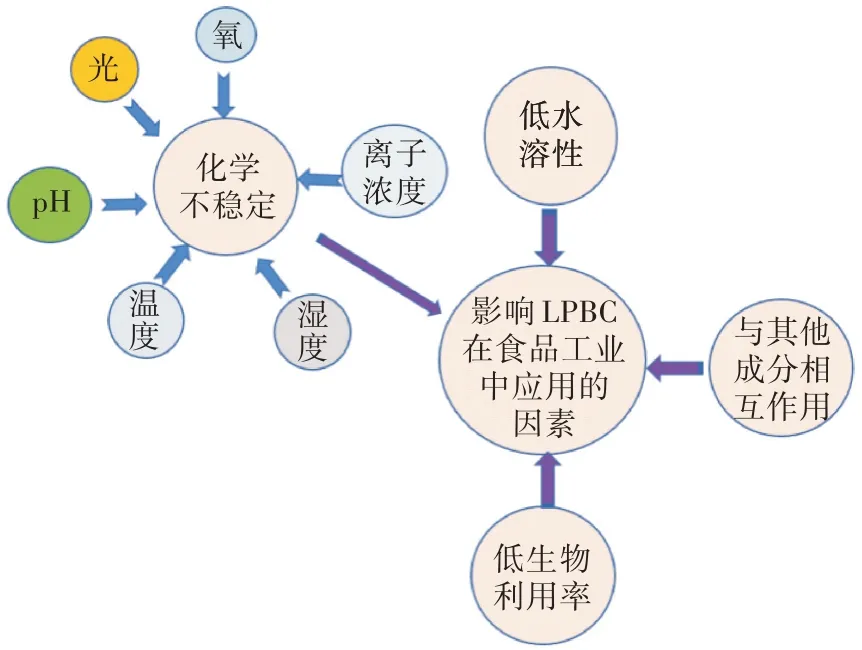
图2 影响LPBC 稳定性的因素
2 乳状液的结构
乳状液是一种液体作为细小液滴分散在另一种与它不相容的液体中而形成的分散体系。它由2 个不相溶的相组成,细小液滴通常称作分散相(内相或不连续相);另一种液体是连续溶液,称为分散介质(外相或连续相)[25]。乳液是一种不透明的乳白色液体。液滴直径大多在0.1~10.0 μm,可以用普通光学显微镜观察到。乳状液由分散相、分散介质和乳化剂3 部分组成,有O/W 和W/O 型2 种。O/W型油为分散相,水为连续相;W/O 型则相反[23]。乳化液中的油相是指所有与水不相容的有机液体。为了保持乳状液的稳定性,两亲性成分(乳化剂)如蛋白质、磷脂、脂肪酸酯在系统中最好位于油-水界面[26]。乳化剂(如蛋白质、磷脂、脂肪酸酯等)的主要作用是在油水界面上吸附或富集,形成保护膜,防止液滴在接近时聚集或絮凝。不同的油相影响乳状液的结构。由于乳化剂是覆盖在油滴表面的物质,且乳化剂种类很多,有大分子的、小分子的、带不同电荷的、不同性质和形状的(图3)。乳化剂在决定乳状液的结构方面起主要作用,乳状液的结构更多的体现在乳状液的表面结构。乳状液的表面结构决定了它的物化特性,如物化稳定性和胃肠道消化特性。构建不同结构的乳状液可以对LPBC 的稳定性及释放进行调控。
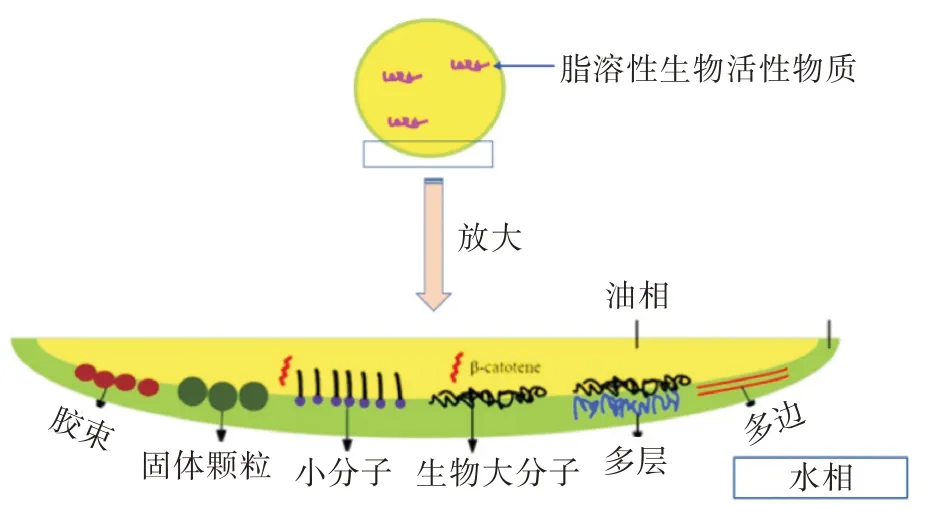
图3 乳状液的结构
3 乳状液的种类
3.1 多层乳状液
多层乳状液由分散在水介质中的小油滴组成,每个油滴被纳米层状壳包围,通常由乳化剂涂层和一个或多个生物聚合物层组成(图4)。它的稳定性取决于其粒径分布、油浓度、乳化剂在界面上的组成和分布、界面层厚度、电位分布和渗透性等[3]。由多层界面包围的油滴的乳状液对pH 变化、加热、冻融、高离子强度等有更好的稳定性,可用于保护和控制食品营养成分释放。
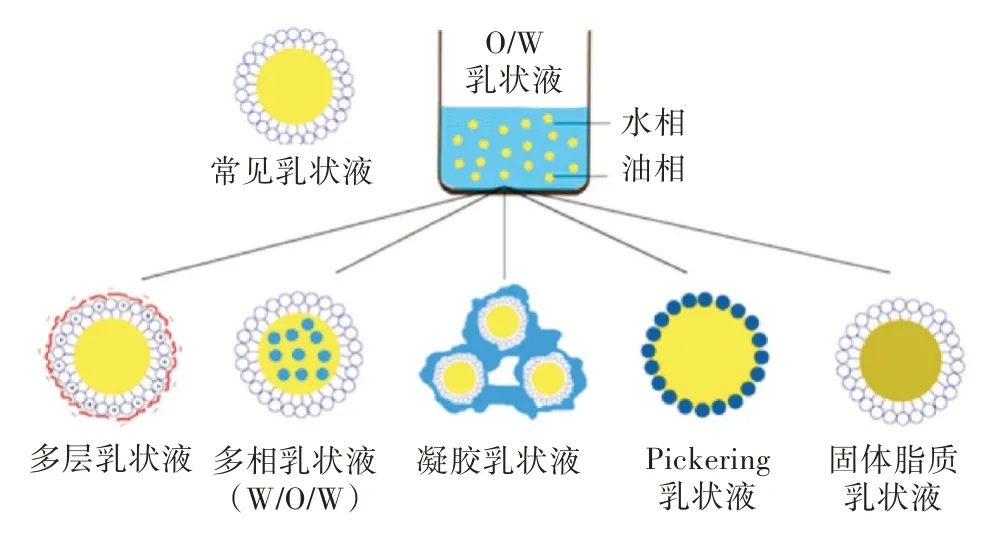
图4 乳状液的种类
3.1.1 多层乳状液的形成 多层乳状液的形成是通过逐层组装法(Layer-by-Layer,LBL)形成的(图5)。LBL 技术通常包括2 个或2 个以上的层吸附步骤,首先1 个带电乳化剂(如蛋白质或卵磷脂)沉积在液滴表面;然后1 个相反电荷的乳化剂(如蛋白质和十二烷基硫酸钠)或聚合物(如多糖)被先前吸附的界面层所吸附,形成第2 层[27]。由于吸附过程主要是由静电力驱动的,乳液体系的pH 对多层膜的形成和性能起着至关重要的作用。对于许多生物聚合物(特别是蛋白质),溶液的pH 决定了表面基团的电荷,也决定了表面电荷的正负和多少[28]。因此,通常存在pH 临界值,能观察到吸附现象,而且pH 值也影响吸附饱和度。因此,可以通过调节pH 设计不同界面结构的乳液,例如界面层厚度(单层或多层)、致密度和电荷密度。离子强度对静电相互作用以及多层膜界面的形成和结构也有很大的影响[29]。在离子强度较高的乳液中,许多反离子聚集在液滴表面,聚电解质与液滴之间的静电相互作用的幅度和范围减小[30]。
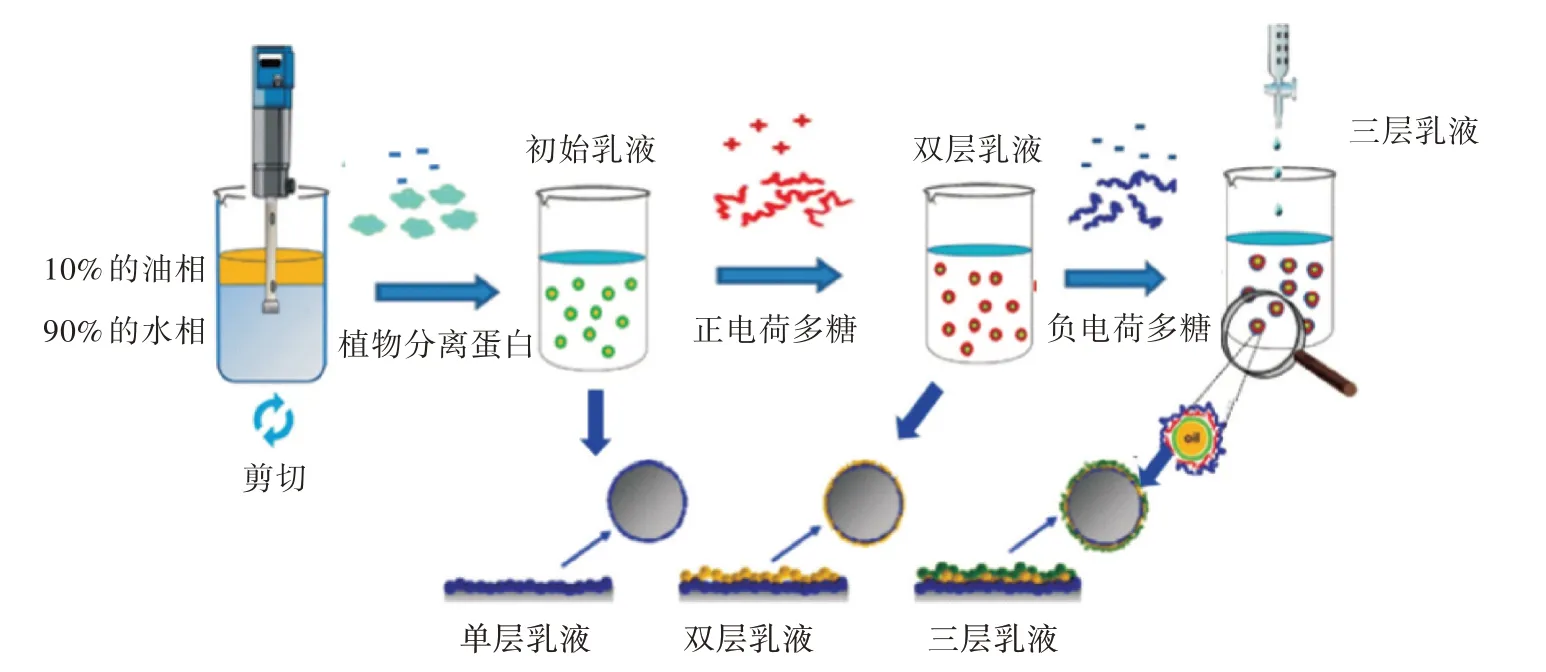
图5 多层乳状液的形成
3.1.2 多层乳状液的生理特性 多层乳状液的1 个主要优点是可以系统地控制包覆脂滴的界面层的性质,例如,它的组成、电荷、厚度、渗透性、流变性和环境响应性。可以通过在制备多层乳状液过程中控制系统组成和制备条件来实现,如乳化剂类型和浓度、电荷种类和强度、pH、离子强度、成分添加顺序和混合条件。系统地以合理的方式控制界面性质的能力使人们能够设计具有改进的稳定性或新的功能性能的多层脂滴。
在多层乳状液中,功能组分可以被包埋在油滴中或者被纳米层状涂层包裹。例如,在均质之前,可以在油相中加入疏水功能组分,而带电的亲水功能组分可以加入环绕脂滴的一个或多个聚电解质层中。然后将功能组分保留在多层乳液中,直到它们响应特定的环境刺激(如pH、离子强度或温度)能保持稳定,最后在预定的作用部位释放,从而实现靶向释放。可以通过界面层设计来实现,使其渗透率或完整性按照明确的方式响应环境的变化。
影响多层乳液特性的因素包括液滴特性(如尺寸和密度)、溶剂质量(如介电常数)、乳化剂和吸附聚合物的性质。加工条件(均质压力)和乳化剂浓度也会影响界面层的性质和液滴大小,因此可以对生物活性化合物的化学稳定性产生重大影响。此外,工艺条件和乳化剂浓度是脂质消化率和生物利用率的重要决定因素。王迪等[11]指出,β-胡萝卜素和游离脂肪酸在酪蛋白酸钠溶液中释放的生物利用率随初始液滴直径的减小而增加。研究表明,降低液滴直径(通过增加均质压力)导致表面积增加,更容易获得脂肪酶来促进水解。由于大型多胞体不能像小型多胞体那样被消化,胶束中β-胡萝卜素的含量随液滴大小的增加而减少。
当多层乳状液被消化时,形成的多层乳状液可以对不同的消化液作出不同的响应,并可以调节营养素的消化。Jukkola 等[31]研究发现,β-乳球蛋白-果胶多层膜可作为风味化合物的传递系统。口腔模型中测试了风味释放,在模拟口腔条件下,观察了β-乳球蛋白稳定的乳化液的zeta 电位和粒径的变化[5]。多层乳状液释放的风味物质比单层乳状液释放的风味物质少,例如β-乳球蛋白-果胶多层乳状液可用于传递挥发性风味物质。当调节pH 时,果胶可以从界面分离,油滴迅速聚集,导致香精释放速率和释放强度提高。
3.2 复合乳状液
在复合乳状液中,分散相含有较小的分散液滴(图4),如水包油乳状液(W/O/W)和油包水乳状液(O/W/O),油水界面和水油界面存在不同的界面层[21]。
3.2.1 复合乳状液的形成 由于存在2 个热力学不稳定的界面,具有较高稳定性的复合乳状液比传统乳状液更难制备。通常采用两步均相法制备复合乳液,首先制备内相W/O(或O/W)乳液,然后将其分散到外相(水或油)中。第二次均质通常在较温和的条件下进行,以预先排气破裂内部乳化液滴。还有一步法工艺,以简化复合乳状液的生产,其中亲脂性和亲水性乳化剂原先分散在水相或油相中,然后再混合。然而,一步法工艺通常需要严格选择乳化剂,乳化剂易于液滴聚结,限制了乳化剂的广泛应用。
3.2.2 复合乳状液的生理特性 复合乳状液包含2个水(或油)相,延长了活性物质在内分散相中的扩散长度,导致释放速率降低和包埋效率提高。此外,它可能会使控制释放的亲水性和亲脂性成分在一个单一的系统。在W/O/W 乳液的内水相中加入亲水性化合物可以显著地提高稳定性。W/O/W 乳液可用于减肥,在保持乳制品黏弹性的同时替代乳脂,因为油相的含油量可被内部水相部分代替。
体外消化试验表明,复合乳状液中的活性成分通常具有延缓释放的作用,其释放受到内外液滴结构的影响。Mcclements 等[7]用W/O/W 复合乳状液包埋甜菜红蛋白酶,发现甜菜红蛋白酶在肠道中的释放相当缓慢。在溶出初期(0~2 h),内水相和油相的液滴尺寸均有所增大。由于油相的消化和消化产物的增溶作用,油相中的油滴聚结较快。与此同时,水相中的甜菜红蛋白酶迅速从薄弱的油层中释放出来。然而,随后的消化(2~3 h)释放量的明显减少,消化3 h 后释放停止。研究发现是由于形成了大的液滴聚集体,进而抑制了脂质的消化和甜菜红蛋白酶的释放。研究证实,液滴大小的变化和甜菜红蛋白酶的释放主要是由于存在胆汁盐和脂肪酶[12]。陈浩等[32]研究表明,油滴大小对内水相亲水营养物消化的影响较大,由于脂肪酶不能很好地水解较大的油滴,与较大的油滴相比,含有较小油滴的乳状液释放的化合物较少。对于较小的油滴,油相的释放和水解以及亲水化合物的释放开始比较快。经过一定的消化时间后,液滴聚结导致液滴大小增加,并抑制脂质的进一步水解和活性成分的释放。在这2 项研究中,双乳状液结构在整个消化过程中被保留。然而,当广泛的聚结发生时,内水相与外水相融合,将W/O/W 乳状液转化为简单的O/W 乳状液,包含在内部水相中的营养物质被完全释放。研究还发现,在W/O/W 乳液中,胃中液滴分布不变,只有在模拟肠道中消化后,才能观察到乳液结构和营养物质释放的变化。这些研究表明,改变油相的液滴大小可以调节亲水化合物在消化过程中在内水相中的释放(强度、速度、位置等)。
将W/O/W 乳液应用于益生菌制剂,结果表明该复合乳状液结构有助于保护益生菌免受胃液和胆盐的侵害[33]。在胃液中,经1.33 h 消化后,乳酸菌的活力迅速下降,琼脂平板上未检测到菌落,而W/O/W乳剂内相中的细菌对酸性环境有抵抗力,经2 h 消化后,49%的细菌存活。研究还发现,W/O/W 乳状液中的细菌活力受到内相比和油滴大小的影响。同样,在W/O/W 乳状液内相中添加不同浓度的细菌,细菌的存活率也较高。W/O/W 乳剂中细菌的存活率与胆盐浓度无关,而未经处理的细菌(直接分散在胆盐溶液中)的存活率随胆盐浓度的增加而降低[11]。
3.3 凝胶乳状液
在凝胶乳状液中,油滴被包裹在凝胶颗粒中,凝胶颗粒起屏障作用,减缓所包含化合物的传质和扩散。凝胶颗粒可以在特定的环境条件下分解,控制油滴内部营养物质的释放[34]。
3.3.1 凝胶乳状液的形成 凝胶乳状液的制备可分为2 个步骤,一是通过均相化制备普通的O/W 乳液,二是通过调节pH、盐浓度、温度、添加酶或施加机械力使乳液与生物聚合物溶液混合。一般来说,凝胶乳状液可分为2 类,在一类凝胶中,油滴不与凝胶网络相互作用,例如,含有海藻酸钙、果胶、明胶、淀粉的乳状液[35];在另一类凝胶中,油滴表现为活性填料,油滴参与凝胶网络的发展,例如,水相中具有蛋白质凝胶网络的蛋白质稳定乳状液(也称为填充蛋白凝胶)。
3.3.2 凝胶乳状液的生理特性 在食品工业中,凝胶乳状液已被用于脂肪酸、鱼油、香精油等传递输送系统。一方面,凝胶网格中的营养物质是从外部环境中分离出来的,如光、氧和酶,它们通常具有更好的化学稳定性[36]。另一方面,可以得到合适的凝胶结构,包括组成、尺寸、硬度、渗透性,允许混合营养素的控制释放[19]。由于凝胶结构可以设计成对环境压力(pH、盐、温度、酶等)有不同的响应,也可以实现靶向释放。
生物聚合物凝胶化颗粒是一种包裹着含有香料的油滴。由于香味分子通过凝胶颗粒的传递速度减慢,口腔中最初的香味释放量减少。通过改变乳液的液滴尺寸或油相体积,可以改变乳液的释放行为。当凝胶以受控的生理触发方式被分解时,例如机械力、熔化和酶处理,得到缓释香味的释放曲线。例如,当淀粉凝胶被α-淀粉酶破坏时,明胶化苋菜红直链淀粉胶乳中的香味释放速度比明胶化小麦淀粉胶乳中的香味释放速度快。凝胶的风味释放与口服过程中油滴的释放密切相关,而油滴大小的变化可以控制风味的释放。对口服过程中乳化蛋白凝胶行为的研究表明,即使在较强机械加工条件下,油滴的释放量也随着液滴大小的增加而增加,而且小油滴与凝胶基质的结合更加牢固。在胃消化条件下,由于油滴从凝胶基质中释放出来,导致胃排空率降低,凝胶中发生严重的聚结和相分离。蛋白质在小油滴凝胶中的消化速度较慢,可能是因为油滴对凝胶结构的作用较大,限制了胃蛋白酶进入蛋白质的水解部位。这些凝胶最后被分解成肽聚集体和游离油[37]。研究发现,通过模拟胃液或模拟肠液,含有α-生育酚的凝胶乳状液的释放主要通过蛋白质降解引起的基质侵蚀来控制。结果表明,由于胃液中蛋白酶的含量较高,凝胶在胃液中的失重速率明显快于在肠道。然而,当凝胶在胃肠消化液中消化一段时间后,所有的生育酚在最后释放[38]。生育酚与油滴结合释放,油的释放可以通过改变颗粒大小和油含量来调节控制。
蛋白质和多糖通常同时用于控制食品的结构、质构和稳定性。这些混合物可以根据双寡头聚合物的特性和环境条件提供不同凝胶结构类型的凝胶体系。Xuan 等[39]认为蛋白质-多糖微凝胶有助于提高食品基质的保水性,改善其流变学特性和结构效应,其也可以作为胶囊和生物活性物质的递送系统。蛋白质微凝胶也被作为替代胶体成分,用于稳定食品乳剂和泡沫。微凝胶可以取代脂肪,模仿一些性能优良脂肪的特点,如脂滴的外观、口感和纹理。静电凝胶的强持水能力也可提供新的风味传递,并可能控制食品的多汁性。在未来,需要更多的工作来验证静电蛋白质多糖水凝胶形成的微凝胶,并确定其在各种食品系统中的功能。
3.4 Pickering 乳状液
Pickering 乳状液(皮克林乳状液)是由固体粒子稳定的O/W 或W/O 型乳状液。具有与传统乳状液相似的理化性质,在多数情况下,可以用来替代传统乳状液,特别是在不使用表面活性剂的情况下[40]。
3.4.1 Pickering 乳状液的形成 用于形成Pickering乳液的固体颗粒不需两亲性,而且颗粒被水和油相部分润湿可以使颗粒在油-水界面上强力锚定(图4)。Pickering 乳状液的界面在物理特性上更加坚固,它们能够提供足够的空间斥力来抑制液滴聚合。为达到有效的稳定的Pickering 乳状液,最好使用比乳液液滴小1/4 数量级的固体颗粒[41]。不同类型的二氧化硅被广泛用于生产Pickering 乳状液,在食品工业中,纤维素纳米晶体[42]、甲壳素纳米晶体[42]、淀粉颗粒[42]和类黄酮混合物[43]已被证明是合适的Pickering 稳定剂。实际上,固体颗粒通常与小分子表面活性剂结合使用,以便在均质过程中更快地降低界面张力,使固体颗粒在界面上得到更好的吸附。
3.4.2 Pickering 乳状液的生理特性 由于Pickering乳状液具有良好的物理稳定性,作为营养物质的递送系统受到了广泛的关注[42]。虽然颗粒之间的间隙可以提供脂解酶进入的途径,但由于颗粒存在液滴表面,可供脂肪酶结合的面积显著减少。
Julia 等[33]采用脂肪晶型W/O 乳液来控制盐的释放。Frasch-melnik 等[44]研究表明,在1 个月的储存后,从Pickering 乳状液中释放出的总盐不到5%,而从表面活性剂稳定的乳状液中释放出的盐超过40%。固体颗粒的释放与颗粒界面结构密切相关,选择合适的乳化剂可以控制固体颗粒的释放。当Pickering 乳状液作为敏感成分的载体时,可以用来提高活性成分的化学稳定性。Wang 等[45]研究发现,与传统乳状液相比,添加淀粉颗粒稳定的O/W 乳状液对姜黄素的抗氧化性能有更好的保护作用。在淀粉酶处理时,乳化剂不稳定,释放姜黄素。在二氧化硅纳米颗粒稳定的Pickering 乳状液中,姜黄素在模拟胃环境中相当稳定(消化36 h 后保留80%)。在模拟肠道环境中,由于表面电荷丧失,乳化液滴迅速聚集,导致姜黄素快速释放(包封姜黄素60%以上的释放时间为2 h)[46]。液滴表面的二氧化硅颗粒可以起到屏障作用,阻止胆盐置换(如蛋白质),从而降低脂肪酶的活性。
Pickering 乳状液在消化液中的稳定性可以通过加入多糖来调节[47]。乳铁蛋白纳米颗粒稳定的乳状液对唾液很敏感,在唾液处理后,体积增大,发泡率提高。添加海藻酸钠可以减缓颗粒大小的变化,但不能抑制乳化[41]。卡拉胶在Pickering 乳状液中参与延缓乳化,但不能阻止液滴聚集。在胃中,乳铁蛋白稳定乳状液相当稳定,但海藻酸钠或卡拉胶的存在导致絮凝显著。
通过使用乳铁蛋白纳米凝胶颗粒,证实了蛋白质颗粒与蛋白质单分子层之间的胃黏膜稳定性,当乳铁蛋白纳米凝胶颗粒与另一种对酶无反应的多糖颗粒(菊糖纳米颗粒)静电复合时,稳定性进一步增强。当乳铁蛋白纳米粒与海藻酸钠、卡拉胶等多糖复合时,其动力学稳定性得到改善。
在肠道消化阶段,蛋白质微凝胶颗粒-稳定界面的消化在连续消化和单纯胆盐-脂肪酶(无蛋白酶)消化2 种情况下存在明显差异[39]。连续的胃和肠消化,白色颗粒物质(WPM)和乳清蛋白单分子层在界面上的存在并不影响游离脂肪酸的释放速度或程度,因为游离脂肪酸释放是一种蛋白质水解主导的脂肪消化现象。载乳铁蛋白纳米粒子的界面也类似,游离脂肪酸的释放程度或速率与乳铁蛋白单分子层在液滴表面的释放程度相似,这可能与含有蛋白水解酶残留的胰脂肪酶的蛋白水解作用有关。与单纯脂肪酶相比,脂肪酶对蛋白质微凝胶颗粒-稳定界面的游离脂肪酸的释放量减少了2/3,初始消化率明显提高。这表明胆汁盐无法从界面取代完整的非蛋白溶解的WPM。大部分表面不能用于脂肪酶/辅脂肪酶复合物的吸附,降低了游离脂肪酸的总体利用率。Pickering 颗粒层为半透水,胆盐和脂肪酶作为小分子可以通过微凝胶稳定界面的缝隙进入界面,但胆盐不能取代微凝胶颗粒,因为WPM 与界面结合很强。
佟臻等[19]利用水不溶性和缓慢的蛋白酶诱导玉米醇溶蛋白粒子的消化率来制备Pickering 乳状液。利用胃/肠蛋白酶完全或部分水解玉米醇溶蛋白颗粒,使脂肪酶进入内脂核。溶剂沉淀法制备的玉米醇溶蛋白微粒壳溶解速率和溶解程度显著降低。使用与单宁酸结合的醇溶蛋白-羟基磷灰石颗粒可以作为替代方法,在恶劣的胃环境中保护Pickering 乳状液液滴,有助于在体外肠道消化过程中减少游离脂肪酸的释放[43]。类似的Pickering 层方法也被用于醇溶蛋白,富含醇溶蛋白的蛋白质与类黄酮(原花青素)结合,能减少游离脂肪酸释放的程度。
3.5 固体脂质颗粒
有些乳状液中含有完全或部分凝固的脂相,这种油粒称为固体脂质颗粒。固体脂质颗粒是水包油乳剂,其中脂质相被固体脂质或固体脂质混合物完全或部分脂化,在这类纳米系统中常使用的油脂包括向日葵油和棕榈油[48]。
3.5.1 固体脂质颗粒的形成 为了制备固体脂质颗粒,先制备传统乳状液,然后冷却使脂质结晶。与胶凝乳状液中的油粒不同,固体脂质粒分散在液体水相中,颗粒内部具有晶体结构。为获得具有不同特性的乳液,可以通过调节温度来控制脂质晶体的形态和堆积。类似凝胶乳剂,固体脂质颗粒存在物理屏障,阻止混合物质转移,并防止来自外部的物质进入。此外,固体脂质颗粒比液体油滴更不容易被脂肪酶消化,可以用来开发低热量食品。固体颗粒可以在一定的温度下熔化,从而控制营养物质的释放。
与传统乳状液和纳米乳状液一样,固体脂质颗粒可以用低能或高能的方法形成,大多数在食品工业中使用的固体脂质颗粒用高能量方法制备。在存在水溶性乳化剂和温度明显高于脂相熔点的条件下,油相和水相逐渐均匀化[42]。形成O/W 乳状液或纳米乳状液,在升温下油脂成为液体。在控制的条件下(如冷却速度和保温温度)冷却乳状液,使部分或全部油脂结晶。在均质过程中,乳化液温度必须保持高于油脂结晶温度,否则会堵塞和损坏均质阀。脂滴的理化稳定性及其内部空间结构通常由脂质成分、液滴浓度、液滴尺寸、过滤剂类型、改进晶体添加剂和冷却条件决定[42]。在固体脂质颗粒中可以产生各种不同的内部结构,例如,均匀的晶体结构、核壳结构或晶体分散体。此外,还可以控制液滴中不同相的相对位置[49]。
3.5.2 固体脂质颗粒的生理特性 固体脂质颗粒具有类似于纳米乳状液的特性,由分散在水介质中的乳化剂包裹的脂质颗粒组成。固体脂质颗粒中的脂相完全凝固或部分凝固,能控制脂相中晶体的结构、位置和积聚,以获得特定的功能。与乳状液或纳米乳状液一样,脂滴的大小和浓度以及脂相周围界面涂层的性质(如电荷、厚度、渗透性和环境响应性)可以不同。这为设计具有不同功能的系统提供了相当大的空间。
脂滴中脂肪晶体的结构和空间组织对于设计用于包裹、保护和输送亲脂性成分的固体脂质颗粒具有重要意义。例如,在某些应用中,将亲脂性成分定位在核心内(远离任何亲水性反应物质)有益,而在其他情况下,将其定位在靠近液滴表面(以促进其释放)可能更为重要[49]。2 个或2 个以上具有不同熔点的脂类被用于在固体脂质颗粒中形成特定的微观结构,如纯化的甘油三酯、复杂的甘油三酯混合物、蜡或脂肪酸的混合物。利用多种脂质而不是单一脂质,通常会增加负载能力和保留封装亲脂性成分,因为它们可以更好地适应更不完善的晶体结构形成。用于稳定脂滴的乳化剂的性质在特定的内部结构方面也很重要。某些表面活性剂的尾基作为基质,促进位于油-水界面的脂质内成核,即异相表面成核。这一特性可用于形成具有固体外壳和液体内核的核壳粒子。亲脂性成分通常在最低熔化温度以上约10 ℃溶解或分散在脂质相中。在亲水乳化剂的存在下,将热脂相与热水相均匀化,生成水包油乳状液,以可控的方式冷却,可以促进脂质结晶。
固体脂质颗粒中的营养成分具有较高的生物利用率。采用均质蒸发技术制备了蛋白质稳定的固体脂质纳米粒,在纳米粒传递系统中Caco-2 细胞对β-胡萝卜素的摄取明显高于游离β-胡萝卜素。根据蛋白质类型(酪蛋白酸钠、乳清分离蛋白和大豆分离蛋白),摄取量可以增加1.7~3.4 倍[50]。不同粒径颗粒的粒径差异是造成吸附量不同的主要原因。其次是纳米颗粒,可以直接穿过上皮细胞层,改变吸附量。由于纳米粒子的表面电荷(带负电荷)影响了纳米粒子对细胞的渗透,可以通过改变纳米粒子的表面电荷来调节纳米粒子的摄取量。研究人员将功能分子包裹在脂质体中进行体外消化,提高其生物利用率。姜黄素是疏水性多酚类化合物,其在脂质体体系中得到了广泛的研究[51]。
4 小结
乳状液递送系统可用于控制胃肠道中LPBC 的消化和释放。多层乳状液、复合乳状液、凝胶乳状液、Pickering 乳状液和固体脂质颗粒等乳状液传递系统通过改变液滴粒径分布、初始乳化剂类型、油相和水相组成,达到控制油脂消化的速度和程度,效果明显优于传统乳状液,但组成更复杂且不稳定。
本研究介绍了乳状液的种类和结构,以及其在消化过程中的行为和营养传递。在消化道中,乳状液暴露在复杂的生理环境中,常发生乳状液失稳,从而影响乳状液的功能性。通过对乳状液的结构进行精心设计,可以实现LPBC 的靶向输送和定向释放,获得更高的生物利用率。同时,通过设计合适的乳状液(如多层乳状液)可以获得具有特殊功能和特殊用途的乳液。控制LPBC 消化和释放的传递系统的设计方面进展迅速,但仍需进一步研究。

