产壳聚糖酶微生物菌株选育研究进展
许炎芬,贾子民,段先莉,龙 同,李文静,赵锦芳
(1.湖北工业大学发酵工程教育部重点实验室,武汉 430068;2.湖北省农业科学院生物农药工程研究中心,武汉 430064;3.湖北省农业科学院植保土肥研究所/农业农村部华中作物有害生物综合治理重点实验室,武汉 430064)
壳聚糖俗称为甲壳胺,是甲壳素脱去部分N-乙酰基的产物,是地球上存量仅次于纤维素的天然高分子聚合物[1]。壳聚糖酶(Chitosanase)是水解壳聚糖生产高活性壳寡糖(Chitooligosaccharides,COSs)所需的关键酶。壳寡糖具有独特的生理活性和功能,可提高机体免疫力、抑制肿瘤细胞生长、在人体肠道内可活化增殖双歧杆菌、降低血压,同时还具有抗菌防腐、保水保湿等性能,在食品和生物医药行业具有广阔的应用前景[2]。
制备壳寡糖的方法主要有物理法、化学法和酶解法。与传统的物理化学方法相比,酶解法制备壳寡糖具有明显优势。1973 年,Monaghan 等[3]研究了来源于微生物的壳聚糖酶,能够降解接合菌Zygomycete 的细胞壁,随后,大量细菌和真菌被发现产壳聚糖酶。在一些植物组织和病毒中也存在壳聚糖酶,主要以内切方式催化水解部分乙酰化壳聚糖中的β-1,4-氨基葡萄糖苷键,得到特异分子量范围的壳寡糖。其专一性较强,来源不同,酶学性质也不相同。
天然菌种的产酶能力较低,研究人员通过筛选高产菌株、基因工程改造等方法获得高产突变株,优化微生物的发酵条件,提高产酶能力和酶活。
1 壳聚糖酶来源及其性质
1.1 细菌来源
产壳聚糖酶细菌研究较多,主要种类为芽孢杆菌属(Bacillus)、沙雷氏菌属(Serratia)、紫色杆菌属(Janthinobacterium)、多黏类芽孢杆菌(Paenibacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和微杆菌属(Microbacterium)[4]。细菌来源壳聚糖酶及其部分酶学性质见表1。
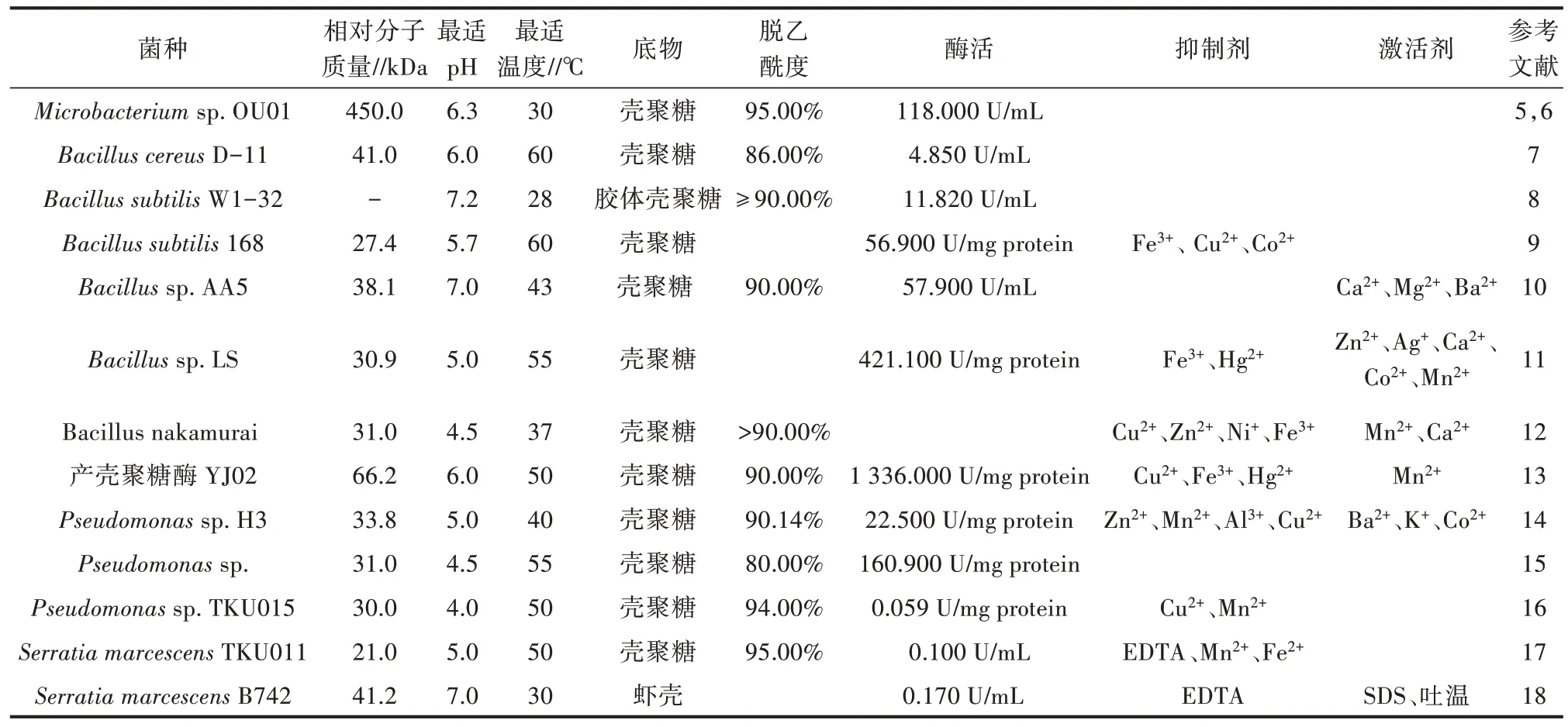
表1 产壳聚糖酶细菌及其部分酶学性质
壳聚糖酶是一种差异较大的糖苷水解酶,微生物产生的壳聚糖酶可以分为2 种类型——组成型和诱导型。绝大多数细菌来源的壳聚糖酶为诱导型,其分子质量一般较小,在20~75 kDa。大多数壳聚糖酶的较适pH 小于6.5,偏酸性的环境有利于保持壳聚糖酶的活性。壳聚糖酶的较适反应温度范围在30~60 ℃,温度过高,引起酶变性失活;温度过低,酶反应速率低。不同菌属来源的壳聚糖酶受金属离子的影响不同,金属离子Fe3+、Cu2+一般会抑制壳聚糖酶活性,Ca2+、Mn2+是壳聚糖酶的促进剂。此外EDTA 也被证实会抑制该酶的活性,而SDS、还原剂等对提高酶活有一定的促进作用。
1.2 放线菌来源
产壳聚糖酶的放线菌有链霉菌属(Streptomyces)、类诺卡氏菌属(Nocardioides)和拟无枝菌属(Amycolatopsis)。链霉菌属研究较多,主要集中于壳聚糖酶基因的克隆、定点突变及异源表达。Ding等[19]通过密码子优化技术获得了Streptomycessp.N174 GH46 家族壳聚糖酶基因的突变株,将野生株和突变株的Csn46 分别在毕赤酵母Pichia pastorisGS115 中表达,经5 L 发酵罐中高密度发酵,野生株壳聚糖酶活为50 000 U/mg,突变株酶活为30 784 U/mg,比野生菌株酶活性降低了40%。野生菌株和突变株壳聚糖酶最适pH 是均为6.0,最适温度为50 ℃。王剑等[20]对浅玫瑰色链霉菌Streptomyces roseolusDH 壳聚糖酶发酵工艺进行研究,接种量3%,搅拌转速250 r/min,通气比vvm 2.0 m3/(m3·min),经52 h 发酵,酶活达到最大,为35.2 U/mL。采用补料工艺发酵,酶活在60 h 达到最大,为46.4 U/mL。Wang 等[21]表达海洋链霉菌Streptomyces hygroscopicusR1 壳聚糖酶基因ShCsn46,得到的重组菌株壳聚糖酶最大活性为2 250 U/mL,总蛋白浓度为3.98 g/L。纯化后的ShCsn46 的最佳pH 为5.5 ℃,最佳温度为55 ℃。纯化后的ShCsn46能被Mn2+活化,被Cu2+、Fe2+和Al3+抑制。
Akihiro 等[22]通过反向遗传技术克隆了拟无枝酸菌属Amycolatopsissp.CsO-2 的壳聚糖酶基因ctoA,其分子质量为27 kDa,并成功在大肠杆菌Escherichia coli中表达。CtoA 对米根霉(Rhizopus oryzae)具有抗菌活性。
1.3 真菌来源
真菌产生的壳聚糖酶有组成型酶和诱导型酶,其中诱导型酶占主导。组成型壳聚糖酶主要来源于植物病原真菌Fusarium solani,在培养基中不添加壳聚糖也能分泌壳聚糖酶。真菌壳聚糖酶按作用方式分有内切酶和外切酶2 种。内切酶即壳聚糖酶(E.C.3.2.1.132),属于GH75 家族,水解壳聚糖生成壳寡糖,外切酶指外切-β-1,4-D-氨基葡糖苷酶(E.C.3.2.1.165),属于GH2 家族,外切产物为氨基葡萄糖[23]。来源于真菌的壳聚糖酶有白僵菌属(Beauve-ria)、绿僵菌属(Metarhizium)、曲霉属(Aspergillus)、青霉属(Penicillium)、木霉属(trichoderma)、镰刀菌属(Fusarium)、毛霉属(Mucor)、紫孢菌属(Micromonospora)、接合菌属(Gongronella)等。
1.3.1 白僵菌属 方祥年等[24]以球孢白僵菌Beauveria bassiana1316 为出发菌,通过紫外诱变筛选出5 株高产壳聚糖酶的菌株,最高酶活为2.32 U/mL,为原始菌株的16 倍。Liu 等[25]成功克隆了球孢白僵菌的壳聚糖酶基因BbCSN-1,并在毕赤酵母中进行了表达。经甲醇诱导后,酵母发酵液中BbCSN-1的含量在6 d 达到最大值,为398 μg/mL。纯化后的BbCSN-1在pH 5.0 和30 ℃时活性表现最佳。金属离子Mn2+能显著提高该酶的活性,而Co2+和Cu2+则能显著抑制其活性。
1.3.2 绿僵菌属 刘桦等[26]等利用正交试验得到金龟子绿僵菌Metarhizium anisopliaeAS3.4606 固态发酵产壳聚糖酶的最佳条件为起始pH 5.0、27 ℃下培养120 h,C/N 为1∶4、固液比为1.0∶1.4,绿僵菌发酵产壳聚糖酶最大酶活为35.08 U/g 干培养基。杨俐等[27]研究贵州绿僵菌固态发酵产壳聚糖酶,经120 h 发酵后,酶活达到83.09 U/g 干培养基,利用交联壳聚糖树脂亲和层析、Cu2+洗脱和分子筛分离的方法得到电泳纯的壳聚糖酶,酶活回收率为43.52%。
1.3.3 曲霉属 曲霉壳聚糖酶的研究主要集中在2个方面,一方面通过传统方法进行高产菌株的筛选及发酵条件的优化,另一方面是克隆曲霉壳聚糖酶基因并进行高效表达。
阎贺静等[28]对烟曲霉Aspergillus fumigatusWHSW-01 产壳聚糖酶的条件进行优化,在基础培养基(基础碳源为1%的葡萄糖)发酵至12 h 时,添加占发酵液总体积40%的壳聚糖水解液,产酶量最高为6.78 U/mL,与前期烟曲霉WHSW-01 基础培养条件下最高酶活3.7 U/mL,提高了83.24%章晔敏等[29]采用响应面法对鹿皮曲霉Aspergillus cervinus ZJOU-AC1 产壳聚糖酶的发酵条件进行优化。得到最佳发酵条件为胶体壳聚糖1.5%、(NH4)2SO40.4%、KH2PO40.2%、MgSO40.05%、麸皮2%、Tween-80 0.06%,发酵温度30 ℃,初始pH 5.9,接种量为3%。经96 h 发酵,壳聚糖酶酶活为8.26 U/mL,是优化前的4.03 倍。
Eom 等[30]采用离子交换色谱和凝胶过滤色谱分离纯化了烟曲霉Aspergillus fumigatusKB-1 产生的2种壳聚糖酶。壳聚糖酶I 的分子质量为111.23 kDa,最适pH 为6.5,适宜温度为60 ℃;壳聚糖酶Ⅱ的分子质量为23.38 kDa,最适pH 为5.5,适宜温度为70 ℃。
陈小娥等[31]分离纯化了曲霉Aspergillussp.CJ22-326 内切壳聚糖酶ChiB,并对其性质进行研究,该酶最适温度为65 ℃,最适pH 为6.0,1 mmol/L Mn2+对ChiB 有强烈激活作用,2 mmol/L Cu2+、Ag+、Hg2+、Cd2+、Fe3+有强烈抑制作用。ChiB 作用的最适底物为脱乙酰度95%的胶体壳聚糖。李松林等[32]采用RACE 方法扩增出曲霉菌CJ22-326 内切型壳聚糖酶基因,在大肠杆菌中表达,利用Ni2+-NTA 柱纯化得到融合蛋白,SDS-PAGE 检测蛋白酶相对分子量为29 kDa。纯化后的酶在37 ℃,pH 为6.0 时,酶活达到1.18 U/mL。
Chen 等[33]克隆了烟曲霉Aspergillus fumigatus耐热型壳聚糖内切酶基因,在毕赤酵母GS115 中能高效表达。在14 L发酵罐高密度发酵,产率为3 mg/mL,酶活达25 000 U/mL。
1.3.4 青霉属 赵有玺等[34]探讨了接种量、装液量、摇瓶转速等对突变菌株淡紫拟青霉BJ2-3 产壳聚糖酶的影响,表明接种量8%、装液量125 mL(500 mL 三角瓶)、摇瓶转速180 r/min 最利于产酶。Aktuganov 等[35]研究青霉菌Penicilliumsp.IB-37-2A,以壳聚糖为主要碳源,主要产生胞外壳聚糖酶,有明显的抗真菌活性,从发酵滤液中纯化得到外切壳聚糖酶,该外切酶分子质量为41 kDa,最优pH 为4.0,最优温度为50~55 ℃,Hg2+和Ag+对酶活性有较强的抑制作用。Cao 等[36]从草酸青霉Penicillium oxalicumM2 发酵液中分离纯化了新型胞外壳聚糖酶,该酶分子质量为42 kDa,纯化后的最大酶活为60.45 U/mg。最优pH 为5.5,最佳温度为60 ℃,Ca2+、Mn2+、非离子表面活性剂(Tween 20/40/60/80 和Trition X-100)和部分常见还原剂(二硫苏糖醇、DTT 和β-巯基乙醇)对该酶具有显著的促进作用。
1.3.5 木 霉 属 刘 萍 等[37]从trichoderma virideXW01 发酵液中分离到一种壳聚糖酶,该壳聚糖酶的分子质量为45 kDa,最适作用温度为60 ℃,最适pH 为5.0,脱乙酰度对其催化速率影响显著,Mn2+、Mg2+、Ca2+、Zn2+对该酶有明显的促进作用,Fe3+、Cu2+和Hg2+对该酶有强烈的抑制作用,该酶以内切方式作用于壳聚糖,主要水解产物是四糖以上的壳寡糖。李淑瑞等[38]利用响应面方法优化绿色木霉液体发酵产壳聚糖酶的培养基,获得了最佳产酶培养基为Avicel 2.56%、玉米芯1.03%、麸皮0.5%、棉子饼粉4.79%、KH2PO40.2%、(NH4)2SO40.2%、CaCl20.03%、MgSO40.03%,最终发酵壳聚糖酶活为2.00 IU/mL。
Luis 等[39]研 究 哈 茨 木 霉(Trichoderma harzianum)、柯宁木霉(Trichoderma koningii)、绿色木霉(Trichoderma viride)和多孢木霉(Trichoderma polysporum)在固态发酵条件下产壳聚糖酶的能力,评价pH 和温度对酶活性的影响。结果表明,pH 对所有供试菌株的酶活性均有显著影响。当pH 为5.0 时,哈茨木霉壳和绿色木霉聚糖酶活性较高,当pH 为5.5 时,柯宁木霉聚糖酶和多孢木霉壳聚糖酶活性最高。酶活较适宜的温度为40~50 ℃。多孢木霉产壳聚糖酶的潜力大,酶活可达1.4 IU/gds,其后为绿色木霉(1.2 IU/gds)和T 哈茨木霉(1.06 IU/gds)。
1.3.6 镰刀菌属 刘怀伟等[40]采用RT-PCR 技术克隆Fusarium solani的壳聚糖酶基因,在大肠杆菌DE3 菌株中进行融合表达,纯化的壳聚糖酶比活性为2.5 U/mg。该酶在50 ℃时活性最大。将该基因与Kluyveromyces marxianus的INU1A 信号序列融合,在酿酒酵母中实现表达,壳聚糖酶酶活达到50.2 mU/mL。
1.3.7 毛霉属 何灏彦[41]对卷枝毛霉发酵产壳聚糖酶的条件进行优化,确定其最佳产酶条件为壳聚糖浓度0.8 g/L、培养温度40 ℃、培养基pH 5.5、培养时间84 h、摇床转速180 r/min。
1.3.8 紫霉属 张馨月等[42]采用单因素和响应面设计法确定了淡紫紫孢菌Purpureocillium lilacinumM7a产酶的最佳培养温度为33 ℃,初始pH 为6.0。
1.3.9 接合菌属 Zhou 等[43]研究Gongronellasp.JG,该菌发酵72 h壳聚糖酶活达到800 mmol/(min·L),得到的壳聚糖酶分子质量为90 kDa,比活性为82 mmol/(min·mg),Mn2+促进酶活,纯化出的28 kDa 壳聚糖酶Csn2 属于GH-75 壳聚糖酶,最佳pH 为5.6,最适温度为55~60 ℃,Mn2+、Ca2+和Sr2+促进酶活性,较高浓度的Cu2+(10 mmol/L)、ETDA 抑制其活性。用海藻酸钙和氯化钙固定化Gongronellasp.JG 细胞,当海藻酸钠20 g/L、氯化钙0.1 mol/L、接种量为10 mL 胶珠/100 mL 培养基、胶珠为2.7 mm,初始pH为5.5,温度为30 ℃时,壳聚糖酶的产量最大,产率为2 429 U/L,比游离细胞提高了60%[44,45]。
2 壳聚糖酶诱变菌株选育
壳聚糖酶产生菌株的筛选一般方法是以粉末壳聚糖为惟一碳源,用透明圈法平皿法初筛,用摇瓶发酵法复筛。自然界中的菌株,壳聚糖酶活性不高,主要通过诱变选育高产菌株,诱变方法有紫外诱变(UV)、亚硝基胍(NTG)诱变、Co60-γ 射线诱变、等离子体诱变、微波诱变及采用多种方法的复合诱变。
屠洁等[2]以Aspergillus fumigatusCX01 为出 发菌株,用紫外诱变选育出壳聚糖酶高产菌株4 株,最高酶活为0.955 7 U/mL,比出发菌株提高50.25%。王艳等[46]以假单胞菌Y8.0为出发菌株,用亚硝基胍(NTG)、Co60、UV诱变获突变菌株Y8,酶活达3.0 U/mL,提高6 倍,并有较好的遗传稳定性。胡远亮[47]以Mitsuariasp.141 为出发菌株,经紫外线和Co60-γ 射线诱变,选育到遗传稳定的菌株,酶活提高30.01%。熊妍妍等[48]以Aspergillus cervinusZJOU-AC1 为出发菌种,用冷源等离子体诱变,最佳诱变时间90 s,获得1 株稳定遗传的突变菌株,酶活提高50.7%。王俊芳等[8]以Bacillus subtilisG10 为出发菌,用紫外和微波复合诱变,选育出一株突变株,酶活为11.82 U/mL,是出发菌株的6.9 倍。
3 展望
壳聚糖酶可用于制备具有生物活性的壳寡糖和真菌原生质体,也可用于植物病原菌病的防治。随着对壳聚糖酶分子结构、作用机理研究的深入,应用更广泛。筛选出低成本、活性高、不同微生物来源的产壳聚糖酶菌株十分关键。壳聚糖酶菌株选育的研究仍将集中在4 个方面,一是复合诱变选育酶活性高、热稳定性好的菌株;二是采用基因工程方法构建壳聚糖酶高效表达工程菌;三是发酵条件优化和发酵工艺改进;四是深入解析壳聚糖酶酶学性质,研究分离纯化相关技术,获得有工业化生产潜力的菌株。

