娘母良通过抑制焦亡改善阿尔兹海默症小鼠的空间记忆能力
孟 恬 刘云宽 陈清华 李永华 贺永胜*
1.云南洛宇生物科技有限公司,云南 昆明 650000;2.云南中医药大学云南省傣医药与彝医药重点实验室,云南 昆明 650500;3.云南奕华农业生物有些公司,云南 昆明 650500
阿尔兹海默症(Alzheimer’s disease,AD)是一种进行性的神经退行性疾病,以记忆力下降、认知功能障碍、视觉空间损害、执行功能障碍、人格和行为改变等为临床特征[1]。娘母良(Polygala crotalarioides,佤文:Nya Miex Tiang)为佤族民间稀有珍贵药材。经考证及中科院鉴定(报告编号:KUN-2106-024),其属于远志科远志属的西伯利亚远志(拉丁学名:PolyaglasibiricaL.)。药理研究[2]表明,西南远志具有养心安神、抗疲劳、抗低温、抗缺氧、提高机体应激能力,提高机体对不良环境的适应能力等活性。本文通过AD 转基因鼠探索娘母良对AD的治疗作用,并初步探讨娘母良在AD模型中通过调节焦亡相关因子,对AD的治疗作用机制。
1 材料与方法
1.1 动物与试剂 12月龄清洁级野生型C57B1/6J-Sv129 雌性小鼠[体质量(20±5)g]以及12月龄清洁级半合子3xTG(APPswe,TauP301L和PS1M146V+/)雌性小鼠[体质量(20±5)g]购于美国杰克森实验室(JAX,美国缅因州);娘母良(Polygala crotalarioides)新鲜叶茎由云南奕华农业生物公司提供;Morris水迷宫:上海欣软研制;Aβ40、Aβ42Elisa 试剂盒购于酶联生物;Tunel荧光试剂盒购自博士德。
1.2 动物分组 将清洁级野生型C57B1/6J-Sv129 雌性小鼠分为对照组(n=12),清洁级半合子3xTG雌性小鼠随机分为3组(n=12):模型组,阳性对照组,娘母良组。对照组:C57B1/6J-Sv129小鼠连续24周进行生理盐水灌胃。模型组:3xTG雌性小鼠连续24周进行生理盐水灌胃。阳性对照组:Huperzine A粉末溶解于蒸馏水中,加入40 %体积的0.1 M盐酸5 mg/mL作为储备液,给药前用蒸馏水稀释,每天以0.1 mg/kg灌胃给药。娘母良组:从双江县(中国云南;地理空间坐标:99.844°E,23.514°N;海拔:1015.9 m)收集Polygala crotalarioides的新鲜叶茎,干燥后研磨成粉末备用,给药前使用羧甲基纤维素钠制备悬液,每天以 5 mg/kg 灌胃给药,连续24周[实验动物使用许可证号:SYXK(滇)K2021-0003]。末次给药次日进行Morris水迷宫实验,行为学检测后一周对动物进行脱颈处死,快速取脑组织。
1.3 Morris 水迷宫实验 Morris水迷宫实验用于评估动物的空间学习和记忆能力[3]。实验主要分为定位巡航实验以及空间探索实验两部分。首先进行水迷宫适应性实验。将小鼠随机从盛水的圆形水槽迷宫(直径100 cm,深60 cm,平均划分为东北,西北,东南,西南四个象限并做好定位标记)轻放入水中,记录动物找到水下平台的时间,若超过60 s 则引导动物寻找平台。让动物在平台上停留10 s。连续训练7 d,每天2次,选游泳能力好,能自主找到平台的动物进行后续实验。定位航行实验中,将动物随机按四个象限轻轻放入水中,将动物每次自入水直至找到目标象限平台并爬上平台的时间记录为逃避潜伏期(s)。正式试验第6天进行空间探索实验。实验前将平台撤走,随机选一个入水点将树鼩放入水中,记录到达隐藏平台的轨迹、总路程(mm)、总时间(s)。
1.4 ELISA检测Aβ40和Aβ42沉积 取适量小鼠海马区组织,采用酶联免疫吸附法(ELISA)检测其中Aβ40和Aβ42的浓度。将组织充分研磨制成组织匀浆,4 ℃,100,000g离心60min,取上清液根据ELISA试剂盒的说明进行检测。
1.5 TUNEL染色实验 脑组织切片脱蜡处理后一步法TUNEL细胞凋亡检测试剂盒避光37 ℃下孵育TUNEL染液1 h,荧光Ⅱ抗 Alexa Flour 488 避光室温下复染1 h,DAPI染液孵育5 min,抗荧光淬灭剂封片,荧光显微镜下成像。
1.6 Western blot 分离各组小鼠海马组织,使用RIPA 法对组织进行裂解。根据试剂盒说明使用BCA法测定蛋白浓度,蛋白变性后转膜至PVDF膜,5%的脱脂奶粉在室温下将膜封闭2 h后将表1中所示的一抗4 ℃下孵育过夜,二抗在室温下孵育1 h。使用ECL化学发光法显影,并通过ImageJ进行捕获。使用NIH Image J软件分析各条带的光密度。

表1 抗体信息
1.7 统计学方法 通过GraphPad Prism 5.0 软件(GraphPad Software, San Diego, CA)进行统计分析,正态分布的连续性变量均以平均数加减标准差(mean±SD)表示。组间比较采用t检测,多组间比较采用单因素方差分析。在图中以连线表示比较的组别,P<0.05为差异有统计学意义。
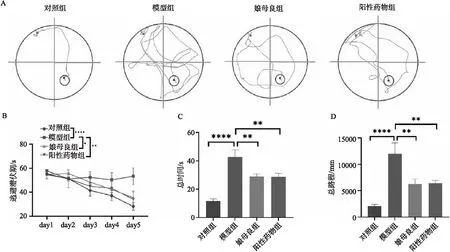
A.到达隐藏平台的轨迹;B.逃避潜伏期;C.总路程;D.总时间图1 娘母良改善AD模型小鼠空间学习和记忆能力图注:*P<0.05,**P<0.01,****P<0.0001
2 结果
2.1 娘母良改善AD模型鼠空间学习和记忆能力 模型建立成功后,首先对各组小鼠进行Morris 水迷宫实验。如图1B所示,各组小鼠的逃避潜伏期随学习天数的增加而逐渐降低。相比于对照组,模型组的逃避潜伏期明显升高(P<0.0001),且随学习天数的增加变化不明显,而娘母良组与阳性对照组小鼠的逃避潜伏期较模型组有明显下降,且随学习天数的增加而明显降低(娘母良组:P<0.05,阳性对照组:P<0.01)。行为学实验第六天进行的空间探索实验结果显示,相较于对照组,模型组到达隐藏平台的轨迹更为复杂冗长,而娘母良组与阳性对照组小鼠的轨迹明显有简化的迹象(图1A)。同样,如图1C-D所示,相较于对照组,模型组小鼠的总路程以及总时间均明显较高(P<0.0001)。娘母良组与阳性对照组小鼠总路程、总时间均有明显下降(P<0.01)。结果说明,娘母良有改善AD模型鼠空间学习和记忆能力的潜力。
2.2 娘母良改善AD模型鼠海马区神经细胞的凋亡 接下来,通过TUNEL 染色来验证各组小鼠模型神经细胞的凋亡。如图2所示,相对于对照组,模型组小鼠模型神经细胞的凋亡更为明显,而娘母良组与阳性对照组小鼠的神经细胞的凋亡有明显的改善。结果说明,娘母良对AD模型鼠的神经细胞的凋亡具有改善的作用。
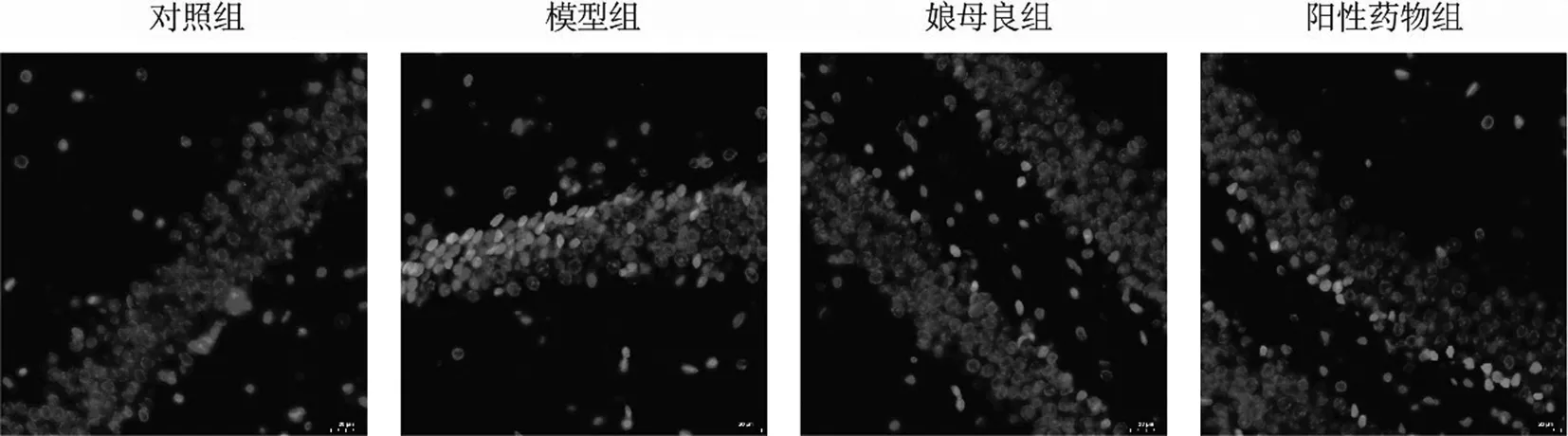
图2 娘母良改善AD模型鼠神经细胞的凋亡图
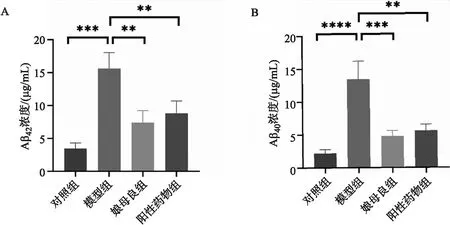
A.Aβ40浓度;B.Aβ42浓度图3 娘母良改善AD模型小鼠Aβ40和Aβ42沉积图注:**P<0.01,***P<0.001,****P<0.0001
2.3 娘母良改善AD模型鼠Aβ40和Aβ42沉积 通过Elisa来检测各组小鼠模型海马组织Aβ40和Aβ42浓度。如图3A,B所示,相对于对照组,模型组小鼠模型海马组织Aβ40和Aβ42浓度明显上升,而娘母良组与阳性对照组中小鼠的海马组织Aβ40和Aβ42浓度均明显下降。结果说明,娘母良对AD模型鼠海马组织Aβ40和Aβ42沉积具有改善的作用。
2.4 娘母良改善AD模型小鼠Tau蛋白异常磷酸化 Tau 蛋白以及磷酸化Tau蛋白的蛋白表达量通过western blot进行检测,并计算各组Tau蛋白磷酸化以及Tau总蛋白含量的比值(p-Tau/Tau)。如图4所示,相对于对照组,模型组小鼠模型海马组织中Tau蛋白磷酸化以及Tau总蛋白含量的比值(p-Tau/Tau)明显上升,而娘母良组与阳性对照小鼠的海马组织p-Tau/Tau均明显下降。结果说明,娘母良对AD模型鼠海马组织Tau蛋白的异常磷酸化具有改善的作用。
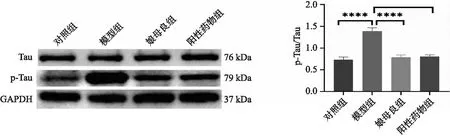
图4 娘母良改善AD模型小鼠Tau蛋白异常磷酸化图注:****P<0.0001
2.5 娘母良影响AD模型鼠焦亡因子表达 为了进一步研究娘母良对AD的作用机制,笔者通过western blot 检测了焦亡因子caspase1(p20)以及GSDMD-N的相对蛋白表达。如图5所示,相对于对照组,模型组小鼠模型海马组织中caspase1(p20)以及GSDMD-N的相对蛋白表达较高,预示焦亡的发生。而娘母良组与阳性对照组小鼠的海马组织caspase1(p20)以及GSDMD-N的相对蛋白均明显下降。结果说明,娘母良可抑制AD模型中焦亡的发生。
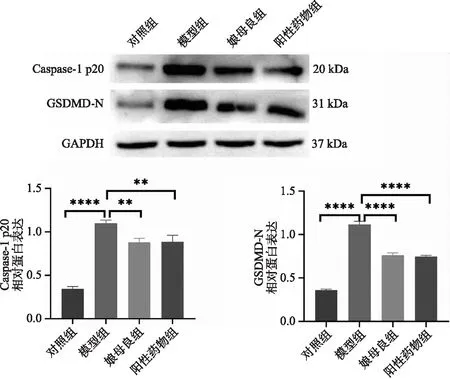
图5 娘母良影响AD模型鼠焦亡因子表达图注:**P<0.01,****P<0.0001
3 讨论
AD是一种进展缓慢的神经退行性疾病,始于轻度记忆丧失,最终导致严重的执行和认知功能障碍[4]。目前AD仍无法治愈,已有的抗AD药物仅能够延缓病理症状的加深,并不能有效阻止、逆转疾病过程,并且停药后易复发[5]。AD的机制涉及多种假说,主要包括β淀粉样蛋白( β-amyloid,Aβ)毒性、Tau 蛋白异常磷酸化和聚集、突触丢失、线粒体功能异常和氧化应激、胰岛素抵抗、神经炎症、血管内皮的损害等,但其具体发病机制仍然亟需探讨[6]。娘母良属远志科远志属多年生草本植物,喜生长于海拔900~1500 m 的红土向阳山丘,性温,味甘,具有补肾助阳、养心安神、祛痰解痉的功效[7]。《神农本草经》中记载,远志具有宁心安神的功效,治疗心神不安、惊悸、失眠、健忘等证。《药性论》中也有记载其“治健忘,安魂魄,令人不迷”[8]。宋代《圣济总录》中记载的远志散,由远志、石菖蒲、茯苓、人参、黄连5味药物组成,有益气化痰开窍、益智健脑的功效,可改善健忘、痴呆等记忆力减退病证[9]。同样,一些学者通过现代日益发展的科学技术同样证明了远志对于AD的治疗可能性[10-11]。本文的结果显示,娘母良可通过减少神经细胞凋亡,改善Aβ40、Aβ42沉积以及Tau蛋白异常磷酸化来改善AD模型鼠的空间学习和记忆能力。
焦亡是一种由炎症引起的程序性细胞死亡,主要由核苷酸结合寡聚化结构域NOD样受体(NLRs)的炎症体介导,并依赖于Caspase家族[12]。当发生焦亡时,炎症小体介导包含Caspase-1在内的多种Caspase的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,细胞发生穿孔,进而肿胀,直至细胞膜破裂,导致细胞内容物的释放,从而引发炎症的进一步恶化[13-14]。根据激活机制,焦亡可以分为caspase-1依赖性和非caspase依赖性途径[15]。这两种途径都是通过裂解Gasdermin-D(GSDMD)而激活的。GSDMD是焦亡的效应因子,因此可以释放N端成孔结构域,插入质膜,造成细胞穿孔,诱导质膜破裂,释放细胞内容物,包括白介素(IL)-1β和IL-18。近年来,焦亡在AD 疾病进程中的重要性吸引了越来越多人的关注。Shen 等[16]发现GSDMD在AD患者中的表达量增加,这可以作为诊断AD并区别于血管性痴呆的生物标志物。李泽等[13]证明喂食高脂饲料和APP/PS1基因均能加强小鼠脑内炎性反应,高脂饮食能够进一步加重痴呆小鼠神经细胞焦亡和神经损伤。Cai 等[17]证明了红景天苷在药理学剂量下可通过抑制NLRP3炎症体介导的焦亡改善AD的症状。本研究发现,娘母良可能抑制AD模型鼠中海马体内焦亡因子的表达,预示着娘母良可抑制AD模型鼠海马组织中神经细胞焦亡的发生。
综上所述,本文验证了娘母良对AD模型的治疗作用以及作用机理,并初步探讨了娘母良对神经细胞焦亡抑制的作用,为娘母良治疗AD的机制研究提供了一定的实验基础。为了更升入的探讨其机制,课题组将在接下来的研究中探讨更加有效的原料药的溶解方案,并进一步加大实验样本量和给药途径,研究药物的最佳用药剂量以及给药方式,以期多角度探索佤药娘母良的临床及科学研究价值。

