双能CT虚拟单能级成像显示胰周血管:与线性融合图像对照研究
梁洪伟 周 旸 张志伟 杜思霖 郑 桥 李信友 吕发金 李咏梅
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种预后不良的恶性肿瘤,是癌症相关死亡的第三大原因[1]。完全手术切除(R0)是唯一可能允许长期生存的治疗选择[2],而胰周血管是影响胰腺肿瘤手术切除和预后的关键因素。多层探测器计算机体层成像(multidetector computed tomography,MDCT)和薄层成像提供了常规的胰周血管显影。但对于血管显示欠清或对比剂充盈不佳的患者,双能CT(dual-energy CT,DECT)虚拟单能级成像(monoenergetic images,MEI[+])能在噪声增加不显著的情况下改善血管的可视化及图像的信噪比(signal-to-noise ratio,SNR)和对比噪声比(contrast-to-noise ratio,CNR),从而有助于肿瘤的分期[3-4]。本文旨在探讨与线性融合图像(polyenergetic images,PEI)相比,DECT MEI(+)成像对胰周血管显影的改善效果及寻找显示胰周血管和图像质量的最佳单能级。
方 法
1. 一般资料
选择2020年6—8月在本院接受腹部双能CT增强检查的45例患者。入组标准:①无胰腺疾病史;②无肝、胆、脾、胃恶性肿瘤;③无肝硬化、门静脉高压症;④无对比剂禁忌证。本研究经医院伦理委员会批准,所有患者均签署对比剂知情同意书。
2. 仪器与方法
使用第三代双源CT扫描仪(Somatom Force;Siemens Healthcare,Forchheim,Germany)。嘱患者禁食4~6 h,扫描前20 min口服清水500~600 mL,头先进完成仰卧位扫描,范围自膈顶至双肾下极。扫描时相包括平扫、动脉期、门脉期(胰腺实质期)。扫描参数:准直宽度128 mm×0.6 mm,旋转时间0.5 s,动脉期螺距0.6,门脉期螺距0.7。采用100 kV/Sn150 kV双能量扫描,A管参考管电流为260 mA,同时生成权重因子(weighting factor,M)为0.6的线性融合图像,所有扫描均使用实时动态曝光剂量调节技术(Care DOSE 4D)。
增强扫描使用非离子型对比剂碘普罗胺(370 mgI/mL),根据基于患者体重的个性化注射方案计算总量和流率,以平均3.5~5 mL/s的流率经右肘正中静脉注射。采用自动触发模式,触发点定于腹主动脉腹腔干水平,达触发阈值100 HU后延迟10、25 s分别启动动脉期和门脉期扫描。
3. 图像重建
采用ADMIRE迭代重建算法,迭代强度为2,卷积核kernel值均为Br40f,动脉期重建层厚及间隔均为1 mm,门脉期重建层厚及间隔均为1.5 mm。所有图像均传至西门子双能量工作站(singovia VB20),由1名放射科医师通过monoenergetic+软件以10 keV为间隔获得40~100 keV内的7组MEI(+)图像。
4. 影像评价
分别在40~100 keV MEI(+)和线性融合的8组图像测量胰周血管(腹腔干、肝总动脉、脾动脉、肠系膜上动脉、胃十二指肠动脉、门静脉和肠系膜上静脉)的CT值,感兴趣区(region of interest,ROI)尽可能大但不包括血管壁及钙化,使ROI包含整个管腔,约2~3 mm2;在胰腺体部,尽量避开血管、脂肪,ROI面积约3 mm2;同时测量同层面左侧竖脊肌CT值,及腹膜后脂肪CT值的标准差(standard deviation,SD)作为背景噪声,ROI面积约为3 mm2。以上测值均于3个层面分别测量后取平均值。按以下公式分别计算每组图像上各支血管及胰腺实质的SNR、CNR及SIR:SNR=CT1/SD;CNR=(CT1-CT2)/SD;SIR=CT1/CT2。式中CT1、CT2、SD分别为血管或胰腺实质CT值、束脊肌CT值、背景噪声。
由2名放射科医师(腹部影像诊断经验分别为14和8年)调节血管显示最佳的窗宽窗位对血管进行观察,并采用双盲法对各组图像的图像质量及7支胰周血管进行主观评分。评分标准如下:5分为优良,无明显噪声和伪影,能清晰诊断,管腔明显强化,血管壁光滑锐利;4分为良,轻度噪声和伪影,能较好诊断,管腔明显强化,管壁欠锐利;3分为中等,中度噪声和伪影,诊断较困难,管腔强化好,边缘欠锐利或模糊;2分为较差,较重的噪声和伪影,诊断困难,血管管腔纤细,管壁模糊;1分为差,严重的噪声和伪影,诊断困难,血管显示不清。
5. 统计学分析
使用SPSS 26.0软件进行统计学分析。呈正态分布的计量资料以±s表示。采用单因素方差分析及Dunnett校正法比较多组图像的客观指标和噪声;以Friedman检验比较8组图像质量及胰周血管评分;观察者间的一致性评价采用Kappa检验。Kappa值≥0.801为吻合度优,0.601~0.800为良,0.401~0.600为一般,≤0.400为差。以P<0.05为差异有统计学意义。
结 果
1.患者的临床特征
本组纳入的45例患者,其中男24例,女21例;年龄19~83岁,平均(54.7±14.7)岁;体重指数(body mass index,BMI)为18.51~26.86 kg/m2,平均(22.34±1.89)kg/m2。
2.图像客观指标——噪声
图像噪声在40~50 keV MEI(+)组明显高于其他MEI(+)组和PEI组,70~100 keV MEI(+)明显低于PEI组;100 keV MEI(+)噪声最低,PEI组噪声和60 keV MEI(+)组相当,二者间差异无统计学意义(P=0.311,图1)。
3.图像客观指标——血管
如表1所示,随keV减小,所有血管的SNR、CNR及SIR逐渐增加,均在40 keV MEI(+)时最高;40~60 keV MEI(+)组图像中所有血管的SNR、CNR及SIR均明显高于PEI组(P<0.001);PEI组血管SNR及CNR和80 keV MEI(+)组相当,二者间差异无统计学意义(P>0.05),SIR和70 keV MEI(+)组相当,二者间差异无统计学意义(P>0.05)。
表1 不同能级图像上各支血管的SNR、CNR和SIR n=45,±s

表1 不同能级图像上各支血管的SNR、CNR和SIR n=45,±s
CA:腹腔干;CHA:肝总动脉;SPA:脾动脉;SMA:肠系膜上动脉;GDA:胃十二指肠动脉;PV:门静脉;SMV:肠系膜上静脉。*:P<0.05,与PEI组比较。
组别SPA 41.12±9.56*32.35±6.94*26.89±5.32*22.91±4.15*20.22±3.79 17.67±3.72 15.54±3.09 17.88±3.39 40 keV 50 keV 60 keV 70 keV 80 keV 90 keV 100 keV PEI CHA 39.44±9.25*31.09±6.65*25.90±5.28*22.16±4.24*19.56±3.97 17.08±3.93 15.07±3.24 17.28±3.56 SMA 44.03±9.54*34.42±7.51*28.47±5.89*24.04±4.48*21.08±3.93 18.30±3.76 15.95±2.99 19.01±3.64 GDA 34.23±9.59*27.16±7.10*22.71±5.47*19.55±4.61*17.39±4.01 15.18±3.79 13.39±3.00 15.90±3.00 PV 19.33±3.83*15.47±2.75*12.97±1.99*11.36±1.59*10.30±1.44 9.38±1.38 8.63±1.29 8.85±1.44组别SMV 19.67±4.27*15.64±3.24*13.01±2.31*11.32±1.83*10.22±1.61 9.29±1.50 8.52±1.39 8.89±1.55 40 keV 50 keV 60 keV 70 keV 80 keV 90 keV 100 keV PEI 40 keV 50 keV 60 keV 70 keV 80 keV 90 keV 100 keV PEI SPA 37.48±9.48*28.65±6.92*22.94±5.29*18.64±4.17*15.52±3.67 12.63±3.54 10.22±2.98 14.03±3.28 SNR CA 44.58±9.79*34.95±7.14*28.91±5.63*24.47±4.37*21.49±4.01 18.73±3.93 16.44±3.18 19.11±3.63 CNR CA 40.93±9.69*31.25±7.09*24.96±5.56*20.20±4.33*16.79±3.84 13.68±3.68 11.11±2.98 15.26±3.50 SIR CA 12.63±3.41*9.67±2.39*7.45±1.74*5.84±1.35 4.66±1.06 3.77±0.87 3.15±0.73 5.06±1.14 CHA 35.79±9.18*27.38±6.65*21.95±5.25*17.89±4.22*14.86±3.80 12.04±3.67 9.75±3.03 13.43±3.47 SMA 40.38±9.46*30.72±7.50*24.52±5.84*19.77±4.46*16.37±3.79 13.26±3.55 10.63±2.82 15.17±3.53 GDA 30.58±9.59*23.46±7.16*18.76±5.54*15.28±4.64*12.68±3.93 10.13±3.68 8.06±2.98 12.06±2.98 PV 15.68±3.76*11.77±2.73*9.01±2.04*7.08±1.59*5.59±1.34 4.34±1.22 3.31±1.10 5.01±1.32 SMV 16.02±4.26*11.94±3.22*9.06±2.31*7.05±1.80*5.52±1.48 4.24±1.29 3.20±1.14 5.05±1.41组别SMV 5.60±1.64*4.33±1.11*3.36±0.78*2.70±0.57 2.21±0.44 1.87±0.35 1.62±0.29 2.35±0.47 CHA 11.20±3.23*8.62±2.27*6.68±1.64*5.29±1.27 4.24±0.99 3.43±0.81 2.88±0.67 4.58±1.11 SPA 11.67±3.36*8.96±2.36*6.94±1.72*5.48±1.34 4.39±1.06 3.57±0.87 2.98±0.73 4.74±1.09 SMA 12.50±3.68*9.54±2.56*7.34±1.83*5.74±1.40 4.57±1.08 3.69±0.87 3.06±0.71 5.04±1.16 GDA 9.78±3.37*7.57±2.41*5.89±1.76*4.68±1.37 3.78±1.06 3.07±0.87 2.58±0.72 4.23±1.02 PV 5.48±1.47*4.29±1.02*3.35±0.74*2.71±0.55 2.23±0.43 1.89±0.35 1.65±0.30 2.34±0.47
4.胰腺图像客观指标
随keV减小,胰腺实质SNR,CNR及SIR逐渐增加,在40 keV MEI(+)上最高(图2);胰腺实质SNR和CNR在40~70 keV MEI(+)组明显高于PEI组(P<0.05),PEI组胰腺SNR及CNR和80 keV MEI(+)组相当,二者间差异无统计学意义(P>0.05);与SNR和CNR不同的是,胰腺实质SIR在40~60 keV MEI(+)明显高于PEI组(P<0.05),PEI组SIR与70 keV MEI(+)组相当(P>0.05)。
5.胰周血管和图像质量主观评分
在动脉期和门脉期,40~60 keV MEI(+)组图像的胰周血管评分均高于其他MEI(+)组和PEI组(P<0.001),40 keV MEI(+)时评分最高,40~60 keV MEI(+)组间评分差异无统计学意义(P=1.000);PEI组评分和70 keV MEI(+)时相当,二者间差异无统计学意义(P=1.000)。图像质量主观评分在50 keV MEI(+)时最高,50~60 keV MEI(+)组评分均高于其他MEI(+)组和PEI组(P=0.003);PEI组评分和80 keV MEI(+)时相当(P=1.000),参见图3和图4。在所有组图像中,观察者间的一致程度为一般到优(Kappa=0.543~0.852),2名医师对胰周血管和图像质量评分的一致性见表2。
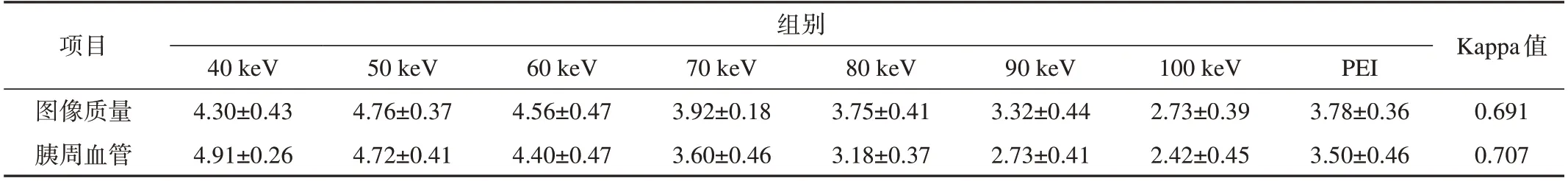
表2 胰周血管和图像质量主观评分
讨 论
胰周血管对胰腺疾病的发生、发展及转归有重要临床意义,其中血管受累程度被认为是预测胰腺癌可切除性和生存的最重要因素。MDCT扫描是显示胰腺动脉的的常规非侵入性方法之一,然而传统CT采用混合能量X线束,容易受到线束硬化伪影的影响,分辨率和对比噪声比相对较低,通常很难显示胰腺动脉的小分支和走行。DECT获得的虚拟单能级图像(MEI[+])能在评估胰腺疾病时提供临床附加价值,MEI(+)近似于单能量X射线所获得的图像,其中碘的衰减随着能量接近碘k边缘(33.2 keV)而增加,从而获得更好的对比[3,5]。然而,传统单能级图像的一个缺点是在低keV水平下的图像噪声增加。据以往文献[6]报道,由于低keV图像噪声的增加,特别是在腹部检查中,小于70 keV MEI(+)图像的临床效用有限。最近,和传统的单能重建算法(standard monoenergetic algorithm,sMERA)相比,第三代双源能谱CT引入一种新的噪声优化的单能重建算法(noise-optimized monoenergetic algorithm,nMERA)已用来克服这一限制。该技术是基于空间频率的重组,来抑制低keV MEI(+)图像的噪声同时提高高keV MEI(+)图像的对比度,以获得最佳图像质量[7]。Young等[8]在研究中提出DECT(SOMATOM Definition Flash;Siemens Healthineers,Forchheim,Germany)在40 keV MEI(+)图像中,获得了显示腹部动脉最佳的对比噪声比和信噪比,以及在60 keV MEI(+)中图像质量最佳。Nagayama等[3]在研究中表明,双层探测器光谱CT(IQon spectral CT;Philips Healthcare)在40 keV时PDAC病灶显著性及胰周血管显影更好。
在本研究中观察到的MEI(+)重建的客观图像噪声特征与最近的研究相当,这些研究显示较低能量水平的噪声略微增加[3-4]。虽然噪声对于图像质量很重要,SNR也是评估图像质量的重要因素,在噪声水平能够被接受的情况下,增加的SNR可以保证提升图像质量。在我们的研究中,与PEI组图像相比,40~50 keV MEI(+)图像中胰腺实质的SNR提高了55.72%~90.03%,血管的SNR提高了70.82%~133.28%。此外,第三代DECT采用最新的迭代重建算法(advanced modelled iterative reconstruction,ADMIRE)来降低噪声和提高图像质量。所有这些因素都导致在较低能量水平下能保持较好的图像质量。
血管增强的可视化主要取决于图像噪声和血管强化程度,降低图像噪声需要增加辐射剂量,提高血管强化程度需要增加对比剂用量或流率[9]。然而,以往研究报道,提高对比剂流率会增加对比剂外渗的风险[10]。DECT虚拟单能级成像能在不增加辐射剂量或对比剂用量及流率的情况下提高增强血管的CNR值,特别是对于对比剂充盈不好的患者,可减少重复注射对比剂的必要。本研究中平均CT剂量指数(CT dose index,CTDIvol)为(11.47±1.69)mGy,低于以往研究报道的常规120 kV胰腺扫描辐射剂量[(16.46±5.32)mGy;(14.0±7.0)mGy][9,11]。虽然我们没有额外进行传统非能谱扫描,而是使用线性融合图像来代替常规120 kV图像与其他单能量图像进行比较,因为线性融合图像相当于常规120 kV混合能量图像。
CNR是评价血管强化的主要客观指标,本组研究显示在40 keV MEI(+)下观察血管的可视化程度最高,这与40 keV MEI(+)时血管CNR提升最多有关。与PEI组图像相比,本组40 keV MEI(+)图像中血管的CNR提高了153.57%~217.23%。在图像质量方面,文献[3-4]报道,主观图像参数在40 keV MEI(+)时重建最佳。在本研究中,50 keV MEI(+)和60 keV MEI(+)时主观认为更适合观察图像,因为在本组的研究中40 keV MEI(+)时噪声增加更大,噪声增高会导致图像质量降低,本组结果显示50~60 keV MEI(+)显示图像细节的能力高于40 keV MEI(+),因此,没有必要生成所有能级的单能量图像来评估胰腺病变或血管。基于本组研究与既往研究结果,40 keV MEI(+)图像可用来评估胰周血管,50或60 keV MEI(+)可用于提高CT诊断图像质量,据此,在今后的胰腺扫描中,常规用能谱CT扫描,不但可以降低辐射剂量,而且采用不同的单能级重建,还可以提高对胰腺疾病的诊断和胰周血管的显示,从而改善DECT对胰腺检查的工作流程。
本研究的局限性:首先,这是一个回顾性的单中心研究,样本较少。第二,我们仅纳入正常胰腺患者,未分析胰腺疾病对胰周血管的影响。第三,图像分析是基于DECT扫描后标准线性融合的M0.6线性融合图像和MEI(+)重建图像,其他混合因子,如M 0.4或M 0.5,以及常规CT扫描所得的120 kV混合能量图像,没有评估。
总之,本研究表明,在接受胰腺扫描的患者中,使用DECT噪声优化算法,在低keV水平下进行MEI(+)重建,与PEI图像相比,可以提供更好的客观和主观图像质量。其中40 keV MEI(+)显示胰周血管最佳,50~60 keV MEI(+)显示图像质量最佳。因此,DECT低keV MEI(+)重建可用于提高CT诊断图像质量,以评估胰腺疾病和胰周血管。

