胰腺癌肿瘤微环境的机制及靶向治疗
张艺译, 徐 敏
上海交通大学附属第一人民医院 消化内科, 上海 200080
胰腺癌是目前公认的恶性程度最高的肿瘤之一,R0手术切除联合辅助治疗是当前唯一有治愈意义的方案,但由于胰腺癌发病隐匿、早期诊断困难、进展迅速,多数患者确诊时已失去手术指征,加之其对抗肿瘤药物不敏感,患者整体预后极差。2018年全球癌症统计数据[1]显示,胰腺癌的发病率虽未列入前十,但癌症病死率排名第七[2],胰腺癌患者整体中位生存期不超过12个月。在美国,胰腺癌5年相对生存率为10%,在所有癌症中最低[3]。近年来,随着对肿瘤微环境(tumor microenvironment,TME)的深入研究,为胰腺癌致病机理和靶向治疗方面提供了新思路。
1 胰腺癌TME
胰腺癌TME是指胰腺癌细胞所处的局部环境,包括细胞成分和非细胞成分。细胞成分包括胰腺星状细胞(pancreatic stellate cell,PSC)、癌相关成纤维细胞(cancer-associated fibroblast,CAF)、免疫细胞和血管等(图1);非细胞成分,也称为细胞外基质(extracellular matrix,ECM),含有胶原蛋白、基质蛋白和多种可溶性因子,包括细胞因子、趋化因子和生长因子等[4]。胰腺癌TME本质上是一个由于活跃的结缔组织增生沉积造成过度纤维化而形成的致密基质[5]。广泛纤维化、血管缺乏、免疫浸润和缺氧的基质环境不仅促进肿瘤生长和侵袭,还使其对抗肿瘤药物产生耐受抵抗。因此,研究胰腺癌TME中各成分的作用和靶向治疗对胰腺癌未来的治疗管理非常重要。
1.1 CAF和PSC CAF来源于基质中各种成纤维细胞:原始成纤维细胞、骨髓衍生细胞和星状细胞。在胰腺癌中,PSC是CAF最主要的来源[6]。癌细胞通过PI3k/Akt、JAK-STAT和Hedgehog等信号传导途径、炎症细胞因子和活性氧成分激活PSC:胞质中维生素A脂滴消失;大量α-平滑肌肌动蛋白生成,被激活的PSC自分泌TGFβ、血小板衍生生长因子受体、IL-6等因子,进一步增强自身活性[2],获得肌成纤维细胞样表型,即CAF[7]。CAF分泌大量胶原蛋白和基质蛋白,蛋白交联沉积,基质过度纤维化,导致ECM又厚又硬[4,6],不仅构成物理屏障阻碍药物输送,且机械压迫血管,造成脉管塌陷,使药物运送更加困难[2,6-7]。CAF还可分泌生长因子、细胞因子及基质金属蛋白酶,以促进癌细胞的生长和迁移[4,7],同时上调免疫检查点程序性死亡受体1(programmed death 1,PD-1)和细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated antigen 4,CTLA-4)的配体表达以诱导效应性T淋巴细胞凋亡,帮助癌细胞实现免疫逃逸[4]。
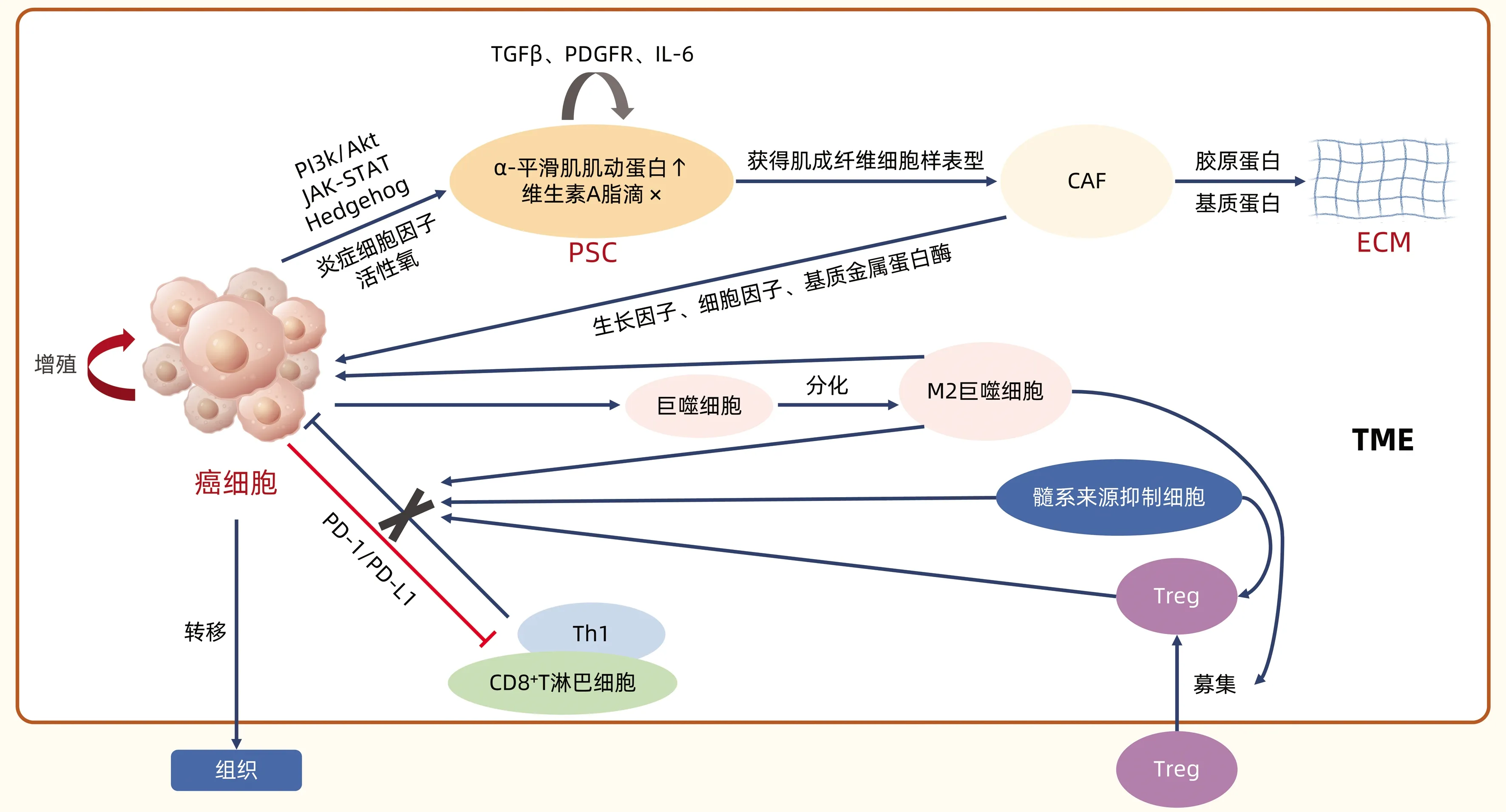
图1 胰腺癌TME细胞成分作用机制图
1.2 免疫细胞
胰腺癌是一个免疫原性低、高度免疫抑制的肿瘤类型,其免疫治疗在临床上几乎没有成功,很大程度上可能受限于TME的免疫缺陷和免疫抑制。胰腺癌TME中免疫细胞主要分为三类:肿瘤相关巨噬细胞、肿瘤浸润性T淋巴细胞和髓源性抑制细胞。
1.2.1 肿瘤相关巨噬细胞 肿瘤相关巨噬细胞是胰腺癌预后不良的标志,包括2种细胞分型:抗肿瘤的M1巨噬细胞和促肿瘤的M2巨噬细胞。在胰腺癌中,肿瘤细胞通过IL-13与巨噬细胞相互作用,诱导其分化成M2表型,不仅促进肿瘤生长、转移和血管生成[4,6],还能够募集调节性T淋巴细胞(Treg),抑制效应性T淋巴细胞对肿瘤的细胞毒作用[8]。
1.2.2 肿瘤浸润性T淋巴细胞 胰腺癌TME中浸润的淋巴细胞以T淋巴细胞为主,包括CD4+辅助性T淋巴细胞(Th)、Treg和CD8+T淋巴细胞,其中CD4+Th分为抗肿瘤的Th1和促肿瘤的Th2。尽管T淋巴细胞在胰腺癌基质中大量存在,但抗肿瘤的效应性T淋巴细胞的浸润与活化被大大限制。研究[4]显示,胰腺癌中丰富的Th2、M2 巨噬细胞、Treg以及髓源性抑制细胞都能够阻断Th1和CD8+T淋巴细胞的抗肿瘤反应以促进肿瘤的生长,因此TME中Th1和CD8+T淋巴细胞计数偏高的胰腺癌患者通常预后较好[4,8]。此外,T淋巴细胞表面存在PD-1,T淋巴细胞受体识别癌细胞表面主要组织相容性复合体后,T淋巴细胞被激活分泌IFNγ,局部高浓度的IFNγ和肿瘤相关巨噬细胞分泌的TNFα诱导癌细胞表达程序性死亡配体1,特异性结合PD-1后启动T淋巴细胞凋亡,癌细胞由此实现免疫逃逸[9-10]。
1.2.3 髓源性抑制细胞 髓源性抑制细胞是肿瘤细胞诱导未成熟的髓系细胞分化而成,可抑制CD4+T淋巴细胞和CD8+T淋巴细胞的增殖分化,限制CD8+T淋巴细胞的免疫监视,并促进Treg的扩增,协助肿瘤细胞免疫逃逸[11]。
1.3 细胞外基质(ECM)
ECM的本质是细胞成分生成的各种非细胞成分,包括基质蛋白如纤连蛋白、层粘连蛋白、胶原蛋白、透明质酸和多种可溶性因子,如细胞因子、趋化因子和生长因子等,ECM不仅为胰腺组织提供结构支持,且为胰腺中各细胞之间信号传导提供平台[4,7]。
1.3.1 基质蛋白和胶原蛋白 基质蛋白和胶原蛋白不仅能够通过构建物理屏障和缺血缺氧环境帮助肿瘤耐药,而且促进癌细胞的增殖和侵袭。研究[6,12]表明,纤连蛋白和层粘连蛋白不仅能够抵抗因细胞色素C释放诱导的凋亡过程,且能够通过抑制半胱天冬酶来逃避凋亡程序,增加肿瘤细胞的存活期。胶原蛋白尤其是TME中最为丰富的Ⅰ型胶原,能够降低癌细胞表面E-钙黏蛋白的表达,破坏E-钙黏蛋白/β-连环蛋白复合物的形成,以迫使癌细胞加速细胞增殖周期;通过α2β1整合素破坏细胞之间的黏附接触,促进癌细胞的迁移[6];同时可诱导基质金属蛋白酶的分泌,降解基底膜,癌细胞由此进入淋巴管和血管系统,侵袭能力显著增强[13]。
1.3.2 透明质酸 胰腺癌ECM中的透明质酸含量在所有恶性肿瘤中最高,高含量透明质酸是影响胰腺癌预后的独立因素[14]。具有强大亲水性的透明质酸能够捕获水分子进入细胞间隙,与蛋白质结合形成蛋白凝胶,将细胞黏在一起又能够彼此分离,使细胞易于迁移,同时阻止细胞分化,促进肿瘤增殖。此外,大量水分的摄入使得ECM间质膨胀,流体压力增加,压迫脉管系统[14-15]并形成机械屏障减少药物摄入[2,4],强化肿瘤对于化疗药物的耐受抵抗能力。
1.3.3 上皮-间质转化(epithelial-mesenchymal transition,EMT) EMT是癌细胞由上皮细胞向间质细胞转化的过程,是胰腺癌具有侵袭性和耐药性的重要机制,与ECM中多种分泌因子及信号通路密切相关。在TGFβ、Notch通路、Wnt/β-Catenin通路等各种EMT诱导信号作用下[16-17],Snail1/Snail2、Twist、Zeb-1、Zeb-2、SMAD蛋白家族等EMT转录因子激活,驱动靶向基因转录,上调N-钙黏蛋白等间充质标志物表达,抑制E-钙黏蛋白等上皮标志物表达,促使上皮细胞失去极性和细胞间的黏附连接,转化为间充质表型,获得迁徙能力,脱离上皮导管结构,实现侵袭和扩散[16,18],同时EMT抑制癌细胞增殖和药物转运蛋白表达,强化对吉西他滨等抗增殖药物的耐药性[19]。
2 胰腺癌TME的靶向治疗
随着胰腺癌TME致病机理的研究逐渐深入,以TME为靶点的靶向治疗成为新的治疗研究方向,基质致密纤维化和独特的免疫环境是目前胰腺癌治疗失败的主要原因,所以基质和免疫细胞是当前最热门也是最有希望实现突破的靶点。
2.1 靶向基质的治疗
胰腺癌对包括吉西他滨在内的很多抗肿瘤药物均有耐受抵抗,而参与吉西他滨耐药的基因表达富集在基质相关途径中[20],引发了以基质耗竭为目的的靶向研究的蓬勃发展,但大量研究[4,21]结果显示基质耗竭不仅不能延长总体生存期,在某些情况下,胰腺癌反而变成更具侵袭性。相比之下,诱导纤维化基质恢复原有稳态可能是更有希望的治疗策略[2,22]。到目前为止,基质靶向治疗主要分为2种思路:(1)基质消耗治疗,如聚乙二醇化的重组人透明质酸酶(PEGylated recombinant human hyaluronidase, PEGPH20);(2)基质调节治疗,如结缔组织因子抑制剂、FAK 抑制剂和维生素D类似物[15]。
2.1.1 聚乙二醇化的重组人透明质酸酶(PEGPH20) PEGPH20能够有效降解透明质酸,降低肿瘤内压力,改善血管塌陷。HALO-109-201和HALO-109-202 Ⅱ期试验[23-24]显示,对发生转移的患者,PEGPH20联合GEM/Nab-紫杉醇方案不能改善整体无进展存活期;但可明显改善高透明质酸患者(ECM中透明质酸染色>50%)的无进展存活期和中位生存期。然而,在专门针对高透明质酸、Ⅳ期胰腺癌患者的HALO-109-301 Ⅲ期试验[25]中,PEGPH20联合GEM/Nab-紫杉醇方案并不能改善该人群的无进展生存期与总体生存期,反而不良事件发生率增加。此外,在SWOG S1313 ⅠB/Ⅱ期试验[26]中,PEGPH20联合FOLFIRINOX方案反而缩短了患者的无进展生存期和中位生存期。PEGPH20在转移性胰腺癌中疗效研究的失败为基质消耗治疗策略带来新的困境。但也有研究[27-28]发现,在小鼠模型中加用PEGPH20后肿瘤对抗血管生成治疗更敏感;显著增强肿瘤疫苗对TME中T淋巴细胞浸润的促进作用,上述结果均展现了PEGPH20与其他靶向治疗联合应用的可能性。
2.1.2 维生素D/维生素D受体 胰腺癌中维生素D降解酶CYP24A1表达增加,造成维生素D缺失,维生素D/维生素D受体信号失活,叉头转录因子M1的表达增加,促进癌细胞的生长和转移,这是胰腺癌发生和进展的关键因素[29]。维生素D类似物骨化三醇与CAF表面的维生素D受体结合后可诱导CAF重新产生脂滴并降低α-平滑肌肌动蛋白的表达,恢复成静息状态的PSC,同时降低基质中的纤维化和炎症浸润,实现基质重构并增加肿瘤中吉西他滨药物浓度,最后使得同种异体肿瘤小鼠的肿瘤体积变小,生存期延长[30-31]。除了吉西他滨,维生素D类似物联合溶瘤病毒、免疫疗法的试验结果也值得期待。
2.1.3 其他 纤维化的基质是阻碍药物运送的主要屏障,选用合适的载体将药物运进肿瘤细胞也是靶向治疗的突破点,纳米载体是当前较为热门的选择。纳米系统Au@PP/RA/siHSP47,通过AuNP纳米载体,向胰腺癌肿瘤模型中同时传递诱导PSC恢复静息状态的全反式维甲酸和靶向热休克蛋白47的siRNA,模型中药物的输送和渗透明显改善,侵袭性胰腺肿瘤的进展受到显著抑制[22]。此外,纳米颗粒载体还能够改善吉西他滨、单克隆抗体的渗透性和靶向性[32],增强其抗肿瘤疗效。
2.2 靶向免疫细胞的治疗 M2巨噬细胞、髓源性抑制细胞、Treg作为TME中主要的免疫抑制细胞,为胰腺癌的免疫治疗提供了靶点。巨噬细胞集落刺激因子1受体(colony-stimulating factor 1 receptor,CSF1R)是肿瘤相关巨噬细胞、髓源性抑制细胞表达的生长因子受体。在同种异体肿瘤小鼠模型中,CSF-1R选择性抑制剂AZD7507可显著消耗巨噬细胞,增强效应性T淋巴细胞浸润比例,导致肿瘤消退并提高小鼠生存率[33]。此外,抗CSF-1R抗体联合肿瘤疫苗GVAX和抗PD-1抗体可提高转移性胰腺癌小鼠的存活率[34]。CTLA-4是表达于Treg表面的抑制分子,抗CTLA-4抗体可阻断免疫抑制信号的传递,增强效应性T淋巴细胞和其他免疫细胞的抗肿瘤活性[35]。CTLA-4和PD-1作为经典的免疫检查点,是肿瘤免疫治疗中的热门靶点,但免疫检查点抑制剂的单药治疗难以提高胰腺癌患者的生存率,目前研究较多的联合免疫检查点抑制剂的免疫疗法有CAR-T淋巴细胞移植、肿瘤疫苗、溶瘤病毒和抗CD40单克隆抗体等。尽管当前胰腺癌免疫治疗的药物试验尚未取得突破性进展,但其疗效和前景仍然值得期待。
3 小结
虽然胰腺癌的分子机制和药物研究一直在深入,但胰腺癌患者的预后没有显著改善。由于胰腺癌TME组成成分的独特性,它在肿瘤的增殖、转移、免疫逃逸和耐药等各个方面都产生极大的影响,因此深入研究胰腺癌TME组成成分的致病机理、新型靶向药物以及联合用药方案是非常迫切又必要的。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:张艺译负责收集资料,分析文献,撰写论文;徐敏负责拟定写作思路,指导撰写文章并最后定稿。

