虎杖活性成分治疗非酒精性脂肪性肝病的相关信号通路及相互作用
李淑娣, 陈欣菊, 刘江凯, 王 振, 段 飞, 袁卓雅, 梁 磊, 李素领
1 河南中医药大学 第一临床医学院, 郑州 450000; 2 河南中医药大学第一附属医院 脾胃肝胆科, 郑州 450000
非酒精性脂肪性肝病(NAFLD)是以肝细胞脂肪过量堆积为病理特征的慢性肝病[1],全球患病率高达25.2%[2]。其发病机制尚不清楚,目前被广泛认可的是“多次打击”学说,主要认为其发病涉及胰岛素抵抗、氧化应激、脂质代谢紊乱、内质网应激及炎症浸润等多种潜在途径及损伤的相互作用[3],且目前尚无任何治疗NAFLD的有效药物获批[4]。中药虎杖为蓼科蓼属多年生草本植物虎杖的干燥根茎和根,归肝、胆经,具有活血散瘀、利湿退黄等功效。其主要化学成分包括以大黄素为代表的醌类,以白藜芦醇、虎杖苷为代表的二苯乙烯类,以槲皮素为代表的黄酮类及其他化合物4类[5]。虎杖具有抗炎、抗氧化、调节代谢、改善微循环、肝保护、抗肿瘤等多种药理活性[6]。近年来有大量研究[7-10]表明,虎杖活性成分可通过改善胰岛素抵抗、抗氧化应激、调节脂质代谢、改善内质网应激、减轻炎症浸润等方面发挥对NAFLD的治疗作用。本文重点梳理虎杖活性成分治疗NAFLD的关键信号通路相关研究进展,为进一步阐明虎杖防治NAFLD的分子机制提供理论依据,也为抗NAFLD药物研发提供思路和参考。
1 虎杖活性成分在NAFLD中调节核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)相关信号通路的机制
1.1 Nrf2相关信号通路在NAFLD中的作用 Nrf2是一种氧化还原反应性转录因子,调控一系列抗氧化蛋白表达。Keap1是Nrf2的负调节器,在生理状态下,Nrf2多存在于胞浆中与Keap1结合,处于被抑制状态;当受到机体内氧化应激信号刺激后,迅速与Keap1解离,以稳态形式转入细胞核中,启动抗氧化反应元件,并与之结合启动下游多种基因的转录与翻译,从而上调抗氧化物质的表达。氧化应激在NAFLD发生发展中发挥关键作用,Nrf2作为机体抗氧化应激的核心途径之一,调控Ⅱ相解毒酶、抗氧化酶的表达,清除超氧化物,发挥抗氧化损伤作用[11]。研究[12]发现,Nrf2无效型小鼠相较于野生型小鼠肝甘油三酯升高,Nrf2的缺失加速了非酒精性脂肪性肝炎(NASH)的进展。另有多项研究[13-14]表明,通过激活Nrf2通路可改善或抑制氧化应激,改善NAFLD和NASH损伤,多种Nrf2通路激活剂在干预NAFLD的实验中已显示出积极的效果,Nrf2被认为是防治肝病的关键治疗靶点。以上研究表明,Nrf2相关信号通路与NAFLD的发生发展密切相关。
1.2 虎杖活性成分在NAFLD中调节Nrf2相关信号通路的机制 氧化应激是指细胞呼吸利用氧产生能量形成三磷酸腺苷时,氧衍生的自由基或ROS的产生及其作用超过对其防御或解毒的能力, 这种细胞氧化还原失调的状态被称为氧化应激[15]。槲皮素属虎杖中活性较高的黄酮类成分具有很强的抗氧化活性,能够有效减轻肝氧化应激[16]。Panchal等[17]研究发现,槲皮素可使Nrf2表达显著升高,而上调血红素氧合酶1(heme oxygenase-1,HO-1)、肉碱酰基转移酶(carnitine palmitoyltransferase 1,CPT1)的表达,发挥抗炎、降低氧化应激、调节脂肪酸氧化作用。虎杖苷是从虎杖根中分离出的天然二苯乙烯类化合物,具有抗氧化、抗炎、改善微循环等多种药理活性[18]。吉秋霞等[7]发现虎杖苷能够抑制肝脏炎性因子TNFα和IL-6水平,促进Nrf2入核表达,从而提升抗氧化酶活性,减轻肝氧化应激。徐志广等[8]研究发现,高剂量虎杖苷可降低大鼠的血清TNFα、IL-1β、IL-6以及肝组织脂质过氧化终产物丙二醇(MDA)水平,增加肝组织超氧化物歧化酶(SOD)活性,虎杖苷可通过激活Nrf2/HO-1信号通路,抑制肝脏炎症及氧化损伤。以上研究提示,虎杖活性成分可通过Nrf2相关信号通路降低炎症反应、抗氧化应激而发挥治疗NAFLD的作用(表1)。

表1 虎杖活性成分调节Nrf2通路作用于NAFLD的效应路径
2 虎杖活性成分在NAFLD中调节腺苷酸活化蛋白激酶(amp-activated kinase,AMPK)相关信号通路的机制
2.1 AMPK相关信号通路在NAFLD中的作用 AMPK被称为“细胞能量平衡的感受器”,是体内不可缺少的蛋白激酶,参与多种代谢过程,是细胞内调节糖、脂代谢的关键分子[19]。AMPK参与炎症信号通路的调节,被认为是NAFLD的潜在治疗靶点[20],是改变代谢通路的关键能量传感器[21]。研究[22]表明,AMPK活化后可通过抑制增加脂肪酸氧化、肝脏中脂肪生成和促进脂肪组织中线粒体功能完整性这3种途径减轻NAFLD的损伤。另有研究[23]发现,激活AMPK/mTOR介导的自噬亦是NAFLD重要的保护机制,当AMPK/mTOR介导的自噬水平显著提升时,肝毒性可得到缓解,激活AMPK/mTOR介导的自噬是一种新兴的NAFLD治疗方法。以上研究表明,AMPK相关信号通路与NAFLD密切相关。
2.2 虎杖活性成分在NAFLD中调节AMPK相关信号通路的机制 固醇调节元件结合蛋白1c(SREBP-1c)作为AMPK信号分子的下游蛋白,直接参与调控葡萄糖代谢、脂肪酸和甘油三酯合成相关酶基因的表达[24]。大黄素是虎杖中主要的蒽醌类成分,具有抗炎、改善微循环、保护肝肾、抗癌等药理活性[25]。大黄素可上调AMPK抑制SREBP-1c及其下游脂肪酸合成相关蛋白的表达,减少肝脂质生成和蓄积,并产生抗氧化应激损伤的作用[26]。胰岛素抵抗为NAFLD的首次打击,在NAFLD的发病过程中发挥重要作用。脂联素是脂肪细胞因子中与胰岛素抵抗关系最紧密的一个特异性细胞因子,是参与胰岛素抵抗的重要因素,可增强脂肪细胞的胰岛素信号转导[27-28]。大黄素不仅可激活AMPK,提升脂联素及其受体的表达,提高胰岛素的敏感性[29];亦可激活AMPK调控的脂联素促进AMPKα的磷酸化、提高酶活性,从而激活AMPKα下游的过氧化物酶体增殖物激活受体α(PPARα)、SREBP-1c及其靶基因,增强肝细胞脂氧化作用,抑制脂肪酸合成和转运,减少肝脂聚积[22]。体外研究[30]发现,25 μmol/L大黄素作用24 h后,可抑制分化成熟的肌小管细胞和脂质细胞的氧消耗量,激活AMPK信号通路,增加脂质细胞的糖酵解水平,增加葡萄糖消耗量,改善葡萄糖的代谢。以上研究提示,虎杖活性成分可通过调节AMPK相关信号通路在NAFLD的脂质代谢、葡萄糖代谢、胰岛素抵抗等过程中发挥重要作用(表2)。

表2 虎杖活性成分调节AMPK通路作用于NAFLD的效应路径Table 2 Active ingredients of Polygonum cuspidatumregulates the pathway of AMPK pathway on NAFLD
3 虎杖活性成分在NAFLD中调节NF-κB相关信号通路的机制
3.1 NF-κB相关信号通路在NAFLD中的作用 NF-κB作为一种重要的基因转录调节因子,具有多向调节功能,可与多种启动子结合,参与调控多种炎症基因、黏附分子和蛋白酶基因的表达[31]。NF-κB的上游分子多种因素激活后,使IκB磷酸化并降解,从而释放并激活NF-κB,激活的NF-κB移入核内结合到相关基因的NF-κB受体上,调控与炎症、细胞增殖及凋亡等相关基因的转录[32]。NF-κB通路已被证实是炎症反应和细胞免疫中的重要通路之一,对肝脏的炎症、氧化应激、肝细胞凋亡和再发生、肝纤维化的过程发挥着重要的作用[33]。以上研究提示,NF-κB相关信号通路与NAFLD在多方面密切相关。
3.2 虎杖活性成分在NAFLD中调节NF-κB相关信号通路的机制 脂多糖(lipopolysaccharide,LPS),也称为内毒素,引发的慢性低度炎症被认为是NAFLD进展的关键因素。张蓉等[34]发现50 μmol/L大黄素作用4 h可抑制LPS过多引起的肌小管细胞和脂质细胞中NF-κB通路的表达,抑制炎症因子IL-6、TNFα的分泌,减轻炎症反应,改善胰岛素抵抗。研究[35]发现,大黄素可能通过抑制NF-κB活化,阻断LPS损伤信号途径的传导,从而减缓NAFLD的病理进程。白藜芦醇是虎杖中非黄酮类多酚化合物,具有抗氧化、抗炎、抗肿瘤、抗老化等功效[36]。研究[37]证实,白藜芦醇通过抑制NF-κB炎症通路,减少TNFα、IL-6和IL-1β mRNA的转录,从而减少促炎因子TNFα、IL-6和IL-1β的表达,干预了NAFLD发生发展重要环节中的炎症反应。以上研究表明,虎杖活性成分通过调节NF-κB相关信号通路从减少炎症反应、改善胰岛素抵抗等方面作用于NAFLD(表3)。

表3 虎杖活性成分调节NF-κB通路作用于NAFLD的效应路径Table 3 Active ingredients of Polygonum cuspidatumregulates the pathway of NF-κB pathway on NAFLD
4 虎杖活性成分在NAFLD中调节沉默信息调节因子1(sirtuin type 1,SIRT1)相关信号通路的机制
4.1 SIRT1相关信号通路在研究NAFLD中的作用 沉默信息调节因子(Sirtuin)是一组高度保守的烟酰胺腺嘌呤二核苷酸依赖性组蛋白和蛋白质脱乙酰酶和ADP-核糖基转移,SIRT1属于Sirtuin家族的一员,其活性受NAD水平与AMPK活性的调节,可以使一系列蛋白发生去乙酰化,对蛋白的下游信号分子进行调节,参与能量代谢﹑细胞生存、衰老及凋亡[38]。SIRT1是肝脂质代谢、氧化应激和炎性反应的重要调节因子,可介导与NAFLD发生机制密切相关的胰岛素抵抗、内质网应激、脂质过氧化等过程,而改善NAFLD/NASH的损伤[39]。研究[40]表明,SIRT1可通过脂肪合成、脂肪代谢和胆固醇代谢3个方面在NAFLD脂质代谢过程中发挥作用。以上研究表明,SIRT1相关信号通路与NAFLD发生机制中的脂质代谢、氧化应激、炎性反应、胰岛素抵抗、内质网应激等多方面密切相关。
4.2 虎杖活性成分在NAFLD中调节SIRT1相关信号通路的机制 脂代谢紊乱所导致的脂肪异位沉积是造成NAFLD的重要原因之一。研究[41]发现,白藜芦醇能够在肝脏和脂肪组织中通过SIRT1促进内质网应激蛋白ATF6的去乙酰化和失活化,上调SIRT1的转录水平,减少脂滴在肝脏中的蓄积。研究[42]显示,大黄素可通过促进SIRT1表达,进而促进脂肪细胞对葡萄糖的吸收,改善脂肪细胞糖代谢。白藜芦醇作为SIRT1的激活剂能够通过SIRT1介导的信号转导途径改善NAFLD[9]。研究[43]表明,白藜芦醇能够通过激活SIRT1/腺苷酸活化蛋白激酶信号通路参与细胞的抗氧化反应。Ding等[44]研究发现,白藜芦醇可调节SIRT1自噬途径及其下游的进程,减轻内质网压力、调节肝脂质代谢。以上研究表明,虎杖活性成分可通过SIRT1相关信号通路从调节脂质代谢、改善内质网应激等途径在NAFLD中发挥作用(表4)。

表4 虎杖活性成分调节SIRT1通路作用于NAFLD的效应路径Table 4 Active ingredients of Polygonum cuspidatumregulates the pathway of SIRT1 pathway on NAFLD
5 虎杖活性成分在NAFLD中调节PPARα相关信号通路的机制
5.1 PPARα相关信号通路在研究NAFLD中的作用 PPARα是一种配体诱导的转录因子,属于核受体超家族,在能量代谢、肝功能、炎症、细胞周期改变中起关键作用[45]。脂肪酸生成和β-氧化是脂质代谢的2个关键环节,PPARα在2个环节均发挥重要作用[46-47]。一方面PPARα可通过调控SREBP-1c表达,通过抑制多种脂肪酸从头合成基因的表达,抑制肝甘油三酯的合成;另一方面PPARα活化后,会催化β-氧化的限速酶,加速脂肪酸氧化。研究[48]表明,在Kupffer细胞向M1型极化过程中因受到PPARα的调控影响,可进一步改善肝细胞脂肪变性,降低局部炎症反应。Yu等[49]研究提示,PPARα激动剂可作为潜在治疗NAFLD的方法。以上研究表明,PPARα相关信号通路与NAFLD中脂质代谢、炎症反应等方面密切相关。
5.2 虎杖活性成分在NAFLD中调节PPARα相关信号通路的机制 陈剑明等[50]研究证实,虎杖苷可增强脂质代谢关键酶PPARα的合成,改善脂质代谢障碍,减少脂质异位沉积,改善机体氧化应激状态。吉秋霞等[7]研究显示,虎杖苷可使肝脏中FASN和SCD1蛋白表达显著下降,上调PPARα和肉碱棕榈酰转移酶1蛋白水平,而发挥调节脂肪酸的新生脂肪生成和β-氧化的作用,减轻血脂异常和肝脂肪变性。研究[10]发现,白藜芦醇可通过PPARα途径改善脂质代谢和氧化还原稳态,影响NAFLD的发生发展。以上研究表明,虎杖活性成分可通过PPARα相关信号通路从改善脂质代谢、氧化应激等方面在NAFLD中发挥作用(表5)。

表5 虎杖活性成分调节PPARα通路作用于NAFLD的效应路径Table 5 Active ingredients of Polygonum cuspidatumregulates the pathway of PPARα pathway on NAFLD
6 信号通路间的相互作用
信号通路是指当细胞要发生某种反应时,信号从细胞外到细胞内传递了一种信息,是将细胞外的分子信号经细胞膜传入细胞内发挥效应的一系列酶促反应通路。在应用虎杖活性成分治疗NAFLD的相关通路中,NF-κB是由SIRT1介导的细胞应激反应的转录调节因子,SIRT1能够促进p65/p50复合物结合,使NF-κB转录活性失活,抑制其促炎靶基因的表达[51]。SIRT1是AMPK的下游调节蛋白,可通过丝氨酸-苏氨酸激酶11介导AMPK,增强AMPK的磷酸化,调控脂质代谢[43]。AMPK激活可增加脂联素的表达,从而激活AMPKα下游的PPARα,增强肝细胞脂氧化作用[22]。Nrf2可通过下调PPARα、PPARγ的表达调控脂质代谢,发挥对肝脏的保护作用[52]。Nrf2可通过转录抗氧化剂和相关下游靶基因,下调IL-1、TNFα等促炎因子,减少NF-κB上游激活因子,而下调NF-κB表达[8],共同调控炎症反应。由此可见,细胞传导通路之间是一个复杂的相互作用网络,虎杖的多成分通过特定的细胞信息作用于多种靶细胞,对应不同靶细胞的受体结合,激活不同的信号传导通路,发挥相互协同或相互拮抗作用机制,形成相互作用网络,显示出从多靶点、多途径、多层次相互作用的机制特点(图1)。
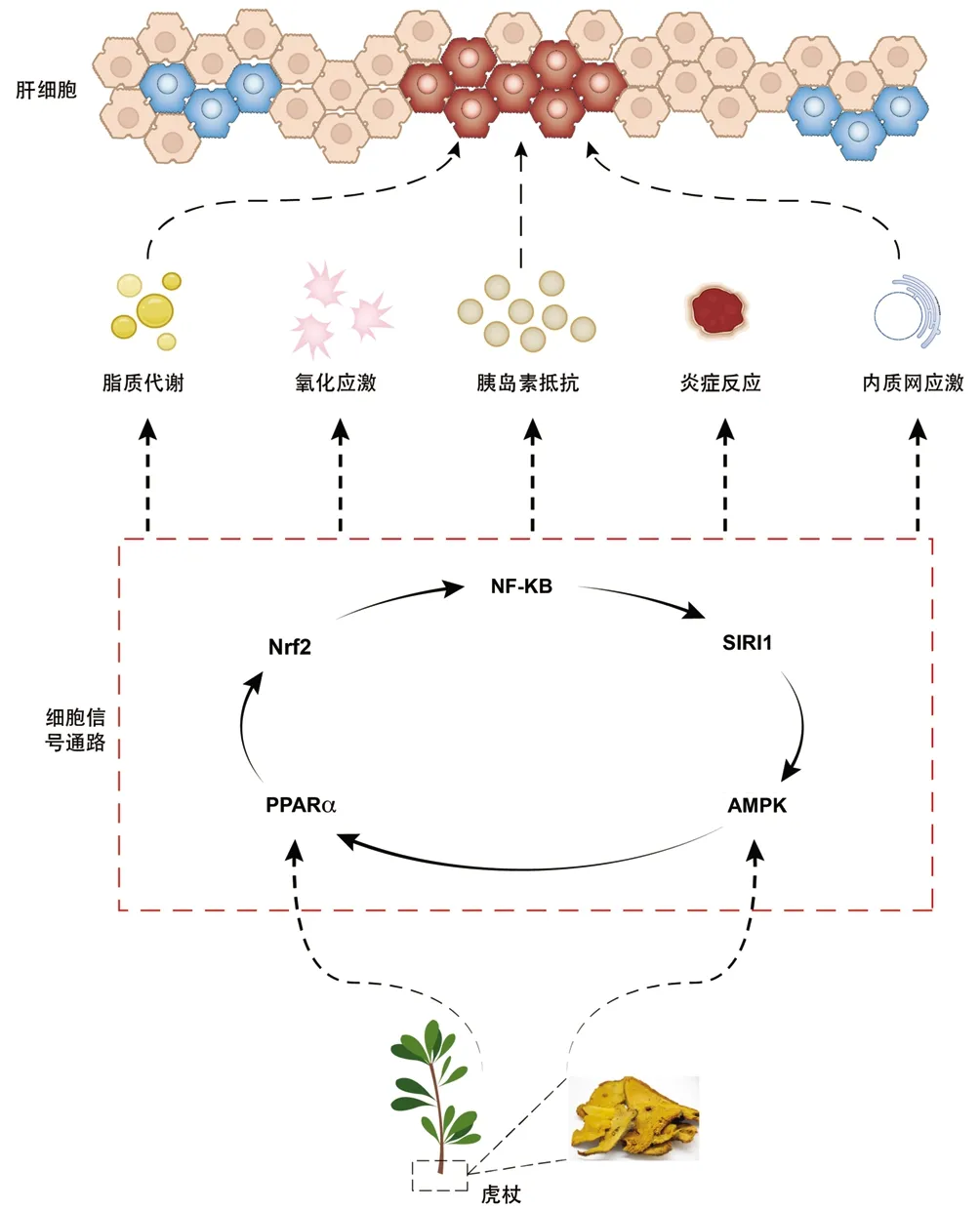
图1 虎杖活性成分治疗NAFLD的细胞信号通路机制Figure 1 Mechanism of cell signaling pathway in treatment of NAFLD by active ingredients of Polygonum cuspidatum
7 小结与展望
本研究通过对虎杖活性成分治疗NAFLD机制中所涉及到的细胞信号通路予以梳理,发现虎杖活性成分可通过调控Nrf2、AMPK、NF-κB、SIRT1和PPARα等多条相关信号通路,发挥改善胰岛素抵抗、抗氧化应激、调节脂质代谢、改善内质网应激、减轻炎症浸润等作用,达到防治NAFLD的目的,显示出多成分、多靶点、多途径相互作用的机制特点。
目前,虎杖在NAFLD的治疗方面取得一定的进展,但虎杖治疗NAFLD所涉及的信号通路的相关研究还存在一些局限性:(1)多数研究集中在对虎杖治疗NAFLD的经典通路探讨,还可挖掘其他重要的信号通路。(2)研究所构建的动物模型比较单一,多属高脂饮食诱导的模型,可从NAFLD不同发病机制开展模型构建。(3)相关信号通路的相互联系作用机制研究较少且不深入,可深入剖析探索相关通路间的作用机制。NAFLD发病机制复杂,其疾病谱包括非酒精性肝脂肪变、NASH、肝硬化和肝细胞癌。可将通路的相互调节、相互拮抗或抑制的作用机制与预防NAFLD疾病谱的进展相联系,达到更优的防治效果。因此,研究相关信号通路之间的联系机制,更好的发挥中药多成分、多靶点、多途径、多层次的优势,为虎杖治疗NAFLD提供强有力的支撑依据及新的思路将是日后的研究重点。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李淑娣负责课题设计,资料分析;陈欣菊、刘江凯、王振、段飞负责修改论文;袁卓雅、梁磊负责归纳总结文献资料;李素领负责拟定写作思路,指导撰写文章并最后定稿。

