海藻羊栖菜化学成分全谱分析及其体外抗神经炎症活性研究
彭红 黄品哲 宋永贵 徐焕华 周明月 朱根华 杨明 艾志福 苏丹


中图分类号 R917;R285 文献标志码 A 文章编号 1001-0408(2022)07-0800-09
DOI 10.6039/j.issn.1001-0408.2022.07.06
摘 要 目的 研究羊栖菜的化学成分组成及体外抗神经炎症活性,为其开发利用以及药效物质研究提供参考。方法 基于超高效液相飞行时间质谱联用技术(UHPLC-QTOF-MS/MS)和气相色谱-质谱联用技术(GC-MS/MS)对羊栖菜中化学成分进行全谱分析。利用脂多糖(1 μg/mL)建立小鼠小胶质细胞BV2的炎症模型,以帕罗西汀(5 μg/mL)为阳性对照药物,通过CCK-8法检测20、40、60、80、100 μg/mL羊栖菜提取物作用24 h后对细胞活性及形态的影响,通过酶联免疫吸附法检测40、60、80 μg/mL羊栖菜提取物作用24 h后对细胞上清液中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)含量的影响。结果 经UHPLC-QTOF-MS/MS分析共鉴定出103种非挥发性成分,经GC-MS/MS分析共鉴定出60种挥发性成分。40、60、80 μg/mL羊栖菜提取物可显著降低因脂多糖诱导而异常升高的BV2细胞活化程度和细胞上清液中TNF-α、IL-6的含量(P<0.05或P<0.01)。结论 本研究建立了海藻羊栖菜的化学成分全谱,并证实了羊栖菜具有一定的体外抗神经炎症活性。
关键词 羊栖菜;全谱分析;挥发性成分;非挥发性成分;抗神经炎症活性
ABSTRACT OBJECTIVE To study the composition of chemical constituents of Sargassum fusiforme and its in vitro anti- neuroinflammatory activity, and to provide reference for its development and utilization and the study of pharmacodynamic substances. METHODS UHPLC-QTOF-MS/MS analysis method and GC-MS/MS method were used to analyze the chemical constituents of S. fusiforme. The lipopolysaccharide (1 μg/mL) was adopted to establish the inflammatory model of neuromicroglia BV2. Using paroxetine (5 μg/mL) as positive control, CCK-8 assay was used to detect the effects of the extracts of S. fusiforme (20, 40, 60, 80, 100 μg/mL) on the activity and morphology of neuromicroglia BV2. The effects of the extracts of S. fusiforme (40, 60, 80 μg/mL) on the contents of tumor necrosis factor α (TNF-α) and interleukin-6 (IL-6) in cell supernatant were detected by ELISA. RESULTS A total of 103 non-volatile constituents were identified by UHPLC-QTOF-MS/MS, and 60 volatile constituents were obtained by GC-MS/MS. The extracts of S. fusiforme (40, 60, 80 μg/mL) could significantly reduce the abnormally increased activation of neuromicroglia BV2 and the contents of TNF-α and IL-6 due to lipopolysaccharide (P<0.05 or P<0.01). CONCLUSIONS The study establish the full spectrum of chemical constituents of S. fusiforme, and it is confirmed that S. fusiforme has certain in vitro anti-neuroinflammatory activity.
KEYWORDS Sargassum fusiforme; full spectrum analysis; volatile constituents; non-volatile constituents; anti- neuroinflammatory activity
羊棲菜Sargassum fusiforme (Harv.) Setch.是褐藻门马尾藻科马尾藻属植物的干燥藻体,习称“小叶海藻”,主要分布于辽宁、山东、福建、浙江、广东等沿海地带的温暖水域[1],是我国一种较为常见且资源丰富的海藻。据2020年版《中国药典》(一部)记载,羊栖菜的形状特点为分枝互生、无刺状突起、藻体较小、叶条形或细匙形[2]。羊栖菜早在《神农本草经》中就有记载,具有软坚散结、消痰利水之功效[3]。相关研究显示,羊栖菜所含成分具有降血糖[4]、减轻动脉粥样硬化的作用[5],是一种极具研究前景的药食两用植物。
我国的海洋资源十分丰富,海洋药物展现出了良好的开发前景[6-9]。但相比于传统中药,海洋药物的总体研究开发以及质量控制水平仍需加强,《中国药典》对包括羊栖菜在内的海洋药物主要是采用硫酸-蒽酮显色法控制其多糖含量,相关研究也多集中在羊栖菜多糖的制备、分离、结构确定及活性评价等方面[10-11],尚缺乏对羊栖菜相关功效涉及的潜在活性化合物(如黄酮类、香豆素类、生物碱类化学成分)的研究[12-13],忽视了羊栖菜所富含的小分子活性成分及其具备的潜在活性。
目前,已有报道采用化学分离的方法对羊栖菜乙酸乙酯、石油醚等萃取部位的成分进行分析[14],但对羊栖菜所含成分的全面分析研究尚为空白。鉴于此,本研究采用超高效液相飞行时间质谱联用技术(UHPLC- QTOF-MS/MS)和气相色谱-质谱联用技术(GC-MS/MS)获得海藻羊栖菜的全谱分析数据库,完善对海藻羊栖菜多糖以外的小分子化合物的研究,并开展以细胞模型为基础的羊栖菜体外抗神经炎症活性实验,为其今后功效活性成分的研究、质量控制方法的优化以及后续活性化合物的开发提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有AB SCIEX Triple TOF 5600+型高分辨飞行时间质谱联用仪(美国Sciex公司),LC-30A型超高效液相色谱仪(日本Shimadzu公司),Agilent 7890A/5975C型GC-MS/MS仪(美国Agilent公司),MS105DU型电子天平(瑞士Mettler Toledo公司),KQ-500B型超声波清洗仪(昆山市超声仪器有限公司),DZTW型调温电热套(北京市永光明医疗仪器有限公司),64R型恒温高速离心机(美国Beckman Coulter公司),Varioskan LUX型酶标仪(美国Thermo Fisher Scientific公司),TS100型倒置显微镜(日本Nikon公司)。
1.2 主要药品与试剂
海藻羊栖菜干燥药材(批号19061309)购自安国市一方药业有限公司,经江西中医药大学岐黄国医书院吴蜀瑶中药师鉴定为真品;7-羟基香豆素对照品(批号DSTDQ006601,纯度≥98%)、川陈皮素对照品(批号DST00690120,纯度≥98%)、滨蒿内酯对照品(批号AF21052105,纯度≥98%)、异贝壳杉烯酸对照品(批号DST210311-187,纯度≥98%)均购自成都埃法生物科技有限公司;蛇床子素对照品(批号201601114,纯度≥98%)、帕罗西汀对照品(批号2019021134,纯度≥98%)均购自成都瑞芬思生物科技有限公司;磷酸盐缓冲液(PBS,批号20210506)、高糖DMEM培养基均购自美国CellMax公司;胎牛血清购自美国Gibco公司;胰酶购自美国Solarbio公司;青霉素-链霉素(批号191118164)购自苏州新赛美生物科技有限公司;CCK-8试剂(批号GK100011)购自美国GlpBio公司;脂多糖购自美国Sigma公司;小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin- 6,IL-6)酶联免疫吸附检测(ELISA)试剂盒(批号分别为202107、202106)均购自江苏酶免实业有限公司;甲醇、乙醇、甲酸、乙腈为色谱纯,其余试剂均为分析纯,水为去离子水。
1.3 细胞株
小鼠小胶质细胞BV2购自中国科学院上海细胞库。
2 方法
2.1 羊栖菜化学成分分析
2.1.1 UHPLC-QTOF-MS/MS分析供试品溶液的制备 称取1 g羊栖菜药材粉末,加入10 mL 80%甲醇,超声(功率280 W,频率40 kHz)提取60 min,过滤,取续滤液置于10 mL量瓶中,以80%甲醇定容,即得。进样前,使用0.22 μm滤头过滤。
2.1.2 GC-MS分析供试品溶液的制备 取剪碎的药材500 g,置于10 000 mL圆底烧瓶中,加10倍量(5 000 mL)水,使用揮发油提取器提取8 h,收集所得挥发油,用精油小瓶封存。进样时,取200 μL挥发油置于10 mL量瓶中,加无水乙醇定容,然后使用0.45 μm微孔滤膜过滤。
2.2 色谱与质谱条件
2.2.1 UHPLC-QTOF-MS/MS分析条件 色谱条件如下:使用Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以水(含0.1%甲酸,A相)-乙腈(含0.1%甲酸,B相)为流动相进行梯度洗脱(0~15 mim,5%B→55%B;15~45 min,55%B→95%B;45~47 min,95% B;47~47.10 min,95%B→5%B);柱温为40 ℃;流速为0.3 mL/min,进样量为3 μL。质谱条件如下:使用正、负离子2种扫描模式,扫描范围为m/z 50~1 550;电压设置正、负值均为4 500 V,去簇电压为100 V;电喷雾离子源(ESI)温度为500 ℃;气帘气压力为40 psi,雾化气、辅助气压力均为50 psi;碰撞能量为(40±10) eV。
2.2.2 GC-MS分析条件 色谱条件如下:使用HP-5MS色谱柱(30 m×0.25 mm,0.25 μm);采用程序升温(初始温度为60 ℃、保持2 min,以2 ℃/min升温至80 ℃、保持2 min,以10 ℃/min升温至120 ℃、保持5 min,以10 ℃/min升温至160 ℃、保持5 min,以5 ℃/min升温至280 ℃、保持10 min);载气为氦气,载气流速为1.2 mL/min;进样量为2 μL,进样口温度为260 ℃,分流比为20 ∶ 1;传输管线温度为280 ℃。质谱条件如下:电子轰击离子源(EI)温度为230 ℃,四极杆温度为150 ℃,质量扫描范围为30~600 amu。
2.2.3 成分分析 利用Analyst TF 1.6、PeakView1.2 数据处理系统获取UHPLC-QTOF-MS/MS分析化合物的保留时间、质谱碎片信息等内容,通过与质谱数据库匹配以及与相关文献报道、对照品比对进行化合物鉴定。利用MSD ChemStation F.01.00.1903软件获取GC-MS/MS分析化合物的信息,并与NIST17数据库进行信息匹配,匹配度不低于90%[15]。
2.3 羊栖菜提取物的体外抗炎作用考察
2.3.1 提取物的制备 将羊栖菜干燥藻体剪碎后置于10 000 mL圆底烧瓶中,加入80%乙醇[料液比为1 ∶ 10(g/mL)]回流提取8 h,使用双层纱布过滤,收集滤液;残渣加5倍量(mL/g)80%乙醇回流提取1 h,使用双层纱布过滤;混合2次所得提取液,旋蒸挥去乙醇,将剩余浓缩液冷冻干燥24 h,研磨后制成冻干粉,置于干燥器内避光保存。给药时取该提取物冻干粉用PBS溶解,然后过0.2 μm除菌滤膜。
2.3.2 BV2细胞的培养 将BV2细胞接种于含有10%胎牛血清、1%双抗(100 U/mL青霉素、100 ?g/mL链霉素)的高糖DMEM完全培养基中,将细胞置于37 ℃、5%CO2培养箱中常规培养、传代。本研究使用第6代细胞进行实验。
2.3.3 BV2细胞活性测定 采用CCK-8法测定细胞存活率。取对数生长期的BV2细胞,均匀接种在96孔板中(6×103个/孔),分为空白对照组、模型组(1 μg/mL脂多糖)、阳性药物组(1 μg/mL脂多糖+5 μmol/L帕罗西汀,浓度根据前期预实验结果设置)、不同质量浓度羊栖菜提取物组[1 μg/mL脂多糖+20(或40、60、80、100) μg/mL海藻羊栖菜提取物,浓度梯度均根据前期预实验结果设置],每组设置3个复孔;并设置空白孔进行调零。将细胞常规培养至60%贴壁后,加入相应药液或空白培养基干预24 h,然后每孔加入10 μL CCK-8溶液,孵育1.5 h。使用酶标仪在450 nm波长处检测各孔的光密度(OD),计算细胞的存活率=(给药孔OD-空白孔OD)/(空白对照孔OD-空白孔OD)×100%;并使用显微镜观察各组细胞的形态进行综合分析。实验重复3次。
2.3.4 细胞上清液中炎症因子TNF-α、IL-6含量的测定 采用ELISA法进行测定。取对数生长期的BV2细胞,均匀接种在96孔板中(6×103个/孔),分为空白对照组、阳性药物组(1 μg/mL 脂多糖+5 μmol/L帕罗西汀)和不同质量浓度羊栖菜提取物组[1 μg/mL脂多糖+20(或40、80) μg/mL羊栖菜提取物],每组设置3个复孔。待细胞培养至60%贴壁左右时,加入药物干预24 h,然后取细胞上清液,按照试剂盒说明书操作,检测细胞上清液中炎症因子TNF-α、IL-6的含量。实验重复3次。
2.4 统计学方法
使用Graphpad Prism 8.0.2软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析;方差齐时组间两两比较用Tukey法,方差不齐时组间两两比较用Dunnetts T3法。检验水准α=0.05。
3 结果
3.1 UHPLC-QTOF-MS/MS分析结果
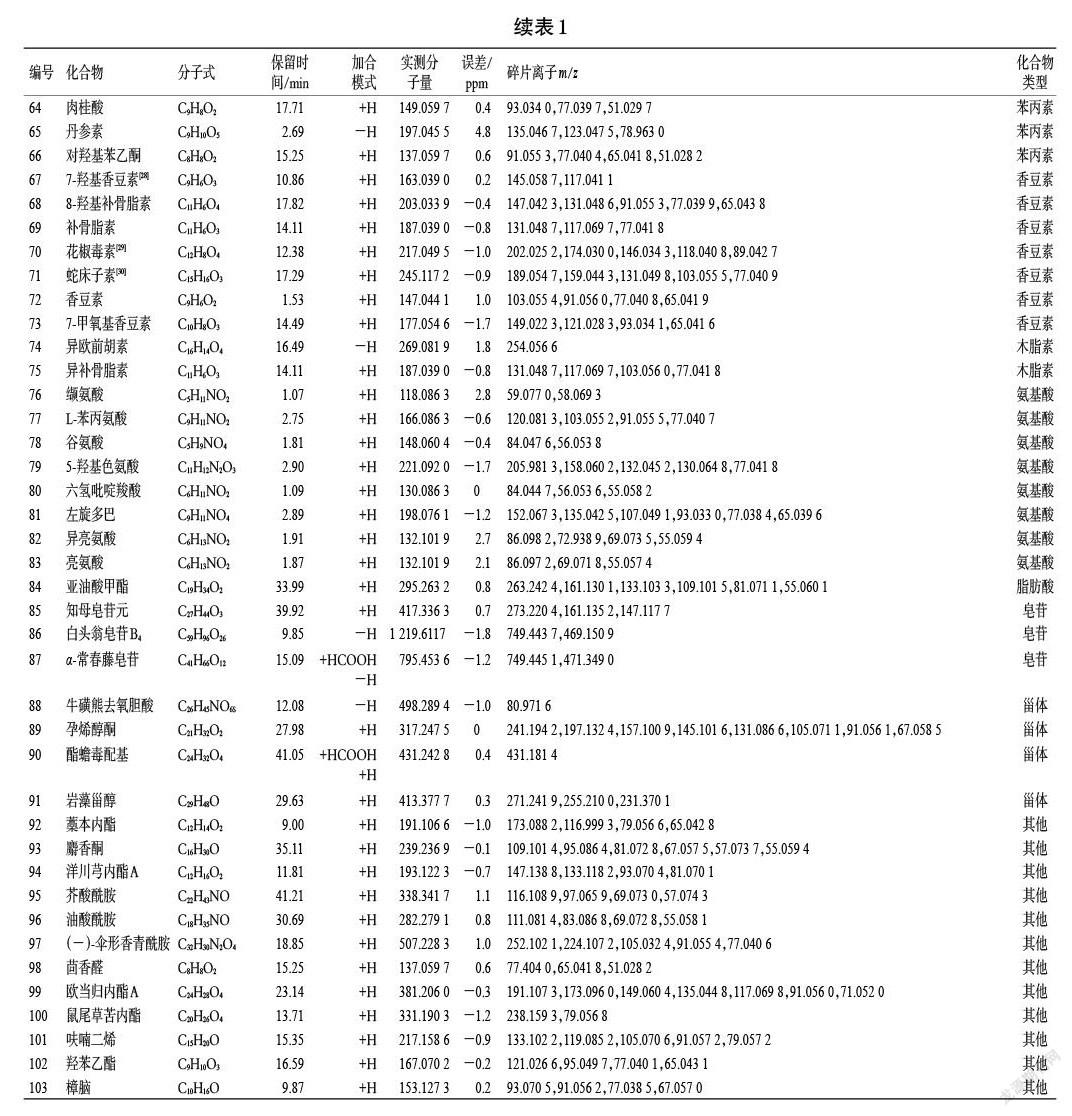
经UHPLC-QTOF-MS/MS分析,从羊栖菜中共鉴定出103种非挥发性成分,包括有机酸类成分3种、生物碱类成分13种、萜类成分24种、黄酮类成分13种、醌类成分1种、糖苷类成分2种、维生素类成分5种、苯丙素类成分5种、香豆素类成分7种、木脂素类成分2种、氨基酸类成分8种、脂肪酸类成分1种,皂苷类成分3种、甾体类成分4种和其他类成分12种。结果见图1、表1。
3.2 GC-MS检测结果
经GC-MS分析,初步鉴定出60种挥发性成分,包括烯类、烷类、酯类、酸类等,其中相对含量较高的有环十二烷、正十六烷、异植物醇、邻苯二甲酸二丁酯、棕榈酸、花生四烯酸、植物醇、植酮等。结果见图2、表2。
3.3 BV2细胞活性考察结果
与空白对照组比较,模型组细胞的存活率显著升高(P<0.01),提示脂多糖对BV2细胞有刺激活化的作用。与模型组比较,阳性药物组和羊栖菜提取物40、60、80、100 μg/mL组细胞的存活率均显著降低(P<0.05或P<0.01),提示上述药物对脂多糖诱导的BV2细胞活化均有一定抑制作用。结果见表3。
3.4 细胞形态观察结果
空白对照组细胞大多较圆润,胞体直径较小,未见形态较长的细胞突触生长。模型组活化细胞的数量显著增加,且胞体变肥大,细胞突触变长。阳性药物组和不同质量浓度羊栖菜提取物组细胞的胞体大多较圆润,与模型组比较,各给药组细胞的突触增长情况得到缓和、活化细胞数量减少。结果见图3。
3.5 细胞上清液中TNF-α、IL-6含量测定结果
与空白对照组比较,模型组细胞上清液中TNF-α、IL-6含量显著升高(P<0.01)。与模型组比较,阳性药物组和不同质量浓度羊栖菜提取物组细胞上清液中TNF-α、IL-6含量均显著降低(P<0.05或P<0.01)。结果见表4。
4 讨论
物质基础研究是药物开发和活性研究的关键环节。为了更加全面地提取、分析羊栖菜的化学成分,本课题组前期分别比较了不同极性溶剂(80%甲醇、乙酸乙酯、乙醇、水)、不同超声提取时间(10、30、60、90 min)对样品中非挥发性成分提取效果的影响。结果表明,当溶剂为80%甲醇、提取时间为60 min时,提取物中可以检测到的化合物数量最多、各成分的相对含量更高。为使实验操作简便、高效,本研究选择以80%甲醇为提取溶剂,采用超声提取60 min的方式制备UHPLC-QTOF-MS/MS分析的样品。此外,本课题组前期还比较了不同极性溶剂(三氯甲烷、丙酮、石油醚、乙酸乙酯、无水乙醇)、不同提取方式(索氏提取法、水蒸气蒸馏法)和不同提取时间(4、6、8 h)对样品中挥发性成分提取效果的影响。结果发现,当使用索氏提取法以石油醚为溶剂提取4 h时,能检测并鉴定出50种化合物;當使用水蒸气蒸馏法提取8 h时,能检测并鉴定出60种化合物。为了更加全面地分析羊栖菜成分,本研究选择了以水蒸气蒸馏法提取8 h的方式制备GC-MS/MS分析的样品。
本研究首次使用UHPLC-QTOF-MS/MS结合GC- MS/MS进行了羊栖菜的全成分分析。通过UHPLC- QTOF-MS/MS分析共鉴定出103种非挥发性成分,通过GC-MS/MS分析共鉴定出60种挥发性成分,完善了羊栖菜的全成分研究。有研究表明,7-羟基香豆素、补骨脂素、蛇床子素等香豆素类小分子化合物对于神经系统有保护作用[31-34]。尤其是蛇床子素,其对于阿尔茨海默病患者的神经损伤具有一定保护作用[35]。海藻羊栖菜所含成分中包含以上多种小分子香豆素类化合物,故本课题组推测,羊栖菜具有潜在的抗神经炎症作用。
IL-6可调节免疫应答和多种细胞的生长、分化,临床常通过监测IL-6含量来评估炎症反应的严重程度[36] 。TNF-α是一种重要的炎症因子,在细胞增殖、分化和凋亡中扮演重要角色[37]。本研究建立體外脂多糖诱导BV2细胞炎症模型,选取可调节经典炎症通路——丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路、抑制小胶质细胞激活的帕罗西汀作为阳性药物对照[38],来探索羊栖菜的抗神经炎症活性。结果显示,脂多糖可激活BV2细胞,促进炎症因子IL-6、TNF-α的产生;经羊栖菜提取物干预后,BV2细胞活性和细胞上清液中TNF-α、IL-6含量均显著降低,表明羊栖菜提取物具有一定的抗神经炎症活性。
综上所述,本研究建立的UHPLC-QTOF-MS/MS法与GC-MS/MS法可快速、有效地对羊栖菜中化学成分进行全谱分析,为海藻羊栖菜的物质基础研究和质量控制研究提供了理论依据;羊栖菜提取物对BV2细胞具有较好的体外抗神经炎症作用,但是具体的作用机制仍不明确。本课题组后期将继续开展羊栖菜抗神经炎症作用机制研究,期望在当前的物质基础研究结果上进一步探索其主要药效活性成分及作用机制。
参考文献
[ 1 ] 史永富.羊栖菜(Sargassum fusiforme(Harv.)Setchel)的研究现状及前景[J].现代渔业信息,2006,21(5):20-23.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:308.
[ 3 ] 崔征,李玉山,肇文荣,等.中药海藻及数种同属植物的药理作用[J].中国海洋药物,1997,16(3):5-8.
[ 4 ] JIA R B,LI Z R,OU Z R,et al. Physicochemical characterization of Hizikia fusiforme polysaccharide and its hypoglycemic activity via mediating insulin-stimulated blood glucose utilization of skeletal muscle in type 2 diabetic rats[J]. Chem Biodivers,2020,17(10):e2000367.
[ 5 ] YAN Y,NIU Z M,WANG B Y,et al. Saringosterol from Sargassum fusiforme modulates cholesterol metabolism and alleviates atherosclerosis in ApoE-deficient mice[J]. Mar Drugs,2021,19(9):485.
[ 6 ] 刘宸畅,徐雪莲,孙延龙,等.海洋小分子药物临床研究进展[J].中国海洋药物,2015,34(1):73-89.
[ 7 ] 王成,张国建,刘文典,等.海洋药物研究开发进展[J].中国海洋药物,2019,38(6):35-69.
[ 8 ] RUSSO P,KISIALIOU A,LAMONACA P,et al. New drugs from marine organisms in Alzheimers disease[J].Mar Drugs,2015,14(1):5.
[ 9 ] WANG X Y,SUN G Q,FENG T,et al. Sodium oligomannate therapeutically remodels gut microbiota and suppres- ses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimers disease progression[J]. Cell Res,2019,29(10):787-803.
[10] HU P,LI Z X,CHEN M C,et al. Structural elucidation and protective role of a polysaccharide from Sargassum fusiforme on ameliorating learning and memory deficiencies in mice[J].Carbohydr Polym,2016,139:150-158.
[11] ZHANG R,ZHANG X X,TANG Y X,et al. Composition,isolation,purification and biological activities of Sargassum fusiforme polysaccharides:a review[J]. Carbohydr Polym,2020,228:115381.
[12] CHEN X M,YU G Q,FAN S R,et al. Sargassum fusiforme polysaccharide activates nuclear factor kappa-B (NF-κB) and induces cytokine production via Toll-like receptors[J]. Carbohydr Polym,2014,105:113-120.
[13] JIA R B,LI Z R,WU J,et al. Physicochemical properties of polysaccharide fractions from Sargassum fusiforme and their hypoglycemic and hypolipidemic activities in type 2 diabetic rats[J]. Int J Biol Macromol,2020,147:428-438.
[14] 李娟娟,马丽娜,杜瑞华,等.羊栖菜挥发性、半挥发性成分的提取及分析方法研究[J].广东化工,2016,43(16):80-83.
[15] 史芳芳,周孟焦,梁晓峰,等.竹叶花椒叶挥发油提取及其化学成分的GC-MS分析[J].中药材,2020,43(5):1191- 1195.
[16] WOOD K V,BONHAM C C,MILES D,et al. Characte- rization of betaines using electrospray MS/MS[J]. Phytochemistry,2002,59(7):759-765.
[17] LIAO C R,CHANG S,YIN S L,et al. A HPLC-MS/MS method for the simultaneous quantitation of six alkaloids of Rhizoma Corydalis Decumbentis in rat plasma and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2014,944:101-106.
[18] 赵利娟,高文雅,顾欣如,等.蒲地蓝消炎口服液化学成分鉴定及归属研究[J].中国中药杂志,2019,44(8):1573- 1587.
[19] NIE L J,LIANG J,SHAN F,et al. A UPLC-MS/MS method for determination of endogenous L-carnitine and acetyl-L-carnitine in serum of patients with depression[J]. Biomed Chromatogr,2021,35(3):e4991.
[20] 蘆丽,宫旭,冯有龙. UPLC-IT/TOF MS快速筛查确证保健食品中36种非法添加的减肥、降血脂、通便类药物[J].中南药学,2019,17(10):1667-1676.
[21] LEE M Y,MOON B C,KWON Y K,et al. Discrimination of Polygonatum species and identification of novel mar- kers using 1H-NMR-and UPLC/Q-TOF MS-based metabolite profiling[J]. J Sci Food Agric,2016,96(11):3846- 3852.
[22] LIANG X,LIU C S,XIA T,et al. Identification of active compounds of Mahuang Fuzi Xixin Decoction and their mechanisms of action by LC-MS/MS and network pharmacology[J]. Evid Based Complement Alternat Med,2020,2020:3812180.
[23] ZHAO A Q,ZHAO J H,ZHANG S Q,et al. Determination of parthenolide in rat plasma by UPLC-MS/MS and its application to a pharmacokinetic study[J]. J Pharm Biomed Anal,2016,119:99-103.
[24] 柴冲冲,曹妍,毛民,等.基于HPLC特征图谱、UPLC-Q- TOF/MS定性及多成分定量的黄芩酒炙前后化学成分变化研究[J].中草药,2020,51(9):2436-2447.
[25] CHEN Z T,CHU H L,CHYAU C C,et al. Protective effects of sweet orange (Citrus sinensis) peel and their bioactive compounds on oxidative stress[J]. Food Chem,2012,135(4):2119-2127.
[26] 罗美霞,吴波,胡坪君,等. 基于UPLC-Q-TOF-MS的砂糖橘皮化学成分分析[J].中国实验方剂学杂志,2017,23(21):45-51.
[27] 孙国东,霍金海,潘五九,等. 基于UPLC-Q-TOF/MS技术的槐角药材化学成分分析[J].中草药,2019,50(16):3774-3783.
[28] 魏文峰,陈宏昌,刘烨,等.基于UPLC-Q-TOF-MS技术的刺五加叶血清药物化学初步研究[J].中草药,2017,48(7):1306-1313.
[29] 任晓蕾,霍金海,孙国东,等. UPLC-Q-TOF-MS法分析防风中香豆素类化学成分[J].中国药房,2019,30(3):349-354.
[30] 李坤平,高崇凯,李卫民. UPLC/ESI-TOF-MS/MS分析蛇床子提取物中香豆素类化合物[J].中成药,2009,31(4):584-587.
[31] QIN T T,FANG F,SONG M T,et al. Umbelliferone reverses depression-like behavior in chronic unpredictable mild stress-induced rats by attenuating neuronal apoptosis via regulating ROCK/Akt pathway[J]. Behav Brain Res,2017,317:147-156.
[32] 高海南,刘斌,刘国良,等.补骨脂素对Aβ损伤PC12细胞的保护作用研究[J].中药材,2019,42(1):174-177.
[33] TANG H Q,LI K M,DOU X B,et al. The neuroprotective effect of osthole against chronic sleep deprivation (CSD)-induced memory impairment in rats[J]. Life Sci,2020,263:118524.
[34] BAO Y X,MENG X L,LIU F N,et al. Protective effects of osthole against inflammation induced by lipopolysaccharide in BV2 cells[J]. Mol Med Rep,2018,17(3):4561-4566.
[35] 郑为娜.蛇床子素對阿尔茨海默病模型大鼠认知障碍的神经保护作用及其机制研究[D].石家庄:河北医科大学,2015.
[36] TANAKA T,NARAZAKI M,MASUDA K,et al. Regulation of IL-6 in immunity and diseases[J]. Adv Exp Med Biol,2016,941:79-88.
[37] ZELOV? H,HO?EK J. TNF-α signalling and inflammation:interactions between old acquaintances[J]. Inflamm Res,2013,62(7):641-651.
[38] LIU R P,ZOU M,WANG J Y,et al. Paroxetine ameliorates lipopolysaccharide-induced microglia activation via differential regulation of MAPK signaling[J]. J Neuroinflammation,2014,11:47.
(收稿日期:2021-12-09 修回日期:2022-03-07)
(编辑:林 静)

