环状RNA在肺纤维化中的作用研究进展
李海龙,张若彤,卫怡颖,张杉杉,马博威,李霄鹤,2,周红刚,2
(1.南开大学药学院,天津 300350;2.天津国际生物医药联合研究院,天津 300450)
肺纤维化(pulmonary fibrosis,PF)是一种慢性进行性疾病,最初纤维结缔组织沉积,进而影响肺泡气体交换,导致呼吸衰竭,最终死亡[1]。PF可分为原发性、药物性、免疫性和特发性PF(idiopathic PF,IPF)等。IPF比例最高,全世界约有300万人患有PF疾病,诊断后平均生存期2~4年[2]。到目前为止,IPF的治疗药物只有美国食品药品管理局批准的抗纤维化药物吡非尼酮(pirfenidone)和尼达尼布(nintedanib),且只能缓解肺功能下降,并不能逆转已经形成的纤维化[3]。因此迫切需要寻找新的针对该疾病的治疗靶点。许多研究表明,环状RNA(circular RNA,circRNA)参与了PF的发病机制。例如,在IPF患者的肺组织中检测到circRNA同源域相互作用蛋白激酶3(circular homeodomain interacting protein kinase 3,circHIPK3)表达异常,提示干预circHIPK3可能是治疗IPF的一种有希望的方法[4]。Yao等[5]报道,在经二氧化硅(silicon dioxide,SiO2)处理的肺上皮细胞及小鼠PF组织中,circRNA CDR1as可以通过miR-7释放转化生长因子β受体2(transforming growth factor-β receptor 2,TGF-βR2),进而促进上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程,在PF过程中发挥重要作用。miR-7与circRNA CDR1as之间的相互作用可能在PF中发挥重要作用,并可能是潜在的治疗靶点。本综述系统总结circRNA在PF病理机制中的作用及其调控机制,有助于阐明PF的发病机制及其治疗。
1 环状RNA分类与功能
circRNA由前体mRNA反向剪切形成,是一种共价闭环结构的非编码RNA。与线性mRNA不同,circRNA不含5′端帽子和3′端多聚腺苷酸尾巴结构,不受RNA外切酶影响,不易降解,可更稳定存在[6]。早在20世纪末circRNA即被发现,但最初被认为是基因剪切的副产物。随着高通量测序技术发展,大量组织特异性或细胞特异性的circRNA被成功识别[7-8]。研究表明,circRNA在细胞增殖、迁移、侵袭和多能性等多种生物学功能中发挥重要作用[9]。circRNA可以作为竞争性内源性RNA或蛋白编码RNA,或与RNA结合蛋白(RNA-binding proteins,RBP)相互作用,广泛参与糖尿病、神经系统疾病和纤维化等疾病的生理和病理过程[10]。
根据母本基因的外显子和内含子环化方式不同,circRNA有3种成环机制[11](图1)。① 剪切体的索尾插接调控。在前体mRNA中外显子下游的5′端连接到上游的3′端形成索尾插接环化,然后通过剪切形成circRNA。②顺式作用元件调控。一种内含子中含有反向互补序列,形成双链RNA,然后通过可变剪切形成含内含子和不含内含子的circRNA;另一种是外显子以及两旁的内含子竞争进行RNA配对,进而通过可变剪切形成circRNA。③RBP调控。RBP结合内含子,从而促进circRNA的形成。
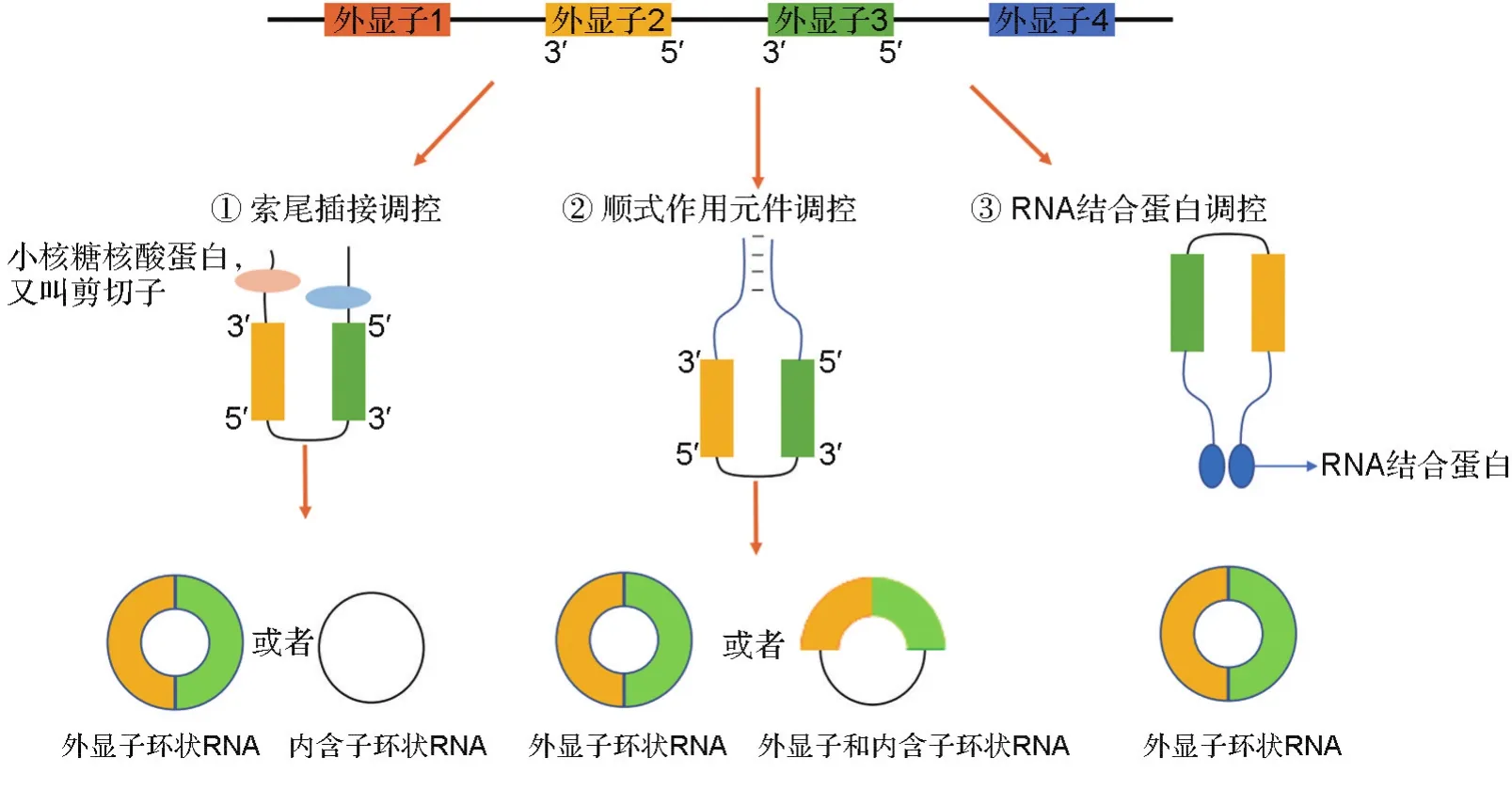
图1 环状RNA成环机制和分类.
根据包含的母本基因内含子和外显子的不同,circRNA可分为3类[12](图1)。① 只有外显子的circRNA(exonic circRNA);② 只有内含子的circRNA(intronic circRNA);③ 同时有外显子和内含子的circRNA(exon-intron circRNA)。此外,circRNA还可以发挥重要的生物学功能,如剪接或转录、与RBP结合发挥功能、微RNA海绵作用和翻译蛋白质等。
2 环状RNA在肺纤维化中的调控作用
2.1 在上皮-间充质转化中的作用
EMT是指上皮细胞失去顶基极性和细胞黏附特性通过特定的过程向间质细胞转化的生物学过程[13]。TGF-β1/Smad经典信号通路在参与肺泡上皮细胞EMT的激活中起着主导作用[14]。在纤维化过程中,EMT诱导信号的持续,产生细胞外基质积累,导致组织重塑和器官病理变化。然而,EMT在IPF发生中的作用存在争议。Jason等[15]研究报道,在博来霉素诱导的小鼠PF模型中跟踪肺泡Ⅱ型上皮细胞(alveolar type Ⅱ epithelial cells,AT-Ⅱ细胞)的命运,发现标记的AT-Ⅱ细胞未转变为肌成纤维细胞。然而,IPF来源的间充质细胞常被发现共同表达上皮和间充质标志物,因此,这表明IPF来源间充质细胞是上皮细胞经过EMT转化生成的[16]。虽然IPF的具体发病机制尚不完全清楚,但目前大多数研究认为,在一定程度上EMT是存在的。
Yao等[5]报道,miR-7可以通过阻断人支气管上皮细胞(human bronchial epithelial cells,HBE)和人肺癌细胞A549的EMT进程而发挥其抗PF的作用。生物信息学分析发现,circRNA CDR1as与miR-7有多个结合位点。circRNA CDR1as可抑制miR-7对EMT及其靶标TGF-βR2的抑制作用,从而导致PF。
Fang等[17]报道,SiO2诱导的细胞增殖、迁移和标志物水平的改变可通过靶向circHECTD1的小干扰RNA恢复,也可通过CRISPR/Cas9系统使HECTD1过表达,证实circHECTD1/HECTD1通路参与内皮细胞-间充质转化(endothelial-mesenchymal transition)。该研究发现,circHECTD1/d1可能与潜在硅肺患者PF发生有关。Jiang等[18]报道,circZC3H4作为miR-212海绵调控ZC3H4表达,在EMT中发挥关键作用。在肺纤维化模型小鼠和IPF患者肺泡上皮细胞中ZC3H4表达上调。
2.2 在成纤维细胞激活和肌成纤维细胞活化中的作用
肺组织中由肌成纤维细胞和细胞外基质蛋白异常表达组成的纤维化灶的形成是IPF的一个显著的病理特征。研究表明,肌成纤维细胞是最终导致严重纤维化过程的细胞[19-20]。肺肌成纤维细胞的累积主要来自于肺组织的成纤维细胞。因此,了解成纤维细胞向肌成纤维细胞转化(fibroblast-to-myofibroblast transition,FMT)过程在IPF中的发生,可能会成为预防IPF进展的有效手段。
Zhang等[4]报道,circHIPK3在IPF患者肺组织中表达异常,且在博来霉素诱导的PF模型小鼠和FMT的肌成纤维细胞中表达升高。进一步研究发现,circHIPK3沉默可以改善FMT并抑制成纤维细胞在体内外增殖。另一项研究发现,在IPF模型小鼠和FMT衍生的肌成纤维细胞中,circ0044226升高,而miR-7降低。circ0044226作为内源性miR-7海绵可以改善FMT,抑制成纤维细胞的活力和增殖。circ0044226的介入治疗可能是一种很有前途的治疗PF方法[21]。Chu等[22]研究报道,在HPF-α细胞中过表达circHECTD1或敲除HECTD1可逆转SiO2诱导的细胞自噬,进而恢复SiO2诱导的成纤维细胞活化、增殖和迁移。
2.3 对巨噬细胞的调控作用
巨噬细胞在组织纤维生成中起关键作用,是许多终末期慢性炎症性疾病发病机制的基础[23]。在许多慢性炎症性疾病中,纤维化是进行性器官衰竭的原因。巨噬细胞是纤维发生的主要驱动力,并与产生胶原的肌成纤维细胞非常接近。它们产生可直接激活成纤维细胞的纤维变性因子,如TGF-β1和血小板衍生因子,并通过调节各种基质金属蛋白酶和基质金属蛋白酶组织抑制剂的平衡来控制细胞外基质更新[24]。巨噬细胞还可通过分泌募集成纤维细胞和其他炎症细胞的趋化因子来调节纤维生成。SiO2刺激肺泡上皮细胞发生炎症反应,进而导致成纤维细胞增殖引起纤维化。Zhou等[25]报道,circHECTD1和HECTD1可通过泛素化参与SiO2诱导的巨噬细胞活化,进而促进成纤维细胞增殖和迁移。该研究为硅肺治疗提供了新思路。
Yang等[26]报道,巨噬细胞在PF中具有重要作用,circRNA在SiO2诱导的肺巨噬细胞炎症中也发挥重要作用。他们采用健康供体和患者肺泡巨噬细胞原代培养及RAW264.7巨噬细胞系,探讨circ-ZC3H4在巨噬细胞活化中的作用。研究结果表明,circZC3H4和ZC3H4蛋白参与了SiO2诱导的巨噬细胞活化并且可促进成纤维细胞增殖和迁移。在硅肺患者的组织样本中发现ZC3H4蛋白表达增强。该结果阐明了SiO2诱导的巨噬细胞活化与circ-ZC3H4/ZC3H4途径之间的关系,从而为应用ZC3H4开发新的硅肺治疗策略提供了新思路。
2.4 在转化生长因子β信号通路中的作用
过去20年来,纤维化发生对TGF-β活性的依赖性一直是研究的重点[27-28]。TGF-β相关信号通路在细胞增殖、分化、迁移、细胞外基质沉积及上皮细胞损伤后修复等方面具有重要作用。其中,TGF-β1在IPF中至关重要[29],是目前公认的最重要的促纤维化信号。在IPF疾病进展过程中,TGF-β1可活化炎症细胞,介导肺泡EMT,促进成纤维化细胞增殖分化和刺激细胞外基质沉积等,在PF发病过程中起着重要的中心调控作用。
近年来有研究发现,miRNA可通过调节TGF-β1/Smad信号通路调节PF进程。Lindsay等[30]揭示了miR-1343在减弱肺上皮细胞系和原代成纤维细胞中TGF-β信号传导中的作用。MiR-9-5p可靶向TGF-βR2和尼克酰胺腺嘌呤二核苷酸磷氧化酶4调节PF等[31]。然而关于circRNA通过TGF-β相关信号通路调节IPF的研究知之甚少。Yang等[32]对博来霉素诱导的PF大鼠肺组织进行了RNA-seq,探索了潜在的与PF相关的circRNA和基因。进一步通过基因本体(gene ontology,GO)和全基因组及代谢途径数据库(kyoto encyclopedia of genes and genomes,KEGG)分析,揭示circRNA在PF中的关键功能和通路。GO分析证实,差异表达的circRNA在细胞成分、分子功能和生物学过程中明显聚集。在KEGG分析中,circRNA的富集途径有抗原处理和表达、吞噬体、磷脂酰肌醇3-激酶/蛋白激酶B信号通路、Ⅰ型人类嗜T细胞病毒感染和单纯疱疹病毒感染等。对PF大鼠模型进行验证后发现,其中5个circRNA与预测的趋势相对一致,与PF密切相关;并且发现chr9:113534327|11354 6234,chr20:14319170|14326 640和chr10:5763 4023|57634588可能通过调节易位相关的Notch同源基因(notch homolog 1,translocation-associated,Notch1)和TGF-β相关信号通路参与PF进程,但上述结果仍需进一步实验验证。Yao等[5]报道,SiO2可诱导环状RNA小脑变性相关蛋白1转录物的反义物(antisense to the cerebellar degeneration-related protein 1 transcript,circRNA CDR1as)使miR-7海绵释放TGF-βR2,在PF中通过促进EMT发挥重要作用。该结果表明,miR-7和circRNA CDR1as之间的相互作用可能发挥重要功能,并为PF提供潜在的治疗靶点。
2.5 其他机制
内质网(endoplasmic reticulum,ER)是一种维持蛋白质稳态的特殊细胞器。ER主要用于蛋白质折叠和蛋白质到达胞内或胞外目的地前的质量控制[33]。ER应激是由各种应激刺激引起的缺血再灌注损伤、氧化应激和钙稳态失衡[34],是许多疾病发生发展的关键因素,包括神经退行性变、糖尿病、癌症、代谢性疾病和IPF等[35]。自噬可以减轻细胞应激的影响,将受损或处理不当的蛋白质和细胞器运送到溶酶体进行降解,从而为代谢提供能量[36]。自噬抑制与肌成纤维细胞表型转化有关,自噬标志物在IPF患者的全肺细胞中明显降低[37]。Cheng等[38]报道,circ-012091调控的 P53凋亡刺激蛋白PPP1R13B通过ER应激和自噬促进肺成纤维细胞的增殖和迁移,在硅肺PF的发病过程中起着至关重要的作用。Cao等[39]还发现,SiO2诱导ER应激与sigma-1受体表达增强有关,而circHIPK2参与了sigma-1受体在人肺成纤维细胞中的调控。该研究阐明了SiO2诱导的纤维化与sigma-1受体信号转导之间的联系,从而为研究sigma-1受体/ER应激在硅肺治疗潜在应用提供了新见解。
3 环状RNA在肺纤维化诊断治疗中的作用
circRNA是近年来RNA研究领域的一个热点,是某些疾病的潜在治疗靶点和诊断性生物标志物。Li等[40]通过circRNA表达谱芯片在IPF患者的血浆中识别出67个严重失调的circRNA,其中38个上调,29个下调。进一步验证表明,与健康对照组相比,IPF患者的血浆样本中(hsa)_circRNA_100906,hsa_circRNA_102100和 hsa_circRNA_102348均显著升高,hsa_circRNA_101225,hsa_circRNA_104780和hsa_circRNA_101242表达降低。此外,荧光素酶报告基因分析证实,hsa_circRNA_100906和hsa_circRNA_102348分别与miR-324-5p和miR-630直接相互作用,提示在IPF患者肺组织中miR-324-5p和miR-630降低。上述结果表明,hsa_circRNA_100906和hsa_circRNA_102348及其相关通路可能成为IPF新的临床标志物和治疗靶点。
4 结语
circRNA是非编码RNA的一种,可通过多种机制调控基因表达,参与多种细胞分化和生物发育过程。研究发现,circRNA在IPF中发挥重要作用,然而其作用机制仍未完全阐明。综上所述,circRNA与IPF发病密切相关,包括调节EMT、FMT、巨噬细胞、TGF-β、ER应激和自噬等,然而其在IPF中的上皮细胞修复、细胞衰老、胶原沉积以及Smad和non-Smad通路的调控作用未见报道。目前的研究也主要集中于生理和病理过程中其表达的变化。circRNA不受RNA外切酶影响,不易降解,故被作为多种疾病诊断和治疗的生物标志物,如circRNA 100906和circRNA 102348已被鉴定为IPF的生物标志物,但仍需更多的工作来探索它们在PF临床上的作用。目前已发现大量circRNA与PF有关,但仍处于初步研究阶段。未来circRNA可能会成为基因调控的重要参与者,探索circRNA在诊断PF和基因治疗具有重要意义。

