紫苏提取物对白鲢鱼糜挥发性成分及贮藏品质的影响
牛宇光,杨 宏,2,王玉栋,庄 洋
(1 华中农业大学 食品科学技术学院,湖北 武汉 430070;2 湖南文理学院 水产高效健康生产湖南省协同创新中心,湖南 常德 415000)
白鲢鱼糜具有脂肪少、易消化吸收和营养价值高等优点。但所有的鱼类均存在一定腥味,作为淡水鱼的白鲢尤为明显[1],且随着贮藏时间延长,鱼肉中的脂质、蛋白质发生氧化降解,产生醛、酮等挥发性化合物,影响鱼肉的鲜度和口感。在鱼糜的加工生产流程中,漂洗可除去鱼肉中的残留色素、鱼体脂肪、碎骨以及一些令人不悦的挥发性成分,改善鱼糜风味,提升鱼糜制品的色泽和品质[2]。目前使用的漂洗液大多为蒸馏水和含有高价金属离子的漂洗液,在改善鱼糜制品的风味和凝胶品质的同时也会对鱼糜制品的营养成分、口感等造成影响,一些漂洗液还对人体有害[3-4]。因此,探究一种新型绿色健康的漂洗液,对去除鱼糜制品的不良风味及改善其贮藏品质均具有重要意义。
紫苏作为我国药食两用植物,因其含有酚类、黄酮类、挥发油等活性物质而具备抑菌、抗氧化性[5],可有效改善鱼糜制品的风味和贮藏品质。研究表明,紫苏叶经蒸馏水-乙醇加热提取后,提取物中含有较多酚类物质,如阿魏酸、芹菜素、槲皮素、迷迭香酸等[6],这些酚类物质对很多自由基均具有清除作用[7-8],可有效延缓鱼糜制品腐败变质。
本试验采用蒸馏水-乙醇提取紫苏叶中的活性物质,通过分析传统蒸馏水漂洗、蒸馏水-紫苏提取物漂洗对白鲢鱼糜制品中挥发性化合物和贮藏品质的影响,探究紫苏提取物漂洗对白鲢鱼糜制品风味及品质的影响,以期为紫苏在食品行业中的深入研究及应用提供参考。
1 材料与方法
1.1 主要材料与试剂
紫苏叶购于吉林市邹氏生鲜农贸市场;新鲜白鲢购于华中农业大学农贸市场;福林酚(分析纯)购于Sigma公司;氯化钠(分析纯)、甲醇(色谱纯)、乙腈(色谱纯)、磷酸(色谱纯)、环己酮(色谱纯),购于国药集团化学试剂有限公司。
1.2 主要仪器与设备
HH-6恒温水浴锅,国华电器有限公司;Ultra Scan XE色度仪,美国Hunterlab公司;HR7625食物料理机,中国香港飞利浦家庭电器有限公司;UV-1800紫外分光光度计,日本岛津公司;PB-10酸度计,德国Sartorious公司;FOX400电子鼻,法国Alpha M.O.S公司;PDMS/DVB/CAR萃取头,上海安谱科学仪器有限公司;GC 7890B-MS 5977B气质联用仪,Agilent公司;e2695+2998PDA+FLD高效液相色谱仪,美国Waters公司。
1.3 试验方法
1.3.1 紫苏提取物的制备 紫苏叶晾干后破碎,过178 μm纱网,加入蒸馏水(液料质量比10∶1)、质量分数7.5% NaCl(按紫苏质量计算),90 ℃加热提取3 h;真空抽虑收集滤液,剩余滤渣添加体积分数95%乙醇(液料质量比3∶1),萃取1 h,过滤后收集滤液,用旋转蒸发仪蒸出乙醇;将上述滤液合并后,置于干燥箱内40 ℃烘干,研磨成粉,4 ℃存储备用。
1.3.2 紫苏提取物的定性及定量 采用福林酚法测定紫苏提取物的总酚含量,并用没食子酸表示。色谱条件[9]:色谱柱:C18柱,4.6 mm×250 mm,5 μm粒径;流动相:A为乙睛,B为0.1%磷酸;洗脱程序:0~3 min:5% A;3~6 min:10% A;6~8 min:30% A;8~9 min:35% A;9~11 min:40% A;11~12 min:50% A;12~15 min:65% A;15~20 min:75% A;20~25 min:90% A;25~28 min:5% A。柱温30 ℃,紫外检测波长280 nm,流速1 mL/min,进样量10 μL。咖啡酸、阿魏酸、迷迭香酸、榭皮素和芹菜素均制备为质量浓度梯度为5,10,25,50和100 μg/mL的混合标品,紫苏多酚提取物配成250 μg/mL的稀释液,溶剂均为色谱纯甲醇;过0.45 μm的滤膜后上机检测。
1.3.3 检测样品的制备 新鲜白鲢去内脏、鳞、皮后,用冷水(4 ℃)清洗干净。从鲢鱼两侧收集鱼肉,放入料理机中空斩30 s。将鲢鱼肉糜与4 ℃冰水按质量比1∶3混合,搅拌5 min,4 ℃保存10 min,过滤去水。蒸馏水重复洗涤2次,第3次洗涤时,分别使用蒸馏水、质量分数0.1%紫苏提取物、0.3%紫苏提取物水溶液漂洗,然后将鱼糜放入料理机中空斩1 min;加入质量分数2.5% NaCl(按鱼糜质量计算),盐斩1 min;加冰水将鱼糜含水量调节为80%,继续斩拌1 min;手动灌肠,肠衣直径20 mm,长度25 cm,两端封口。将鱼肠于40 ℃水浴煮制60 min,90 ℃煮制30 min,0 ℃冰水中冷却20 min,依次命名为对照组、0.1%漂洗组、0.3%漂洗组,全部鱼肠样品于4 ℃冷藏备用。
1.3.4 电子鼻检测 根据谢青青[10]的方法稍作修改。取2.0 g鱼肠样品,置于10 mL顶空瓶中,加盖密封后顶空平衡120 s,顶空温度35 ℃,进样口温度45 ℃,流量150 mL/min,采样时间间隔10 s,搅拌速率500 r/min,样品收集时间120 s,滞后时间300 s。
1.3.5 风味物质检测 将6 g鱼肠与5 mL 5.4 mol/L NaCl饱和溶液混合,均质1 min;将5 mL鱼浆倒入20 mL顶空瓶中,加入10 μL 1 μL/mL环己酮,在气质联用仪中70 ℃平衡10 min;用DVB/CAR/PDMS萃取头在70 ℃下吸附40 min,挥发性化合物在250 ℃下解吸4 min。
气相色谱条件:色谱柱为DB-5MS(60 m×0.32 mm×0.25 μm);起始温度40 ℃,保持3 min;以5 ℃/min升到200 ℃,保持2 min;再以10 ℃/min升到250 ℃,保持5 min;载气为He,流量1.0 mL/min,进样口温度250 ℃,不分流。
质谱分析条件:采用EI离子源,电离能量70 eV,离子源温度230 ℃,传输线温度280 ℃,四级杆温度150 ℃,溶剂延迟2 min,质量扫描为30~500 amu,扫描速率:2.0 cm/s。
1.4 测定指标及方法
将鱼肠在4 ℃下贮藏0,3,5,7,9,12 d后取样,用于色度、菌落总数、挥发性盐基氮(TVB-N)、2-硫代巴比妥酸(TBARS)值和pH值的测定。
1.4.1 色度测定 将恢复至室温的鱼肠样品切成厚度10 mm的薄片,用高精度色度仪测定样品的L*、a*、b*值。样品设6个平行,结果取平均值。白度值(whiteness,W)按下式计算:
(1)
式中:W表示白度,L*表示亮度,a*表示红绿值,b*表示黄蓝值。
1.4.2 菌落总数测定 参考GB 4789.2-2010《食品微生物学检验:菌落总数测定》测定菌落总数。
1.4.3 挥发性盐基氮(TVB-N)值的测定 TVB-N值可以反映原料鱼和肉的鲜度。测定时称取5 g样品,加入50 mL质量分数7.5%三氯乙酸(含质量分数0.1% EDTA)均质,使用全自动定氮仪测定。
1.4.4 2-硫代巴比妥酸(TBARS)值的测定 TBARS值可以反映食物中油脂腐败的程度。参考彭晶[11]的方法测定。
1.4.5 pH值测定 参考GB/T 5009.45-2003《水产品卫生标准的分析方法》测定。
1.5 数据处理
(1)挥发性风味化合物定量分析。样品顶空吸附前加入环己酮作为内标,利用峰面积比计算鱼肠中挥发性物质的相对含量,即:
(2)
式中:Cx表示待测挥发性风味化合物含量,μg/kg;C0表示内标化合物质量浓度,μg/μL;V0表示内标化合物体积,μL;mx为试样的质量,kg;S为未知风味化合物与内标化合物的峰面积比。
(2)气味活度值(OAV)。OAV为风味物质含量与该风味物质在水中的感觉阈值之比,用来衡量不同化合物对样品总体气味的贡献度,即:
(3)
式中:OAV为气味活度值;C为风味物质含量,μg/kg;T为该风味物质在水中的感觉阈值,μg/kg。
(3)相对气味活性值(ROAV)。ROAV是衡量挥发性组分对整体风味贡献值大小的参数,按下式计算:
(4)
式中:ROAVx为待测风味化合物相对气味活度值;OAVx为待测风味化合物气味活度值;OAVstan为样品中对总体风味贡献最大的风味化合物的气味活度值。
定义对样品总体风味贡献最大的组分为stan,则ROAVstan为100,显然,所有组分的ROAV取值在0~100区间内。一般认为ROAV≥1时,说明该物质对样品的整体风味具有重要贡献,可以当作样品中关键风味化合物;当0.1≤ROAV<1时,说明该物质对样品总体风味起到修饰作用;当ROAV<0.1时,说明该物质对样品总体风味影响不明显。
(4)电子鼻数据分析。利用IBM SPSS Statistics 23软件,对电子鼻传感器响应值原始数据进行主成分分析(PCA)。
(5)GC-MS数据分析。采用NIST 11检索,只有匹配度大于80的数据才予以采用,挥发性成分的定量采用内标法。
所有试验均重复3次,数据重复测定3次。试验数据采用Origin 8.5和Excel 2010进行处理,采用SPSS 22.0进行数据分析及Ducan’s检验(P<0.05)。
2 结果与分析
2.1 紫苏提取物中的酚类化合物
福林酚法测定紫苏提取物中的总酚含量为(32.49±1.18) mg/g,通过HPLC鉴定出4种酚类物质(图1-B),分别为咖啡酸(4.22±1.16) mg/g、阿魏酸(4.00±0.40) mg/g、迷迭香酸(9.00±2.57) mg/g、芹菜素(11.05±0.04) mg/g,合计(28.27±4.17) mg/g。说明紫苏提取物中含有较多的酚类物质,其中芹菜素和迷迭香酸含量显著高于其余酚类物质(P<0.05)。
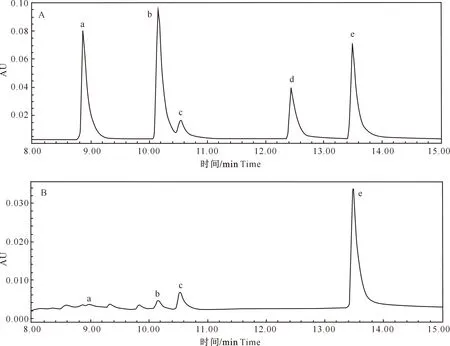
a.咖啡酸;b.阿魏酸;c.迷迭香酸;d.槲皮素;e.芹菜素
2.2 紫苏提取物对鱼糜凝胶气味特征的影响
2.2.1 主成分分析(PCA) 利用IBM SPSS Statistics 23软件对电子鼻响应值数据进行主成分分析(PCA),结果如图2所示。由图2可知,第一主成分(PC1)和第二主成分(PC2)的贡献率分别为86.173%和11.467%,累积贡献率远远大于80%,表明两个主成分能够反映原始数据的信息。
由图2还可知,不同处理组分布较为接近,主要沿着PC1轴横向分布,对照组与0.1%漂洗组之间相距较近且有交集,0.3%漂洗组距离对照组较远,说明紫苏提取物漂洗导致鱼糜制品整体风味在一定程度上发生了变化,这与紫苏提取物本身具有一定特殊风味有关。
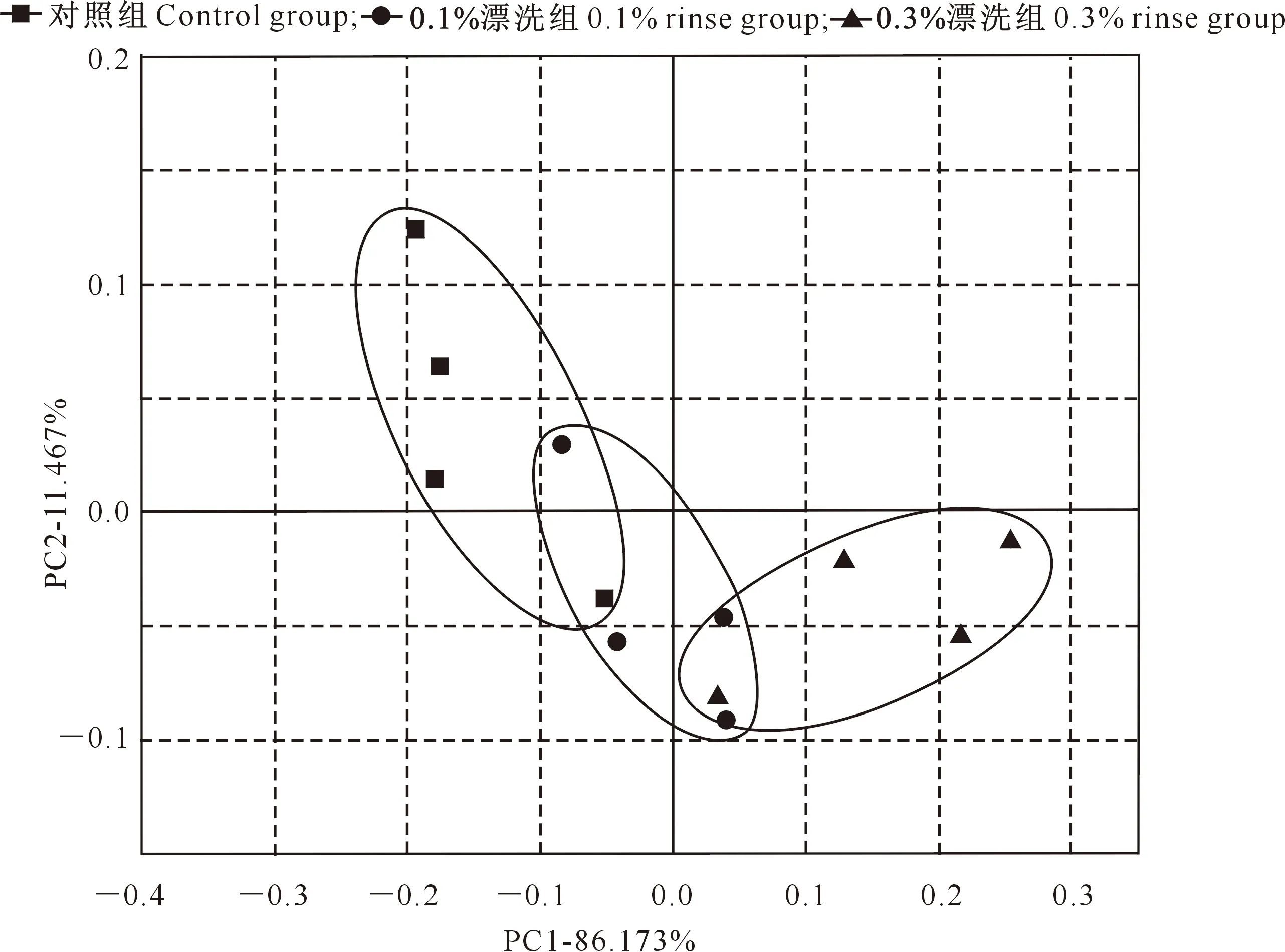
图2 紫苏提取物不同漂洗浓度样品中挥发性成分电子鼻响应值的PCA分析结果
2.2.2 电子鼻传感器的响应变化 为检测不同样品中复杂的挥发性成分,电子鼻检测应运而生,可集识别、分析、检测于一体,是新兴的电化学传感系统。电子鼻各传感器类型及检测范围如表1所示。

表1 电子鼻传感器的类型及检测范围
电子鼻各传感器对不同样品的响应值检测结果如图3所示。由图3可知,不同处理白鲢鱼糜凝胶制品的整体挥发性风味轮廓相似,说明样品的主体风味并未丢失;试验所使用的电子鼻传感器主要涉及TP型传感器(T30/1、P10/1、P10/2、P40/1、T70/2、PA/2、P30/1、P40/2、P30/2、T40/2、T40/1、TA/2共12个响应值)的变化。由图3还可知,与对照组相比,经0.1%紫苏提取物漂洗后样品除T70/2、PA/2、T40/2传感器外,其余TP型传感器响应值均有所增加;经0.3%紫苏提取物漂洗后样品在TP型传感器上响应值均有所增加,即样品整体挥发性化合物种类有所增加。以上结果表明,紫苏提取物漂洗质量浓度是鱼糜样品挥发性化合物发生变化的主要因素,由图3可知,紫苏漂洗后所引入的挥发性物质涉及到醛、酮、醇、烯烃类等物质。
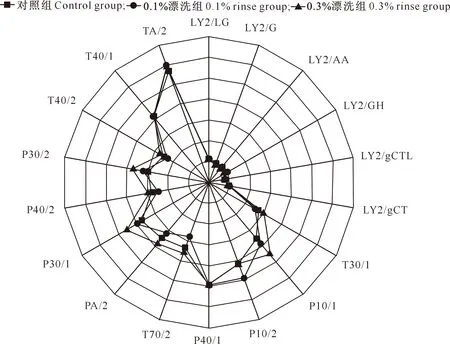
图3 电子鼻传感器对紫苏提取物不同漂洗浓度样品挥发性成分的响应值
2.3 紫苏提取物对鱼糜凝胶挥发性化合物的影响
不同浓度紫苏提取物漂洗样品中挥发性风味化合物及其ROAV详见表2。由表2可知,3组样品共检测到28种挥发性化合物,与对照组相比,紫苏提取物漂洗后样品中的挥发性成分种类有所增加,主要增加了醛类、酮类、烯烃类化合物,且对鱼腥味起主要贡献作用的物质有所减少,如己醛、庚醛、1-辛烯-3-醇等。
2.3.1 醛类化合物 醛类化合物由脂肪氧化产生,其阈值较低,对整体风味贡献较大[12]。经紫苏提取物漂洗后,白鲢鱼糜样品中增加了紫苏醛,且随着漂洗浓度的增加,样品中紫苏醛的含量显著提升(P<0.05)。紫苏醛是紫苏特有的重要活性成分之一,具有紫苏独特的青草辛香味,有一定的风味遮蔽作用。林梦南[13]从紫苏中检测到紫苏醛的相对含量达44.54%。
白鲢鱼糜凝胶中的特征风味化合物如己醛、壬醛、庚醛,其中己醛呈现鱼腥味、青草味,是鱼肉中产生高强度鱼腥味的主要物质;壬醛、庚醛等饱和直链醛也会产生一些辛辣的、令人不悦的刺激性气味。0.3%紫苏提取物漂洗后样品中的己醛、壬醛、庚醛含量分别减少了55.55%,19.11%,20.82%。已有研究表明,一些不饱和脂肪酸氧化后形成的过氧化物,裂解后会产生相对分子质量较低的醛类物质,阈值较低,对白鲢鱼糜样品的特征风味有贡献[14]。0.1%漂洗组中壬醛含量少许增加,因此,低浓度紫苏提取物漂洗可能对样品中的壬醛含量影响不大。
2.3.2 烃类化合物 烷烃类化合物可能是烷氧自由基脂质氧化降解产生的,大部分烷烃类化合物阈值较高,对白鲢鱼糜样品整体风味贡献不大,仅起修饰作用。由表2可知,相较于对照组,紫苏提取物漂洗后二十一烷含量显著增大(P<0.05);在所有处理组中二十一烷及十七烷的含量较高,这与江健等[15]的研究相符。
由表2还可知,经紫苏漂洗后样品中新增了许多烯烃类物质,大多是经紫苏提取物漂洗后引入到样品中的,但烯烃类化合物阈值较高,对样品整体风味影响不大。但也有研究认为,烃类化合物本身气味虽不易被察觉,但其作为重要的前体物质,在一定条件下可转化为醛类和酮类物质,对整体风味具有不可忽视的作用[16]。
2.3.3 醇类化合物 醇类化合物大多是由脂质氧化分解而来[17],由表2可知,经紫苏提取物漂洗后,白鲢鱼糜样品中醇类化合物的种类未发生变化。亚油酸氧化降解产生1-辛烯-3-醇,呈近似于蘑菇和鱼腥气味,在鱼类中广泛存在[18],其在3组样品中作为特征风味化合物(ROAV≥1),对鱼腥味的产生具有重要影响。与对照组相比,0.3%漂洗组中1-辛烯-3-醇含量显著减少25.30%(P<0.05),0.1%漂洗组减少了7.51%,表明紫苏提取物漂洗可以在一定程度上减少白鲢鱼糜凝胶的腥味。
1-庚醇是淡水鱼中主要的气味物质[19],由表2可知,1-庚醇对3组样品的整体风味影响较大(ROAV≥1),随着紫苏提取物漂洗浓度增大,白鲢鱼糜样品中的1-庚醛含量显著降低(P<0.05),这可能是因为紫苏多酚的漂洗减少了鱼肉中脂质的氧化,从而减少了样品中腥味物质的产生。
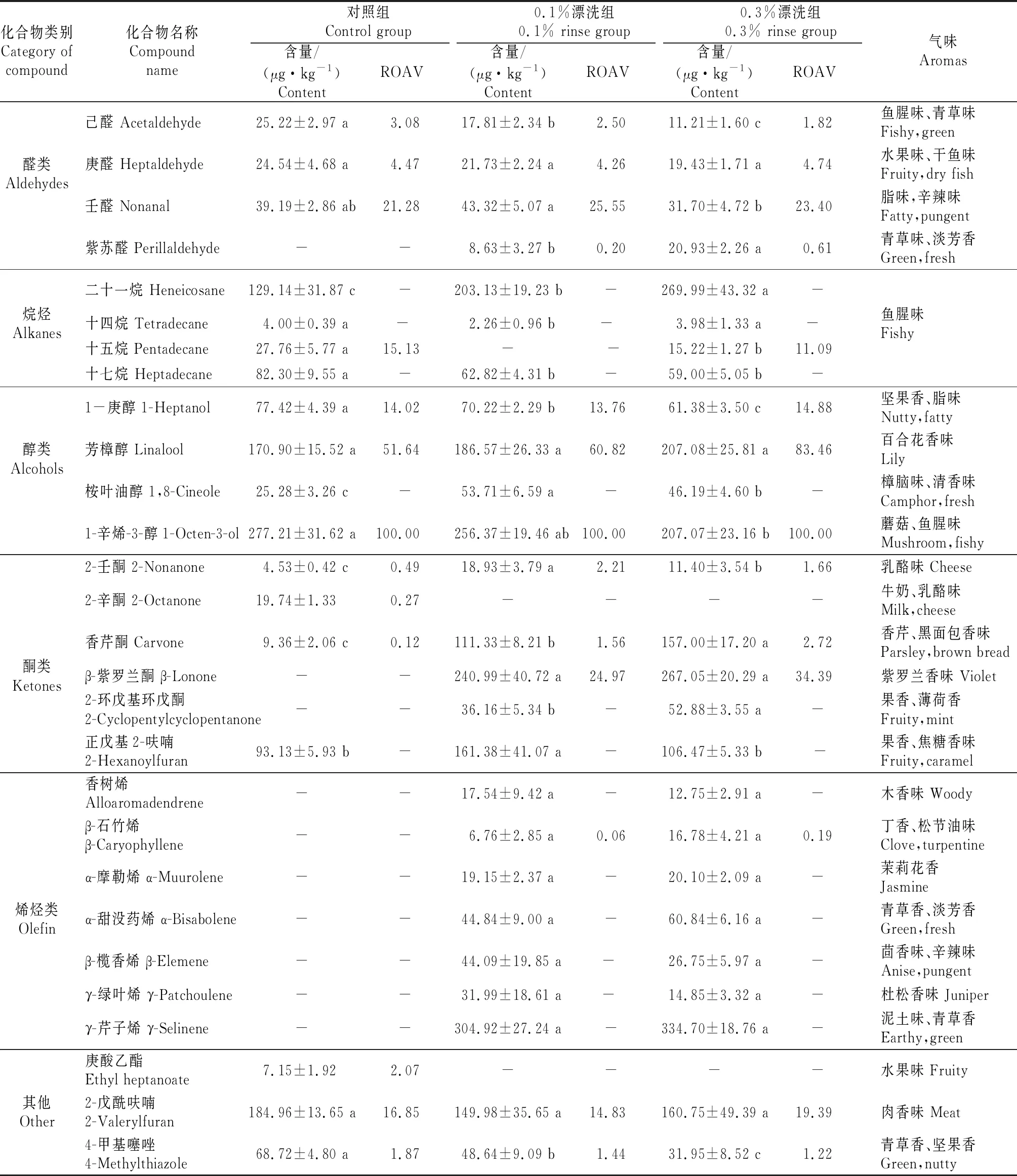
表2 不同浓度紫苏提取物漂洗样品中挥发性成分含量及其相对气味活性值(ROAV)
2.3.4 酮类化合物 酮类化合物的主要分子合成途径之一就是不饱和脂肪酸的氧化和降解;与醛、醇类化合物相比,酮类化合物的阈值更高,对样品总体风味的影响更小[20]。部分酮类化合物具有特殊风味,如2-庚酮具有果香味,正戊基2-呋喃酮具有焦糖香味。同时酮类也能够和其他腥味性物质一起发挥作用,增强腥味[21]。由表2可知,在对照组中2-壬酮、香芹酮对样品整体气味起修饰作用(0.1≤ROAV<1),紫苏提取物漂洗后,样品中二者的含量显著提升(P<0.05),并成为样品的特征风味化合物(ROAV≥1)。同时紫苏提取物漂洗后新检测到了β-紫罗兰酮和2-环戊基环戊酮,其中β-紫罗兰酮是紫苏特有的物质,经紫苏提取物漂洗处理后带入样品。说明紫苏提取物漂洗会增加样品中酮类化合物的种类和含量。
2.3.5 其他化合物 由表2可知,在对照组样品中检测到庚酸乙酯,酯类化合物主要赋予食品特殊的水果香味,对样品总体风味贡献度较大(ROAV≥1);3组样品中均检测到2-戊酰呋喃,这可能是白鲢鱼糜中的氨基酸与还原糖发生美拉德反应生成的反应产物,可以与其他挥发性风味物质协同增加样品风味[22],且对样品整体风味贡献度较大(ROAV≥1)。
2.4 紫苏提取物漂洗对鱼糜凝胶贮藏品质的影响
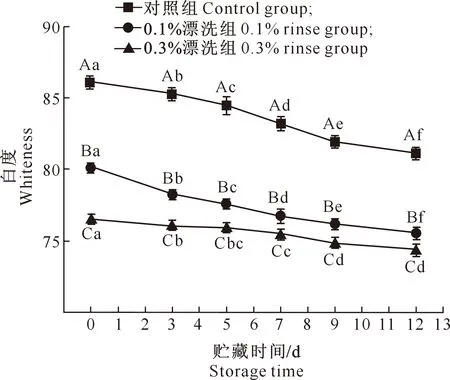
2.4.1 色 度 紫苏提取物不同浓度漂洗后鱼糜凝胶白度的变化如图4所示。
不同大写字母表示同一贮藏时间不同处理差异显著(P<0.05),不同小写字母表示同一处理不同贮藏时间差异显著(P<0.05)。下图同
由图4可知,相较于对照组,0.1%紫苏提取物漂洗时,其中所含色素会使鱼糜凝胶的白度值显著降低,亮度减小,整体呈黄绿色,且随着紫苏提取物漂洗浓度的增加,鱼糜凝胶白度进一步降低(P<0.05)。随着贮藏时间的延长,各处理组整体白度逐渐下降,水分开始流失,蛋白质和脂肪开始氧化。紫苏提取物中的酚类及紫苏醛等物质具有抑菌抗氧化性,可以延缓样品中脂质、蛋白质的氧化降解。在整个贮藏期间,0.3%漂洗组白度的变化幅度最小,说明一定浓度的紫苏提取物漂洗可以保持鱼糜凝胶的色泽,稳定整体的感官品质。
2.4.2 菌落总数 由图5可知,所有处理组中菌落总数均随着贮藏时间的延长而增加,相较于对照组,紫苏提取物漂洗后,样品中的菌落总数显著降低(P<0.05)。在贮藏12 d后,0.1%,0.3%漂洗组的菌落总数均显著低于对照组(P<0.05),与贮藏初期相比,对照组的菌落总数大约增加了36.55%,0.1%漂洗组中大约增加了27.43%,而0.3%漂洗组中的菌落总数增加了不到18.34%;说明紫苏提取物漂洗具有很好的抑菌性,随着漂洗浓度增大,抑菌效果更加明显。
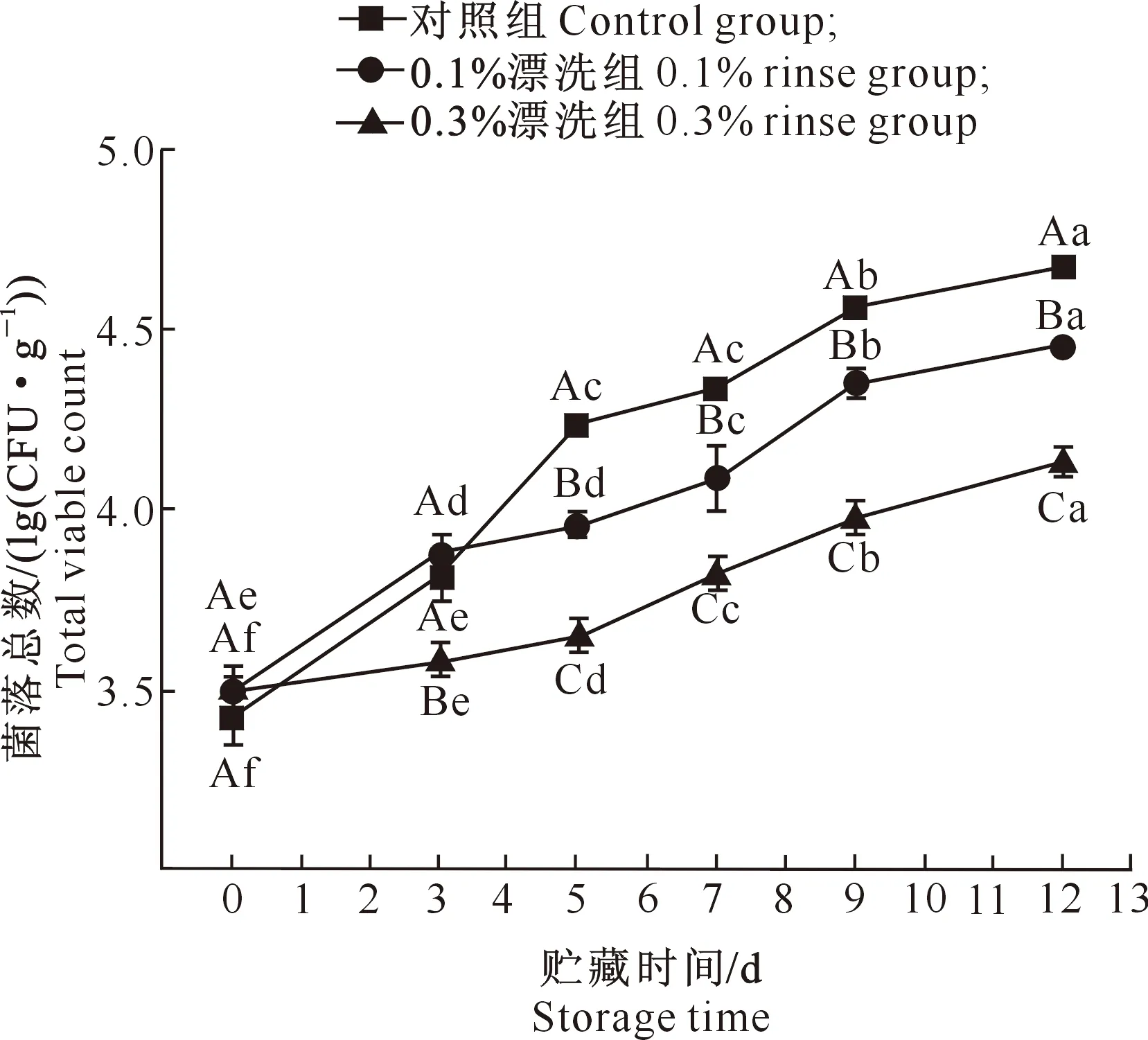
图5 紫苏提取物漂洗对白鲢鱼糜贮藏期间菌落总数的影响
2.4.3 TVB-N值 TVB-N值的增加可能是由于贮藏过程中微生物和内源酶分解蛋白质的结果,TVB-N值越高则腐败越严重[23]。由图6可知,各处理组在贮藏期间TVB-N值均呈上升趋势。与对照组相比,紫苏提取物漂洗可以显著降低样品TVB-N值的增长速率(P<0.05),在贮藏12 d时,紫苏提取物漂洗处理样品的TVB-N值显著低于对照组。说明紫苏提取物漂洗可以起到减少蛋白质分解的作用,抑制蛋白质氧化。与贮藏初期相比,贮藏12 d时3组样品的TVB-N值分别增加了101.6 mg/kg(对照组)、43.9 mg/kg(0.1%漂洗组)、38.2 mg/kg(0.3%漂洗组)。由此可知,TVB-N值随着紫苏提取物漂洗浓度的增加而逐渐减缓,反过来证明了紫苏提取物的抑菌作用。
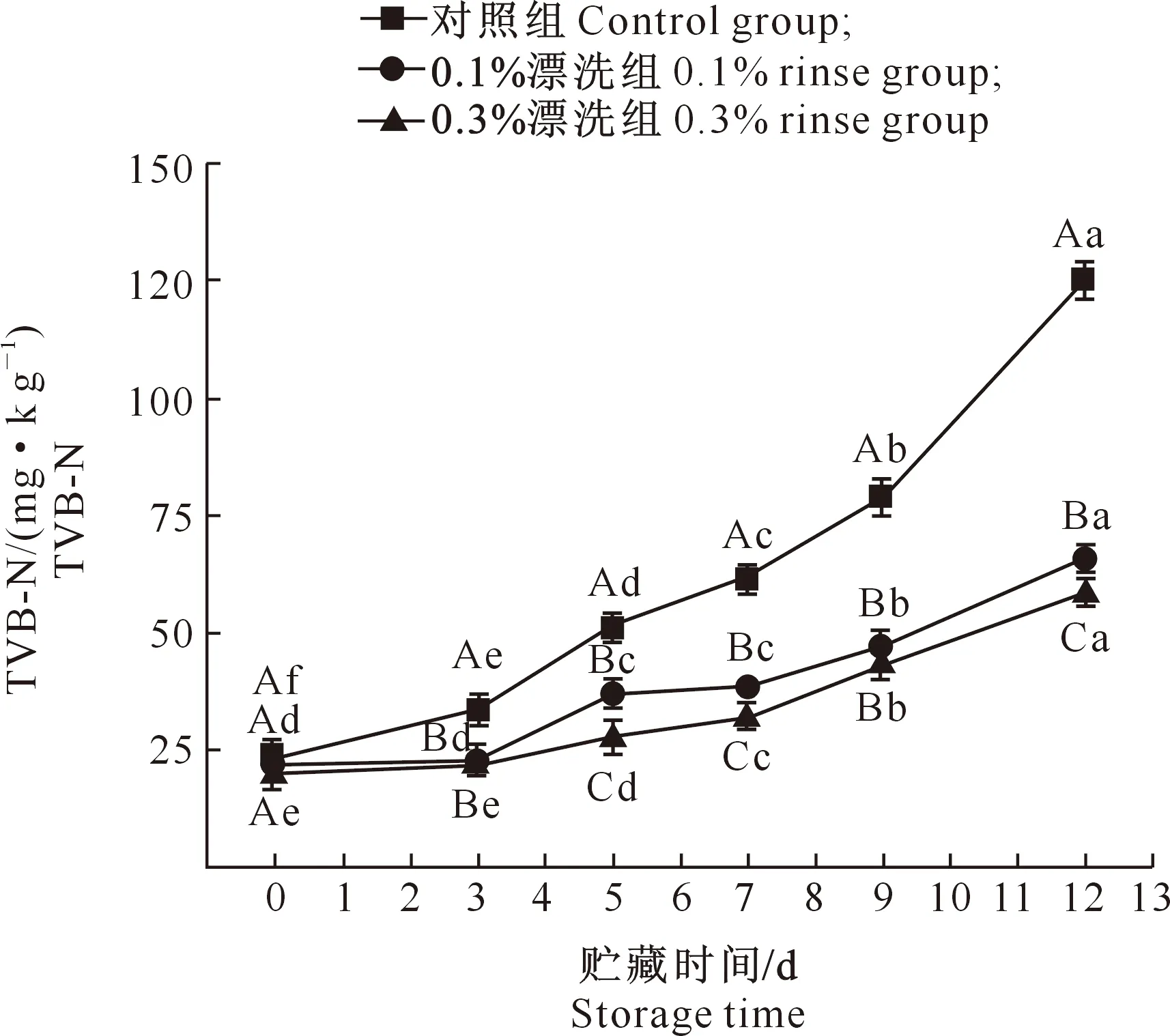
图6 紫苏提取物漂洗对白鲢鱼糜贮藏期间TVB-N值的影响
2.4.4 TBARS值 由图7-A可知,所有处理组的TBARS值均随着贮藏时间的延长而上升,与对照组相比,紫苏提取物漂洗组样品中的TBARS值均显著降低(P<0.05)。贮藏12 d后,对照组和质量分数0.1%、0.3%漂洗组样品的TBARS值分别达0.51,0.41,0.29 mg/kg。表明紫苏提取物漂洗能够延缓样品贮藏期间品质的劣化。推测认为,紫苏提取物所含的酚类物质可能会延缓鱼糜制品中的脂质氧化。林硕等[24]研究发现,酚酸、黄酮等化学成分在紫苏叶中广泛存在,这些活性成分可以很好地清除自由基,起到抗氧化效果,同时也具有抑制脂质过氧化的作用。本研究中,样品中对腥味起贡献的醛类化合物含量的减少与紫苏提取物漂洗后样品TBARS值的减少相符。由此可见,紫苏提取物漂洗处理可以有效减少白鲢鱼糜制品的不良风味,其机理可能通过延缓脂质氧化来实现。
2.4.5 pH值 pH对鱼肉的新鲜度和品质有一定的影响。由图7-B可知,所有样品在整个贮藏期间均处于弱酸性状态,表现比较稳定;在贮藏前9 d,同一贮藏时间紫苏提取物漂洗可显著降低样品的pH(P<0.05),但不同样品之间的变化趋势基本一致,说明紫苏提取物漂洗浓度的变化对样品在贮藏期间pH的变化趋势影响不大。在贮藏前5 d,所有样品pH均呈上升趋势,可能是由于微生物大量繁殖,蛋白质分解生成碱性含氮化合物如三甲胺等[25],导致pH值升高;之后则开始下降,可能是因为微生物生长代谢生成CO2等,凝胶质地变差,CO2和有机小分子发酵产生酸性物质,导致pH降低。
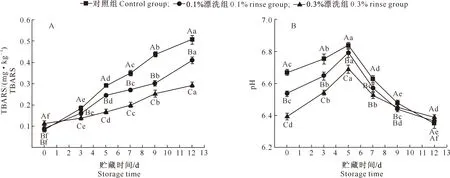
图7 紫苏提取物漂洗对白鲢鱼糜贮藏期间TBARS值和pH值的影响
3 讨 论
紫苏含有的活性成分具有广泛的抑菌、抑酶、抗氧化等特点,紫苏本身也具有特殊的挥发性气味成分,可以起到去腥的作用[26]。紫苏提取物漂洗鱼糜可以在去除鱼糜凝胶不良气味的同时,延缓其中蛋白质、脂质的氧化变质,改善鱼糜凝胶的贮藏品质。
对照组白鲢鱼糜凝胶制品共检测出18种挥发性成分,其中特征风味化合物有10种,分别为己醛、庚醛、壬醛、十五烷、1-庚醇、芳樟醇、1-辛烯-3-醇、庚酸乙酯、2-戊酰呋喃、4-甲基噻唑,其中己醛、庚醛、壬醛、1-辛烯-3-醇是白鲢鱼糜中的特征腥味物质。曾文浩等[27]研究表明,己醛、辛醛、壬醛等在新鲜白鲢鱼肉中呈现鱼腥味和青草味,形成白鲢鱼特有的风味。另有研究表明,新鲜白鲢鱼糜中主要风味物质是己醛和1-辛烯-3-醇,主要呈现土腥味[28]。随着加热熟化,鱼糜制品伴随着美拉德反应生成了2-戊酰呋喃,增添了肉香。
在经紫苏提取物漂洗处理后的鱼糜制品中,共检测出26种挥发性物质,与对照组相比,其中特征风味化合物新增了2-壬酮、香芹酮和β-紫罗兰酮。紫苏中的酚类物质具有良好的抗氧化性,可有效抑制鱼糜凝胶中脂肪的氧化分解,从而减少对鱼糜制品不良风味起主要贡献作用的化合物的含量,如己醛、庚醛、十五烷、庚醇、1-辛烯-3-醇,且随着漂洗浓度增大,含量进一步减少。同时通过电子鼻分析可知,紫苏提取物漂洗后白鲢鱼糜制品的气味发生了较大变化,紫苏特有的一些烯烃类物质被引入样品中,香芹酮和β-紫罗兰酮在样品中呈现香芹和紫罗兰香,2-壬酮呈现乳酪味,在去腥的同时还可以在一定程度上丰富样品的风味,给鱼糜制品的开发和加工提供了新的思路。
紫苏提取物中含有较多的色素,漂洗鱼糜后会使鱼糜凝胶白度降低,整体呈现黄绿色,在白鲢鱼糜制品的贮藏过程中,各处理组白度值均有不同程度下降,而0.3%漂洗组的白度变化较小,说明高浓度紫苏提取物漂洗可维持鱼糜凝胶的感官品质,稳定色泽。有研究表明,紫苏水提物对金黄色葡萄球菌和变形链球菌有明显的抑菌作用,可有效抑制厌氧菌、好氧菌、乳酸菌、嗜冷菌、酵母以及霉菌的生长[29-30]。紫苏提取物中的酚类物质可以抑制微生物增长和脂质氧化,降低菌落总数的增长速率,延缓微生物及内源酶分解蛋白质,减少氨类物质生成,从而延缓白鲢鱼糜制品贮藏过程中的挥发性盐基氮(TVB-N)值的增加。同时抑制引发氧化反应的脂肪游离基,减少硫代巴比妥酸(TBARS)值的增长;降低样品品质劣化速率,稳定pH值,在贮藏期间能较好保持白鲢鱼糜制品的凝胶品质。
综上所述,紫苏作为药食两用植物,除了去腥、杀菌、提鲜等外,在鱼糜制品的贮藏方面也可以发挥积极作用,具有广阔的应用前景。

