菌根对盐胁迫下胡杨幼苗生长和叶绿素荧光特性的影响
再努尔·吐尔逊,高文礼,陈晓楠,伊力努尔·艾力,马晓东
(新疆师范大学 生命科学学院 新疆特殊环境物种保护与调控生物学实验室/干旱区植物逆境生物学重点实验室,新疆 乌鲁木齐 830054)
塔里木河下游干旱少雨,蒸发强烈,土壤含盐量较高,且在河水漫溢的影响下盐分空间分布复杂,植物生长受盐旱胁迫严重[1]。过多的盐分常常导致荒漠河岸林植物的正常生长受限,地表植被群落出现退化,严重地区甚至还会有大面积植物死亡[2]。杨柳科(Salicaceae)杨属(Populus)胡杨(Populuseuphratica),具有较强的抗逆能力,能在极端干旱、盐化严重等较恶劣的环境下生存,对防治沙漠化和绿洲生态安全保护具有重要作用[3],是塔里木河下游荒漠河岸林的建群种[4]。塔里木河下游的胡杨对整个荒漠河岸林群落的稳定和维系起到关键作用,然而由于盐胁迫不利于胡杨幼苗生长,导致胡杨实生苗更新困难,种群存在较大的退化风险。因此,研究盐胁迫下胡杨幼苗的生长特性及抗逆能力具有重要意义。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能与94%的维管植物形成菌根,菌根通过菌丝网络帮助植物获取土壤中的营养和水分,增加植物对周围土壤的利用范围,替代了植物吸收根的部分功能[5]。研究表明,AMF在根系中的定殖受到土壤水分、盐分、碳、氮和有机质等土壤特性的强烈影响[6-8]。在塔里木河下游,胡杨既是荒漠河岸林建群种,又是关键的菌根植物。研究表明,胡杨根际土壤中的AMF孢子种类以摩西球囊霉(Glomusmosseae)占优势,AMF在胡杨根际的侵染率最高可达81%、侵染强度达45%以上,但土壤中胡杨根际的AMF多样性较低,可能是恶劣的荒漠环境降低了AMF的多样性和接种潜力[9]。AMF也被看作是不同生态系统中植物耐盐性的生物改良剂[10],在抗盐胁迫中可改变宿主植物的组织结构、提高渗透调节能力、改善氧化损伤和维持正常的光合过程,体现了AMF在植物抗盐胁迫中的重要作用[11]。叶绿素荧光参数是研究光合作用机理的天然探针[12],它可指示植物在不同条件下耐受环境胁迫的能力和光合机构受损害的程度[13],还能够探测光合机构捕获光能和传递电子的关键信息,且对环境变化特别敏感,因此可以用来监测物种对生物和非生物胁迫的抗性[14-16]。目前,有关AMF是否能通过增强胡杨幼苗的耐盐性来促进幼苗生长,进而使之快速渡过脆弱期尚不清楚,因此本研究探讨了盐胁迫下AMF对胡杨实生幼苗生长及叶绿素荧光参数的影响,以期为促进塔里木河下游胡杨繁殖更新提供依据。
1 材料与方法
1.1 材料及处理
选取株型基本一致的1年生胡杨实生幼苗为试验材料(胡杨更新过程中实生幼苗阶段是关键),栽培至直径30 cm、高30 cm 的圆形花盆中,每盆定苗1株。供试砂土取自塔里木河下游河道两侧,田间最大持水量为22%,平均全盐含量1.8 g/kg,pH 8.4。砂土过孔径0.2 cm 筛去除杂质后清洗,并在110 ℃、0.14 Mpa 下连续湿热灭菌1 h备用。供试菌种为质量比1∶1的幼套球囊霉(Glomusetunicatum)和摩西球囊霉(Funneliformismosseae)的混合菌种,来源于新疆农业科学院微生物研究所,菌剂孢子密度为25 mL-1。花盆放置于玻璃温室接受自然光照,待培养40 d后,对幼苗进行盐胁迫处理。
塔里木河下游土壤中含盐量一般为0.2 g/kg,因此本试验设0.2 g/kg(CK)、3 g/kg(S1)、6 g/kg(S2)和12 g/kg(S3) 4个NaCl水平,每个NaCl水平下又设置接种AMF和不接种AMF(对照)处理,共计8个处理,每个处理3株幼苗(3个重复),随机排列。土壤含水量为田间最大持水量的80%,土壤盐分采用便携式电导率仪(DDSJ-308F)测定。为避免盐激,采用少量多次的浇灌方式来控制,每天1次,连续添加7 d,直至达到预定的NaCl水平。随后对胡杨幼苗盐胁迫处理90 d,期间为防止盐分流失,每个花盆下面放一个托盘,把花盆里渗出来的水再倒回去。处理90 d后,从胡杨的根、茎和叶中取样,样品在105 ℃烘箱中杀青30 min,然后置于80 ℃烘箱中干燥至质量恒定。
1.2 测定指标与方法
1.2.1 根系AMF侵染率和依存度 幼苗收获后,对其根样进行染色处理(台盼蓝染色法)[17],用于镜检。选取直径2 mm左右的细根剪成1 cm长度制成封片于显微镜下观测,检测幼苗根系内菌根侵染状况和菌根共生结构,采用网格交叉法统计形成菌根的根段数,计算根系的AMF侵染率[18]。菌根依存度按同一盐胁迫处理下的接种植株干质量和不接种植株干质量来计算,具体计算公式如下:
菌根侵染率=侵染根段数/全部根段数×100%;
菌根依存度=(接种植株干质量-
不接种植株干质量)/接种植株干质量×100%。
1.2.2 幼苗生长指标 试验开始前分别测量各处理幼苗的株高和基径,盐胁迫处理90 d后测量各处理幼苗的株高、基径及地上和地下生物量(烘干称质量法)。挖掘过程中,采用过筛法将植株根系全部取出,并对不同处理植株根系进行分级,其中粗根直径≥2 mm,细根直径为≥0.5 mm~<2 mm。用根系扫描仪(Epson V 700)将不同处理的植物根系扫描成电子图像后,应用WinRHZIO软件对植株根系形态的总根长、细根长和根表面积进行分析,每个处理重复测定6次,其他相关指标按以下公式计算:
株高相对增长率=(植物最终高度-植物最初高度)/植物最初高度×100%;
基径相对增长率=(植物最终基径-植物最初基径)/植物最初基径×100%;
根冠比=地下部分生物量/地上部分生物量。
1.2.3 叶绿素含量和荧光参数 盐胁迫90 d后,使用叶绿素仪测定各处理幼苗叶片的叶绿素含量,每个处理重复测定6次。同时在阳光充足的天气下,选择幼苗从上向下数第4和第5片充分生长的叶片,采用 Junior-Pam 便携式调制叶绿素荧光仪于09:00-18:00,每隔3 h测定光适应下最大荧光Fm′;并于当日22:30测量暗适应的初始荧光F0、光下基础荧光F和最大荧光Fm;同时计算可变荧光Fv、非光化学过程处于最优态时的荧光产量F0′、PSⅡ潜在光化学效率Fv/F0、最大光化学效率Fv/Fm、非光化学淬灭系数NPQ和光化学淬灭系数qP等[19],计算公式如下:
Fv=Fm-F0;F0′=1/(1/F0-1/Fm+1/Fm′);Fv/F0=(Fm-F0)/F0;Fv/Fm=(Fm-F0)/Fm;NPQ=(Fm-Fm′)/Fm′;qP=(Fm′-F)/(Fm′-F0′)。
1.3 数据统计分析
采用Microsoft Excel绘图,采用SPSS 19.0统计软件计算各指标平均值和标准误,并对数据进行多因素方差分析和LSD多重比较分析,差异显著性水平为P<0.05。
2 结果与分析
2.1 盐胁迫对胡杨幼苗菌根侵染的影响
由表1可知,随着盐胁迫程度的增加,胡杨幼苗菌根侵染率呈现逐渐降低的变化趋势,且各处理间差异显著(P<0.05);与对照(CK)相比,S1、S2和S3处理胡杨幼苗菌根侵染率分别降低了9.3%,15.6%和43.7%,这说明盐胁迫抑制了胡杨菌根的形成。
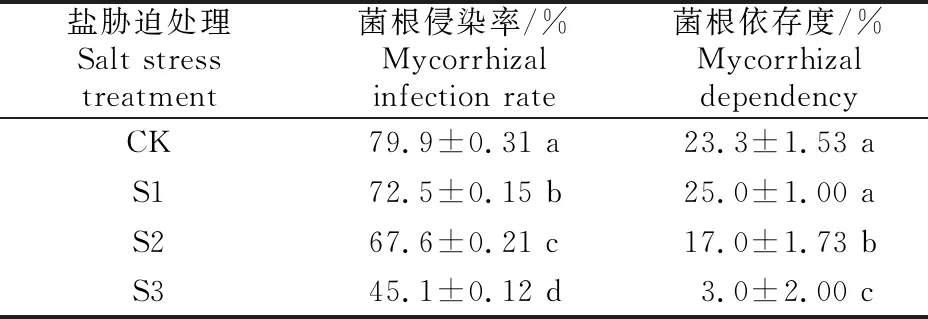
表1 盐胁迫对胡杨幼苗菌根侵染率和菌根依存度的影响
菌根依存度反映了AMF与植物生物量增加之间的关系,表1显示,随着盐胁迫程度的增强,菌根依存度呈现先增加后减小的趋势,S2和S3盐胁迫处理下菌根依存度较CK分别降低了27%和87%,达显著水平(P<0.05),说明盐胁迫达到一定程度会抑制菌根对胡杨幼苗干物质积累的作用。
2.2 AMF对盐胁迫下胡杨幼苗地上部分生长的影响
由图1可见,随着盐胁迫程度的增强,接种AMF和不接种AMF的胡杨幼苗株高相对增长率和基径相对增长率均呈现逐渐下降的趋势;无论是否接种AMF,盐胁迫下各组胡杨幼苗的株高相对增长率均显著低于CK,而基径相对增长率仅接种AMF的S2和S3处理与其CK差异显著(P<0.05)。另外,在相同盐胁迫水平下,株高和基径相对增长率在接种AMF与不接种AMF组之间无显著差异,但总体上接种组的指标值略高于不接种组,说明接种AMF有利于胡杨幼苗的生长。

AMF+和AMF-分别表示接种AMF和不接种AMF;图柱上标不同小写字母表示处理间差异达显著水平(P<0.05)。图2同
2.3 AMF对盐胁迫下胡杨幼苗根系生长和总生物量的影响
由表2可知,随着盐胁迫的加重,接种和不接种AMF处理胡杨幼苗的总根长、细根长和根表面积均逐渐降低。接种与不接种AMF比较,胡杨幼苗总根长和细根长仅在2个CK组之间差异显著(P<0.05),而在不同盐胁迫处理组间差异均不显著。根表面积仅在2个S1处理间差异显著(P<0.05),而其他盐胁迫水平和CK处理间差异均不显著。由此可知,盐胁迫下胡杨幼苗的总根长、细根长和根表面积均降低,但接种AMF可在一定程度上促进植株根系的生长。
由表2还可知,无论是否接种AMF,胡杨幼苗的总生物量均随着盐胁迫的加剧而降低,各盐胁迫组幼苗的总生物量均较其CK显著下降,其中S3处理下不接种AMF幼苗的总生物量比CK降低了90%,接种AMF组幼苗的总生物量比CK降低了72.4%。根冠比在S1、S2和S3处理下接种AMF组比不接种组分别增加了20.9%,38.4%和27.8%,并在S2处理下接种与不接种AMF组之间差异显著(P<0.05)。由此可见,盐胁迫下接种AMF可不同程度提高幼苗的总生物量,同时促进生物量的合理分配。

表2 AMF对盐胁迫下胡杨幼苗根系生长和总生物量的影响
2.4 AMF对盐胁迫下胡杨幼苗叶片叶绿素荧光参数和叶绿素含量的影响
由表3可知,盐胁迫下胡杨幼苗的F0值在各处理之间无显著差异,但接种AMF后F0值均大于对应的不接种AMF处理。随着盐胁迫水平的升高,接种AMF和不接种AMF胡杨幼苗叶片Fv/Fm、Fv/F0均具有先下降后增加的趋势;在S2和S3处理下,接种AMF组胡杨幼苗叶片的Fv/Fm、Fv/F0、qP显著高于不接种AMF组(P<0.05),其中Fv/Fm较不接种AMF组增加14.3%和4.8%,Fv/F0增加50.1%和40.7%,qP增加41.2%和43.5%。在接种AMF和不接种AMF的情况下,NPQ均随盐胁迫加重呈先增加后下降的变化趋势。综上可知,接种AMF能有效缓解盐胁迫对胡杨幼苗叶片光合能力的损伤。

表3 AMF对盐胁迫下胡杨幼苗叶片叶绿素荧光参数的影响
AMF对盐胁迫下胡杨幼苗叶片叶绿素含量的影响如图2所示。由图2可知,在S1、S2和S3处理下,不接种AMF组胡杨幼苗叶片的叶绿素含量较CK处理分别减少9.9%,5.1%和10%,而接种AMF组则较CK分别增加 0.1%,11.3%和22.5%。在S1处理下,接种AMF与不接种AMF组胡杨幼苗叶片的叶绿素含量无显著差异,但在S2和S3处理下,接种AMF组胡杨幼苗叶片的叶绿素含量分别较不接种AMF组高4.8%和17.9%,且在S3处理下二者差异显著(P<0.05)。这表明盐胁迫达到一定程度后,接种AMF能增加胡杨幼苗叶片的叶绿素含量。

图2 AMF对盐胁迫下胡杨幼苗叶片叶绿素含量的影响
3 讨 论
本研究发现,盐胁迫对菌根形成产生了抑制作用。从菌根依存度来看,低盐胁迫下(S1),AMF的依存度显著高于中(S2)、高(S3)盐胁迫,并高于对照(CK),这说明低盐胁迫不但没有抑制反而促进了菌根依存度。韩冰等[20]研究显示,低盐胁迫下黄瓜植株接菌处理的菌根依存度高于正常接菌处理,这与本试验结果一致。塔里木河下游胡杨幼苗在河水漫溢下有一段时期处于低盐环境,如果此时AMF能迅速侵染,将对幼苗生长十分有利。
盐胁迫使植物生长受阻,严重情况下甚至导致死亡,接种AMF则有助于提高植物的耐盐能力[21]。本研究中,盐胁迫处理下,不接种AMF组胡杨幼苗的株高相对增长率、基径相对增长率、总生物量、总根长、细根长和根表面积均较对照显著降低,而接种AMF后上述指标均有所提升,这与张欣磊等[22]对盐胁迫处理下白芨(Bletillastriata)的研究结果一致。盐胁迫下接种AMF对地下根系生长具有促进作用,这有助于提高胡杨幼苗对土壤水分和养分的获取能力,从而进一步增强其抗盐旱胁迫能力,以适应塔里木河下游极端干旱和高盐的不良环境。
叶绿素荧光能反映植物光能吸收、激发能传递、光化学反应、电子传递等几乎所有光合作用过程的变化,其参数可表征植物对外部生物和非生物胁迫的抗性,以及植物对不同生境的适应能力[23]。研究表明,Fv/Fm是衡量光抑制程度的重要指标,可用于指示PSII初级光能的转换效率[24],如果Fv/Fm大大降低,则表明植物受到光抑制,反应中心受到不可逆的损伤或可逆的失活[25]。在本研究中,盐胁迫导致Fv/Fm、Fv/F0和qP下降,但接种AMF使中盐胁迫(S2)和高盐胁迫(S3)下胡杨幼苗的上述指标较不接种AMF组的显著提高。由此可知,盐胁迫越严重,接种AMF对胡杨幼苗叶片叶绿素荧光参数的影响越明显。在S2和S3处理下,接种AMF组胡杨幼苗的叶绿素荧光指标均高于不接种AMF组,说明接种AMF对于提高盐胁迫下胡杨幼苗的光合能力及保护光合机构具有一定的作用。同时,植物叶片的叶绿素含量容易受到盐胁迫的影响,而AMF则可以提高植物的光合效率和叶绿素含量[26]。在本研究中,盐胁迫导致不接种AMF组胡杨幼苗的叶绿素含量较对照减少,但在S2和S3处理下,接种AMF后胡杨幼苗叶片的叶绿素含量均高于不接种AMF组,这与高崇[27]对杜梨(PyrusbetulifoliaBunge)、杨海霞等[28]对白三叶(TrifoliumrepensL.)、王栋等[29]对紫花苜蓿(MedicagosativaL.)的研究结论一致,这说明盐胁迫下AMF对植物幼苗叶绿素含量的提高有促进作用。塔里木河下游高盐土壤环境对植物光合物质的积累十分不利,而接种AMF能有效保障胡杨幼苗正常的光合作用过程,提高其耐盐性,从而促进幼苗快速生长,帮助其及早度过生长脆弱期。
4 结 论
1)胡杨幼苗的菌根侵染率与生长基质中的盐含量密切相关,随着盐含量的增加,胡杨幼苗根系菌根侵染率显著下降。此外,盐胁迫会抑制菌根对胡杨幼苗干物质积累的作用。
2)在相同盐胁迫程度下,与未接种AMF相比,接种AMF组胡杨幼苗的总生物量、株高相对增长率、基径相对增长率、总根长和细根长总体上变化不显著;但低盐胁迫(3 g/kg NaCl)处理下胡杨幼苗的根表面积、中盐胁迫(6 g/kg NaCl)处理下胡杨幼苗的根冠比均为接种AMF组显著高于不接种AMF组,表明盐胁迫下AMF对胡杨幼苗生长起到保护作用。
3)中盐胁迫(6 g/kg NaCl)和高盐胁迫(12 g/kg NaCl)处理下,接种AMF使胡杨幼苗的叶绿素荧光参数(Fv/Fm、Fv/F0、qP)值显著高于不接种AMF的幼苗,且高盐胁迫(12 g/kg NaCl)处理下接种AMF可显著(P<0.05)增加胡杨幼苗叶片的叶绿素含量,说明接种AMF能减轻盐胁迫对胡杨幼苗光系统的损伤。

