红光熊蜂GS、Akt2基因克隆与低温胁迫表达
王丹丹,王 星,周翘楚
(辽东学院 农学院,辽宁 丹东 118000)
红光熊蜂(BombusignitesSmith)是一类重要的传粉昆虫,具嚼吸式口器,吻喙长,接触植物柱头频率高,除大颚可用作咀嚼或塑蜡外,中舌、小颚外叶和下唇须合并构成复杂的食物管吸食花蜜。红光熊蜂为典型的全变态社会性昆虫,具狭温性[1-2],生活温度10~30 ℃,最适温度25 ℃。低温胁迫会影响其发育历期,以及羽化后成蜂的死亡率、行为、外部形态和理化特性等,如翅脉发育、神经突触数量等,主要表现在糖、脂类、氨基酸、嘌呤和硫胺素等代谢通路上相关基因的富集化差异表达[3]。
糖原合成酶(glycogen synthase,GS)为胰岛素作用的关键酶,也为糖原生物合成过程中的限速酶,磷酸化GS失活,糖原被分解;去磷酸化GS被激活,糖原合成[4]。Akt由Akt1、Akt2和Akt3共3个亚型组成,序列同源率达85%,3个亚型生理功能各不相同,亦有重叠。其中Akt1缺失可导致胎盘营养缺失、生长发育延迟或体质量下降;Akt2位于胰岛素效应组织中,参与葡萄糖稳态调节,Akt2缺失可导致胰岛素分泌或血糖异常;Akt3缺失可诱发大脑萎缩。Akt约有100 余种底物,参与机体多种信号通路,如通过调控FoxO亚家族蛋白或CREB等转录因子[5],调控新陈代谢与生长发育相关基因的表达;通过抑制Bcl-2家族的Bax、Bad等成员达到抑制细胞凋亡的目的[6];通过调控Mtor参与蛋白质合成、抗细胞调亡与保护神经细胞的功能[7];亦可通过磷酸化糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK3β),调控糖代谢、细胞生长、增殖以及细胞调亡等过程[8]。活化的Akt2通过磷酸化多种酶及转录因子来调节细胞的功能,如Akt磷酸化GSK3β而抑制其活性,促进葡萄糖代谢、调节细胞周期;如GSK-3β为Akt2的底物,调控细胞的凋亡过程,即胰岛素激活Akt2磷酸化GSK3β,使GSK3β失活,GS去磷酸化而被激活,糖原合成,反之糖原合成被抑制[9]。当红光熊蜂机体葡萄糖含量升高,胰岛素通过激活PI3K/Akt通路刺激组织摄取葡萄糖,抑制GSK3β激酶活性,使GS去磷酸化,合成糖原,降低血糖含量,维持个体稳态[10]。
温度在动物生存、繁殖、行为等方面具有深远的影响,目前为止,尚无研究从分子水平探讨红光熊蜂适应低温胁迫的防御机制。为了深入研究低温胁迫对红光熊蜂相关糖代谢基因的差异表达趋势,本研究采用RT-PCR与RACE技术克隆红光熊蜂GS和Akt2基因全长cDNA,采用实时荧光定量PCR(qRT-PCR)分析不同温度和不同时间低温胁迫下,GS和Akt2基因的动态表达规律,旨在探究红光熊蜂在低温环境下的防御机制,糖代谢通路特点及高糖状态的形成机制,为培育抗寒红光熊蜂奠定基础。
1 材料与方法
1.1 试验材料
选取繁育旺盛、18日龄健康无病的红光熊蜂(BombusignitesSmith)工蜂200只放入无光照、温度25 ℃,相对湿度(relative humidity,RH)55%的恒温恒湿箱(型号:HPX-160BS-Ⅱ)中培育5 d。将培养后的红光熊蜂工蜂二等分,一部分分别置于RH 55%,温度25,18,15,10,8,和5 ℃的低温环境中培养2 d后取材,另一部分在RH 55%,8 ℃低温下胁迫4,8,12,16,24,48和72 h后取材,对照组处理为RH 55%,8 ℃培养0 h,每个处理采用3只红光熊蜂工蜂,3次生物学重复。
1.2 总RNA提取与cDNA第一链的合成
将1.1节中不同低温(5~25 ℃)培养以及8 ℃低温胁迫不同时间的工蜂分别放入液氮研磨,按照Qiagen通用总RNA提取试剂盒(RNeasy Plus Universal Mini Kit)抽提总RNA,120 V、1%琼脂糖电泳检测RNA完整性;按照试剂盒PrimeScriptTMRT Master Mix说明书反转录合成cDNA第一链,4 ℃保存备用[11-12],每处理取3只工蜂,3次生物学重复。
1.3 红光熊蜂GS、Akt2基因全长克隆
以意大利蜜蜂(GenBank登录号:XM_001120954.5)GS基因序列设计引物(表1),以1.2节中RH 55%,25 ℃培养的红光熊蜂工蜂RNA反转录生成的cDNA第一链为模板,克隆红光熊蜂GS基因核心序列。PCR反应体系(20 μL): cDNA 1 μL, LA缓冲液 (10×) 2.0 μL,dNTP Mix 3.0 μL,20 μmol/L上下游引物各1 μL,5 U/μL LA聚合酶混合液0.5 μL,灭菌ddH2O加至20 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,59 ℃退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。扩增产物回收送至生工生物工程(上海)股份有限公司测序。

表1 本研究所用引物信息
以GS核心片段设计特异性引物,与GS 3’CDS引物按照SMARTerTMRACE cDNA Amplication试剂盒说明书克隆红光熊蜂GS基因3’端,反应条件同上;红光熊蜂Akt2基因全长克隆步骤同GS基因。
1.4 红光熊蜂GS、Akt2全长基因生物信息学分析
根据GS、Akt2基因全长序列,采用ORF Finder预测基因开放阅读框;Prot Param在线软件分析其理化特性;Prot Scale分析氨基酸序列的疏水性和亲水性;SOPMA在线软件预测蛋白质二级结构[13];GenBank数据库Blastp程序预测氨基酸保守域及同源性分析;采用TBtools软件对GS、Akt2基因进行染色体定位。
1.5 红光熊蜂GS、Akt2互作蛋白网络构建分析
为验证红光熊蜂GS、Akt2蛋白的生理作用及其代谢信号通路,采用在线软件String(http://string-db.org/)构建GS、Akt2蛋白的互作蛋白网络,设置高可信度值为0.7。
1.6 红光熊蜂GS、Akt2基因的低温胁迫表达分析
1.6.1 不同温度胁迫下GS、Akt2基因表达水平分析 采用Primer Premier 6设计特异性引物GS-qF/R与Akt2-qF/R,以GAPDHF/R为内参引物(表1),采用RTQ-960 Pro实时荧光定量PCR仪,按照TaKaRa试剂盒SYBR Premix Ex TaqTMⅠ说明书进行实时荧光定量PCR,分析GS、Akt2基因在25,18,15,10,8和5 ℃培养下表达水平的差异。PCR反应体系(20 μL):cDNA模板1.5 μL,上、下游引物各1.0 μL,ROX Reference Dye Ⅱ 0.5 μL,SYBR Premix Ex TaqTM10 μL,ddH2O加至20 μL。PCR反应程序:95 ℃预变性4 min;95 ℃变性10 s,59 ℃退火30 s,72 ℃延伸45 s,40个循环;72 ℃延伸8 min。每处理取3只工蜂,3次生物学重复。
1.6.2 低温胁迫不同时间GS、Akt2基因表达水平分析 采用Primer Premier 6设计特异性引物GS-qF/R与Akt2-qF/R,以GAPDHF/R为内参引物(表1),采用RTQ-960 Pro实时荧光定量PCR仪,按照TaKaRa试剂盒SYBR Premix Ex TaqTMⅠ说明书进行实时荧光定量PCR,分析GS、Akt2基因在8 ℃培养不同时间(0,4,8,12,16,24,48和72 h)的表达水平差异,探究红光熊蜂低于生活温度不出蜂房工作时,其机体对低温刺激的反应,PCR反应体系和反应程序同1.6.1节。
1.7 数据处理与分析
采用Microsoft Excel 2010统计分析试验数据并制图,利用SPSS 21.0软件进行基因相对表达量统计分析。
2 结果与分析
2.1 红光熊蜂GS、Akt2基因克隆
以GS-cF/R为引物RT-PCR扩增获得892 bp基因片段,经Blastp比对表明该片段编码氨基酸与较多昆虫GS基因均具较高的同源性(85%~98%),可见,扩增得到的基因片段为红光熊蜂GS基因核心序列。基于GS基因核心序列,进行5’-RACE与3’-RACE PCR扩增,分别得到378和197 bp的明亮条带,采用SeqMan程序将5’-RACE、核心序列与3’-RACE 3段DNA序列进行拼接,获得长度为1 417 bp DNA片段,即GS基因(图1-A)。
以Akt2-cF/R为引物RT-PCR扩增获得674 bp基因片段,经Blastp比对表明该片段编码氨基酸与较多昆虫Akt2基因均具较高的同源性(92%~96%),可见,扩增得到的基因片段为红光熊蜂Akt2基因核心序列。基于Akt2基因核心序列,进行5’-RACE与3’-RACE PCR扩增,分别得到168和488 bp的明亮条带,采用SeqMan程序将5’-RACE、核心序列与3’-RACE 3段DNA序列进行拼接,获得长度为926 bp DNA片段,即Akt2基因(图1-B)。
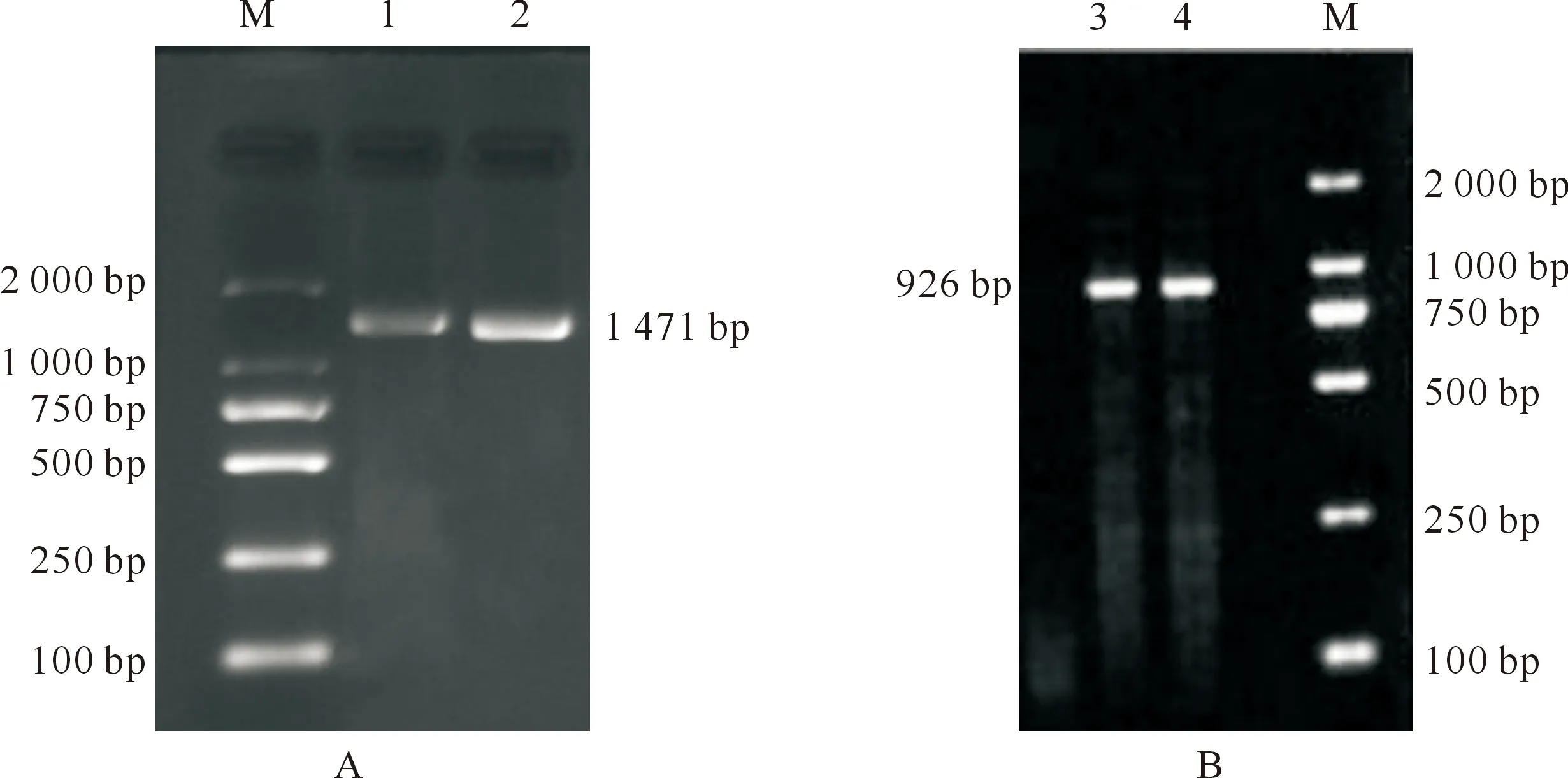
A.GS基因克隆;B.Akt2基因克隆
2.2 红光熊蜂GS、Akt2基因序列分析
红光熊蜂GS基因全长为1 417 bp,包含一个1 020 bp的完整开放阅读框(ORF),编码339个氨基酸,其5’-UTR 291 bp,3’-UTR 106 bp(图2)。
Prot Param分析表明,GS蛋白分子式为C1594H2530N530O494S9,分子相对质量为37.31 ku,等电点(pI)为8.31,脂肪系数61.56。Prot Scale分析表明GS蛋白为亲水性蛋白;PSORT Prediction亚细胞定位该蛋白可能存在于线粒体中;SOPMA预测GS蛋白二级结构包括无规则卷曲(51.92%)、α-螺旋(23.89%)、延伸链(12.09%)和β-转角(12.09%);NetPhos 3.1预测其具有12个Ser、6个Thr、2个Tyr,可能成为GS蛋白激酶磷酸化位点。
红光熊蜂Akt2基因全长为926 bp,ORF为837 bp,编码278个氨基酸,其5’-UTR 48 bp, 3’-UTR 57 bp(图3)。Prot Param 分析表明,Akt2蛋白质分子式为C1427H2227N369O423S13,分子相对质量为31.74 ku,等电点(pI)为5.29,脂肪系数89.42;Prot Scale分析表明Akt2蛋白为亲水性蛋白。PSORT Prediction亚细胞定位该蛋白可能存在于细胞核或线粒体中;SOPMA预测Akt2蛋白二级结构包括无规则卷曲(33.45%)、α-螺旋(34.89%)、延伸链(23.74%)和β-转角(7.91%);NetPhos 3.1预测其具有7个Ser、8个Thr、5个Tyr,可能成为Akt2蛋白激酶磷酸化位点。
SignalP4.1 在线预测红光熊蜂GS、Akt2蛋白均不具信号肽序列,故二者均为非分泌蛋白。染色体定位结果显示,GS、Akt2基因分别分布在红光熊蜂1H和3H号染色体上。
2.3 红光熊蜂GS、Akt2互作蛋白网络分析
为验证红光熊蜂GS、Akt2蛋白的生理作用,采用在线软件String(http://string-db.org/)搜索互作蛋白网络关系,结果显示与GS、Akt2互作的蛋白质共有9个(图4),即:糖原合成酶激酶-3β、叉头转录因子、丝/苏氨酸蛋白激酶、4,5-二磷酸磷脂酰肌醇3激酶、磷酸肌醇依赖性蛋白激酶-1、促分裂素原活化蛋白激酶5、TBC1结构域家族蛋白成员4等,这些蛋白均为PI3K/Akt/Mtor、PI3K/Akt/Mtor以及PI3K/Akt/Foxo信号通路的重要蛋白酶类,参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能调节。GS直接参与糖原合成与分解过程,Akt2是胰岛素信号通路中重要的蛋白激酶,调控糖代谢过程,当个体处于低温刺激时可抑制细胞凋亡,调控机体累积大量抗冻保护物质葡萄糖以抵御低温损伤,可见,GS、Akt2是红光熊蜂低温胁迫糖代谢过程中的关键酶。
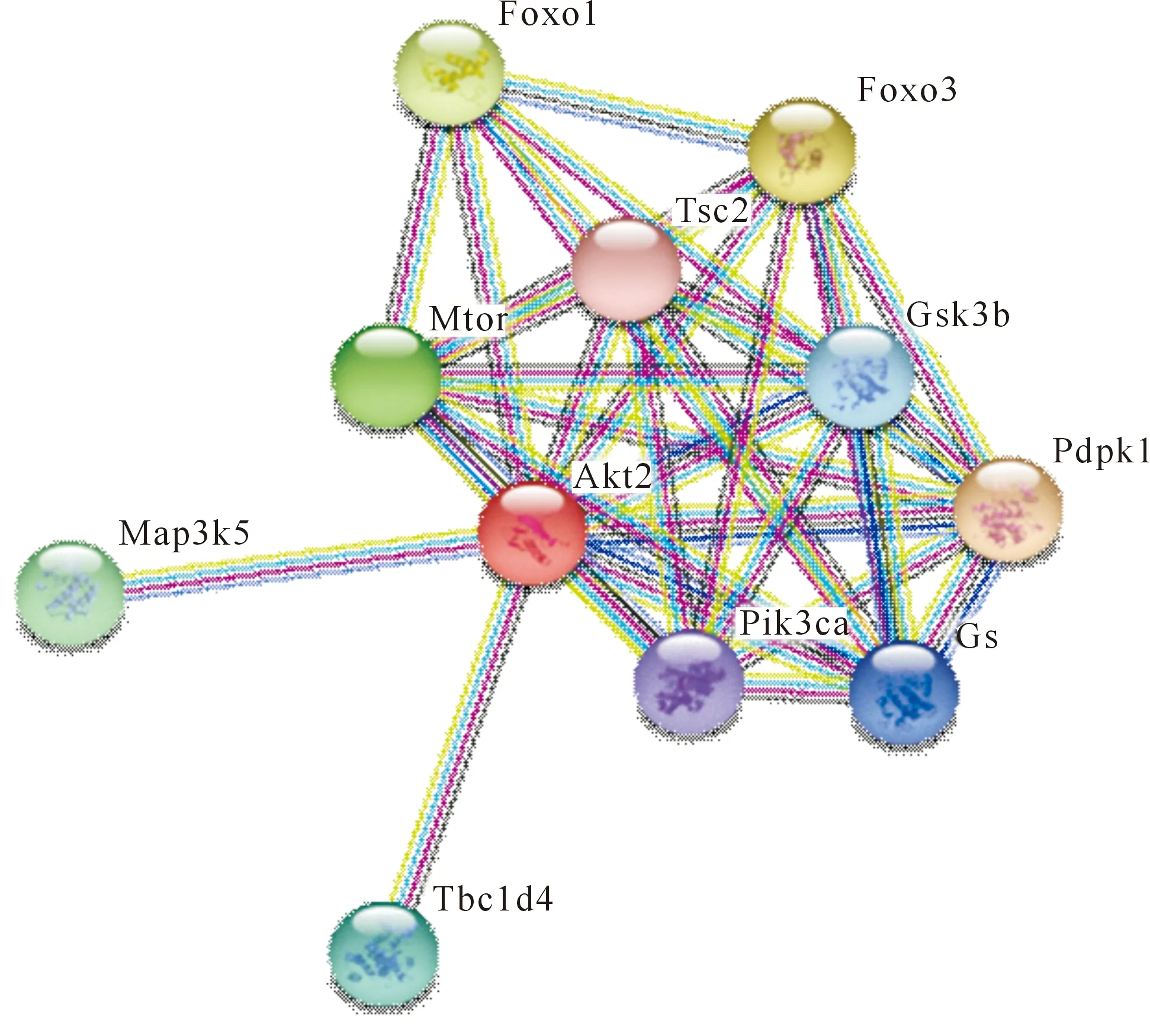
Gsk3b.糖原合成酶激酶-3β;Gs.糖原合酶;Foxo3.叉头转录因子3;Foxo1.叉头转录因子1;Mtor.丝/苏氨酸蛋白激酶;Tsc2.抑癌基因2;Pik3ca.4,5-二磷酸磷脂酰肌醇3激酶;Pdpk1.磷酸肌醇依赖性蛋白激酶-1;Map3k5.促分裂素原活化蛋白激酶5;Tbc1d4.TBC1结构域家族蛋白成员4
2.4 红光熊蜂GS、Akt2基因低温胁迫表达分析
2.4.1 不同温度胁迫下GS、Akt2基因的表达水平 不同温度胁迫下红光熊蜂GS、Akt2基因的相对表达量如图5所示。
由图5可知,GS基因的相对表达量随温度降低呈下降趋势,15 ℃时表达量下降显著,5 ℃时表达量是25 ℃的16.1 %;而红光熊蜂Akt2基因表达水平随温度降低呈明显上升趋势,15 ℃时Akt2基因的表达量显著升高,5 ℃达到峰值,约为25 ℃时表达量的3.7倍,推测红光熊蜂为适应低温环境,机体通过糖原合成过程中的关键限速酶GS限制糖原的合成,使机体呈高糖状态,这种高糖状态源自于糖原降解,即通过抑制GS活性,促进GP活性,导致体内葡萄糖积累,因此,低温环境下GS表达一直处于较低水平,说明低温条件下红光熊蜂机体可产生大量葡萄糖作为抗冻物质,保护自身免受低温损伤,对红光熊蜂抵御低温环境起重要作用。
2.4.2 低温胁迫不同时间GS、Akt2基因的表达水平 红光熊蜂生活温度为10~30 ℃,温度低于10 ℃便不出蜂房工作,本研究探究低于生活温度时,红光熊蜂机体对低温刺激的反应。图6为8 ℃低温处理不同时间红光熊蜂GS、Akt2基因的相对表达量。由图6可知,与对照(0 h)相比,8 ℃胁迫8 h 时GS基因的相对表达量显著下降;胁迫12 h相对表达量最低,约为对照组的11%;胁迫12 h后GS相对表达量随胁迫时间的增加有所回升,24 h后基本平稳,表明低温胁迫下红光熊蜂GS基因相对表达量随胁迫时间延长呈先显著下降后缓慢上升逐渐趋于平稳的趋势。8 ℃低温胁迫下,红光熊蜂Akt2基因表达水平随胁迫时间延长呈先上升后下降的趋势。与对照(0 h)相比,胁迫4 h时Akt2基因相对表达量显著升高,12 h时达到峰值,约为对照组的1.7倍,随后其相对表达量随胁迫时间延长缓慢下降,胁迫72 h时基本恢复正常水平,说明在遇到低温刺激时,红光熊蜂机体快速做出应答反应,但可通过自身调节恢复且维持在一个稳定的状态。
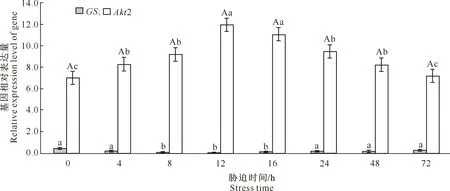
图6 低温胁迫不同时间红光熊蜂GS、Akt2基因表达量变化
3 讨 论
3.1 低温胁迫对红光熊蜂的危害
红光熊蜂是农业生产中重要的传粉昆虫,其传粉能力远超过蜜蜂,所以熊蜂采蜜是农业增产的重要渠道[14]。蜂群耐低温胁迫或安全越冬对第二年熊蜂的生产、作物产量至关重要。低温冷害一直作为严峻的非生物逆境胁迫影响着红光熊蜂的寿命,温度低于10 ℃红光熊蜂便不出蜂房工作,所以,了解红光熊蜂耐低温胁迫的生理机制及生存策略对保护和培育抗寒蜂种至关重要[15]。低温环境对昆虫身体各器官及其新陈代谢水平影响较大,如低温胁迫下,昆虫机体新陈代谢水平显著下降,营养物质的吸收与利用、缺氧缺血、蛋白质结构与细胞膜流动性均会发生改变,昆虫则通过减慢代谢水平来降低能量的消耗,也可通过提高或降低糖代谢相关基因或蛋白质的表达量(如GS、Akt基因)来抵御低温胁迫[16]。低温胁迫时体液结冰,器官遭物理压迫,而自由水是维持生命正常新陈代谢不可或缺的物质,当红光熊蜂体温低于体液的冰点温度时,渗透压降低,致使细胞内液外流,自由水含量显著下降,细胞发生皱缩,细胞内溶质浓度升高,新陈代谢紊乱,机体处于低代谢缺氧状态,造成氧化损伤[17-18],可见,细胞产生冰晶不但损伤机体细胞,形成氧化损伤,亦可产生溶质中毒现象威胁红光熊蜂的生存。研究表明,昆虫在低温环境下能够自我提高体内结合水的含量,同时降低自由水含量,以避免体液结冰,而红光熊蜂体内葡萄糖、游离水含量的增加可提高过冷却点温度。过冷却现象是低温状态下红光熊蜂体内抗寒物质所表现出来的一种抵御低温环境的生理现象,过冷却点越低,表明昆虫的抗寒能力越强[19]。
3.2 红光熊蜂抵御低温的分子机制
糖原是动物体内储存葡萄糖的一种形式,由多个葡萄糖组成的生物大分子,低温胁迫下,糖原分解葡萄糖来维持血液中的葡萄糖含量,为机体新陈代谢提供能量,而机体内过多的葡萄糖按能量代谢方式转化为糖原储存在红光熊蜂体内,以确保在逆境胁迫下维持其机体正常的生命活动[20-21]。本研究分析了8 ℃低温胁迫下红光熊蜂GS基因的表达量,结果表明,胁迫4 h 时GS基因的相对表达量显著下降,12 h相对表达量最低,约为对照组的11%,而后GS相对表达量随胁迫时间的延长有所回升,24 h后基本平稳,推测红光熊蜂为适应低温胁迫,机体通过降低糖原合成过程中的关键限速酶GS表达水平来抑制糖原合成,使机体产生大量葡萄糖提供能量,以提高过冷却点温度抵御低温,葡萄糖的产生来源于机体糖原降解,即通过抑制GS活性,促进糖原磷酸酶(glycogen phosphorylase,GP)的活性,导致体内葡萄糖大量积累,体内葡萄糖含量与温度降低呈正相关,即温度越低体内葡萄糖含量越高[22-23]。低温胁迫下,红光熊蜂Akt2基因相对表达量呈先上升后降低的趋势,胁迫4 h时Akt2基因的相对表达量显著升高,12 h达到峰值,约为对照的1.7倍,而后通过自身调节,其相对表达量随胁迫时间延长缓慢下降,72 h基本恢复正常水平。Akt2属于胰岛素信号通路中的重要激酶,低温胁迫下,Akt通过调节下游分子GSK3β和GS活性,降解和转化糖原产生大量葡萄糖来维持机体血糖平衡抵御低温[24]。按照PI3K-Akt信号通路原理,Akt2磷酸化GSK3β后,抑制了GSK3β的活性,而促进GS活性,GS基因的表达量应该随着Akt2上调,但事实GS基因的表达量却是下调,说明其不仅仅是调控糖代谢,也可通过PI3K/Akt/Mtor、PI3K/Akt/Mtor以及PI3K/Akt/Foxo等信号通路,调节Mtor参与抗冻蛋白质合成、调控Bad等,进而达到调控细胞调亡或通过调节FoxO亚家族调控能量代谢等过程,如PI3K- AKT - FoxO1信号通路中FoxO1作为机体调控代谢的重要因子,受胰岛素负调控,胰岛素缺乏时,FoxO1集中于细胞核,启动靶基因胰岛素反应元件(insulin response element,IRE)的表达促进糖异生;胰岛素充足时,FoxO1激活PI3K-AKT通路,导致下游分子AKT磷酸化活化,进而使FoxO1磷酸化从细胞核易位到细胞质失去活性[25]。与Xu等[26]研究结果一致,即在0 ℃低温胁迫下,中华蜜蜂(Apisceranacerana)成蜂(20日龄)与生态环境相关的Ca2+信号通路、FoxO信号通路、Hippo信号通路,及其丝氨酸/苏氨酸蛋白激酶、热激蛋白以及锌指蛋白等均存在显著的差异表达现象。可见,在低温胁迫过程中Akt2参与多种信号通路行使多种功能,以达到红光熊蜂抵抗低温伤害的目的。此外,红光熊蜂GS、Akt2基因在15 ℃时表达量波动较大,相对其体温波动也很大,推测15 ℃是红光熊蜂体温调节的临界值,可能与红光熊蜂的能量代谢密切相关。

