经皮椎间孔镜下病灶清除治疗腰椎间隙感染的疗效分析
黄群 朱现玮 严飞 徐炜 徐沁 周志平
腰椎间隙感染是椎间盘和相邻椎体、关节以及软组织感染的统称,以椎间盘感染、相邻椎体感染以及硬膜外脓肿形成为特征表现[1]。免疫力低下、合并糖尿病、肿瘤疾病、艾滋病等是椎间隙感染的易感因素。此外,脊柱注射或脊柱手术后医源性感染的数量一直在增加。病人最常见症状是腰背痛,部分病人表现为发热、根性痛、神经损害等[2],其临床表现因感染部位、受累节段数、致病菌不同而有差异。因为腰椎间隙感染解剖位置较深,血培养敏感度不高,椎间隙解剖结构的特殊性,药物治疗的有效抗菌浓度难以达到,对这类病人的治疗比较困难。随着腰椎手术病例的增多,腰椎间隙感染有增加趋势,严重影响手术效果和病人的康复进程[3]。对于经保守治疗无效、神经受压、巨大脓肿或椎旁脓肿形成、感染侵犯邻近节段椎体以及腰椎进行性畸形的病人需接受手术治疗。手术可以彻底清创,神经减压,恢复脊柱的稳定性,还能取病灶组织进行细菌培养,明确病原菌,有助于术后用药[4-5]。既往手术治疗包括切开清创冲洗引流联合内固定以及CT 引导下穿刺置管引流:开放手术以前路、后路或前后路联合等方式行病灶清除和椎间植骨融合,临床疗效满意,但其缺点也很明显,如手术时间长、创伤大、术后恢复慢;由于部分病人一般状况差,难以耐受切开清创引流;而CT引导下穿刺时常因脓液黏稠堵塞引流管导致引流失败。经皮椎间孔镜技术因其具有操作简便、安全、微创的优点,不仅被应用于腰椎间盘突出症的治疗,而且已有学者将脊柱内镜技术应用到腰椎间隙感染的治疗中[6-7]。自2016年11月至2019年9月我院采用经皮椎间孔镜技术治疗腰椎间隙感染病人14例,我们从临床功能评价指标、血常规、C-反应蛋白(CRP)、红细胞沉降率(ESR)等炎症指标及影像学评价指标方面探讨椎间孔镜技术治疗腰椎间隙感染的疗效。
资料与方法
一、纳入标准与排除标准
纳入标准:①通过卧床休息、抗感染治疗效果不佳的腰椎间隙感染病人;②顽固性腰背部疼痛,经保守治疗效果不佳;③出现神经受压表现;④影像学(MRI)结合实验室检查结果确诊;⑤病人一般状况差,难以耐受开放手术。
排除标准:①脊柱畸形、失稳;②伴椎体骨质重度破坏;③纤维环破裂合并椎管脓肿;④晚期肿瘤病人合并感染;⑤存在明显凝血功能障碍病人。
二、一般资料
14例腰椎间隙感染病人中男5例,女9例,年龄为(57.26±8.38)岁(44~69 岁)。所有病人均在局麻下行经皮椎间孔镜下病灶清除置管引流术。术后根据药敏试验结果给予敏感抗生素抗感染治疗。术后定期复查血常规、ESR 及CRP 检测炎症控制情况。手术由同一名术者操作。
三、手术方法及术后处理
病人侧卧于手术台,透视引导下定位靶点,标记穿刺点。常规消毒、铺巾,1%利多卡因局部浸润麻醉至上关节突,透视引导下穿刺进入靶点,置入导丝,顺导丝逐级插入扩张套管,然后逐级使用环锯,去除上关节突部分骨质,扩大椎间孔,置入工作通道。连接内镜,在椎间孔镜下探查椎管。髓核钳清除被感染的髓核、炎性肉芽组织及终板组织,高频电极清除病灶周围坏死组织及脓肿壁,持续生理盐水冲洗椎间隙,探查神经根及硬膜囊无明显压迫。最后通过椎间孔镜通道放置2根引流管至病变椎间盘间隙,固定。拔出内镜及工作通道,切口缝合1 针,无菌敷料包扎。
将术中取出的病灶组织进行病理检查和细菌培养,根据药敏试验结果及时使用敏感抗生素。术后所有病人均采用含庆大霉素的0.9%氯化钠溶液连续灌洗,待液体清亮并连续2 次血培养及引流液培养无细菌生长后拔除引流管。卧床期间鼓励病人早期行腰背肌、四肢功能锻炼,预防肌肉萎缩及深静脉血栓形成。引流管拔除后佩戴腰围逐步下床活动。病人术后定期复查血常规、ESR 及CRP 等炎症指标。术后1个月复查腰椎MRI判断病灶情况。
四、评估指标
记录病人术前和术后1周、1个月、3个月疼痛视觉模拟量表(visual analogue scale,VAS)评分、日本骨科协会(Japanese Orthopaedic Association,JOA)评分、Oswestry 功能障碍指数(Oswestry disability index,ODI)。末次随访时采用改良MacNab 标准对治疗效果进行评价:优,无明显疼痛,活动无明显受限,恢复正常生活及工作;良,症状得到大部分缓解,偶感疼痛,基本不影响工作生活;可,症状得到改善,但对工作与生活有影响;差,手术前后症状无缓解甚至加重,需要再次手术治疗。
五、统计学分析
采用SPSS 23.0软件(IBM公司,美国)进行数据分析,计量资料以均数±标准差()表示,手术前后VAS评分、JOA评分、ODI采用重复测量方差分析,并行配对t检验作两两比较,检验水准均为双侧α=0.05。
结 果
所有病人均获得随访,随访时间为(13.57±2.56)个月。病人术后腰痛症状即刻缓解,住院时间为(22.21±3.49)d。术前3 例病人存在不同程度的尿潴留或尿困难,术后全部恢复正常。术后1 周、1 个月、3 个月病人VAS 评分、JOA 评分、ODI 均优于术前,差异有统计学意义(P<0.05,表1)。术后1个月复查,ESR、CRP 均降至正常范围(表2)。末次随访时,采用改良MacNab 标准对病人进行评估,优9例,良3例,可1例,差1例,优良率为85.71%。
表1 病人手术前后VAS评分、JOA评分、ODI比较(±s)
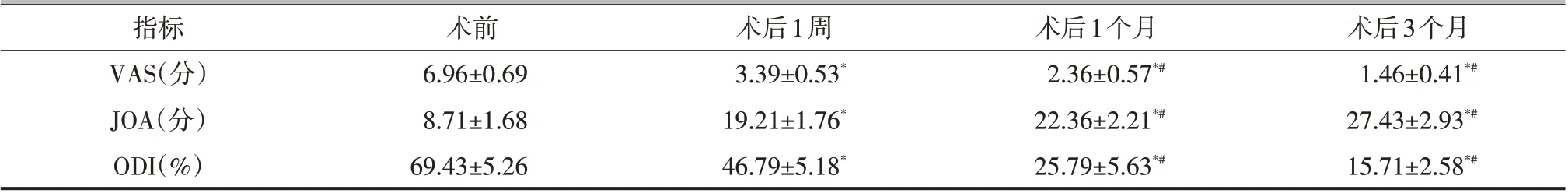
表1 病人手术前后VAS评分、JOA评分、ODI比较(±s)
注:与术前比较,*P<0.05;与术后1周比较,#P<0.05
指标VAS(分)JOA(分)ODI(%)术前6.96±0.69 8.71±1.68 69.43±5.26术后1周3.39±0.53*19.21±1.76*46.79±5.18*术后1个月2.36±0.57*#22.36±2.21*#25.79±5.63*#术后3个月1.46±0.41*#27.43±2.93*#15.71±2.58*#
表2 病人手术前后实验室检查结果比较(±s)
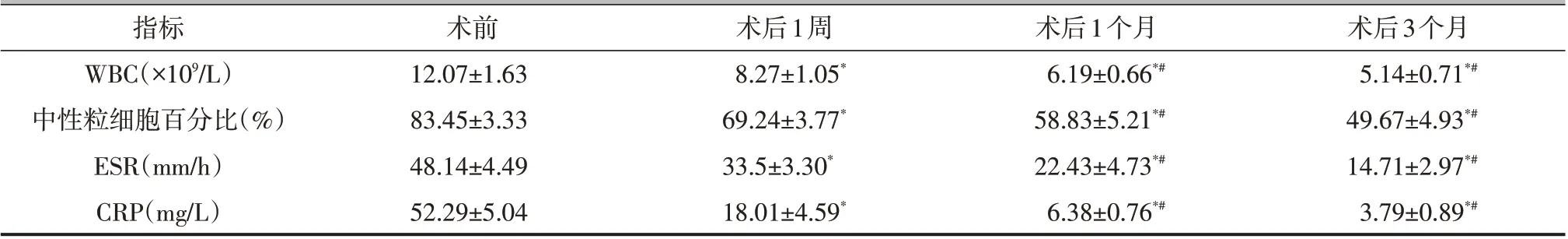
表2 病人手术前后实验室检查结果比较(±s)
注:与术前比较,*P<0.05;与术后1周比较,#P<0.05
指标WBC(×109/L)中性粒细胞百分比(%)ESR(mm/h)CRP(mg/L)术前12.07±1.63 83.45±3.33 48.14±4.49 52.29±5.04术后1周8.27±1.05*69.24±3.77*33.5±3.30*18.01±4.59*术后1个月6.19±0.66*#58.83±5.21*#22.43±4.73*#6.38±0.76*#术后3个月5.14±0.71*#49.67±4.93*#14.71±2.97*#3.79±0.89*#
病灶组织细菌培养结果阳性者6例(42.9%),其中大肠埃希菌3例,金黄色葡萄球菌2例,结核杆菌1 例。3 例大肠埃希菌感染者予以头孢哌酮他唑巴坦2.25 g静脉滴注(2次/d),治疗6周,出院后改口服治疗6周;2例金黄色葡萄球菌感染者予以头孢呋辛2.0 g 静脉滴注(2 次/d),治疗6 周,出院后继续口服治疗6 周;1 例结核杆菌感染者予以头孢呋辛2.0 g静脉滴注(2 次/d),治疗6 周,住院期间及出院后口服帕司烟肼、利福喷丁、乙胺丁醇、吡嗪酰胺继续治疗10个月。其余8例细菌培养结果阴性病人,使用经验性抗生素治疗(头孢呋辛+左氧氟沙星),其中7 例效果较好,静脉滴注6 周后继续口服治疗6 周;余1例病人,头孢呋辛和左氧氟沙星治疗效果不佳,改为美罗培南和利奈唑胺治疗,效果良好,出院后改为口服抗生素继续治疗6周。病人术后定期复查血常规、ESR、CRP,炎症指标均逐渐下降。术后1个月内10例病人上述指标恢复至正常,术后3个月内所有病人上述炎症指标均恢复正常。典型病例见图1。
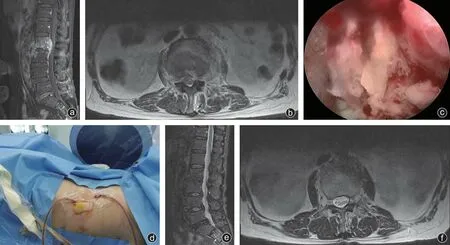
图1 病人,男,67岁,因“腰背部伴左下肢疼痛1个月”入院。予卧床休息,口服抗结核药物等保守治疗效果不佳,择期在局部麻醉下行椎间孔镜下椎间隙感染病灶清除联合灌洗引流术,术中病灶组织培养为结核杆菌,术后予头孢呋辛并继续抗结核治疗,症状缓解,恢复良好 a、b:L2/3椎体异常信号灶,伴椎旁软组织肿胀,L2/3平面椎管受压狭窄;c:术中镜下清除脓肿及炎性组织;d:术中病灶置入灌洗引流管;e、f:L2/3椎体异常信号灶较前明显好转,椎旁软组织肿胀伴异常信号已吸收
讨 论
一、腰椎间隙感染治疗方案的选择
腰椎间隙感染是由病原微生物引起的腰椎椎体、椎间盘及椎体周围软组织的感染[8],其早期无特异性症状和体征,初始症状出现到最后确诊往往需2~6 个月。临床表现包括腰背部剧烈疼痛、活动受限,休息后无缓解,发热和进行性的神经功能障碍[9]。X线片、CT早期无特异性改变,MRI具有较高的早期诊断价值,可为临床诊断提供早期依据[10]。脊柱感染的传统治疗方式主要包括非手术治疗和开放手术治疗。对于原发性椎间隙感染,若只有轻微的破坏或是处于感染早期阶段,可采取卧床休息、加强营养及敏感抗生素等保守治疗。若抗生素治疗无效或出现进展性脊柱畸形、腰椎失稳、硬膜外脓肿及出现神经损害,则需要手术治疗[11]。
手术能彻底清除病灶,矫正畸形,恢复脊柱序列,改善神经功能,降低复发机率,缩短卧床时间,迅速缓解疼痛。因此,目前多主张手术治疗[12]。但开放手术也有缺点,创伤大,对于高龄、基础条件较差的病人围手术期风险大,并发症多。
大部分腰椎椎间隙感染病人经卧床休息、加强营养及敏感抗生素对症治疗可治愈[13]。手术治疗包括经皮抽吸引流术、CT引导下病灶穿刺置管引流术,其治疗椎间隙感染也可以取得比较满意的疗效[14]。但单纯置管灌洗引流不能直接清除病灶组织,有时因脓液黏稠而导致引流失败。
对出现神经受压、腰椎失稳、椎旁巨大脓肿形成以及经保守治疗无效的病例,需行手术治疗。手术治疗的目的是彻底清除病灶、减压、尽可能恢复神经功能。传统的开放手术方式主要包括前路、后路病灶清除植骨融合内固定术,外侧入路病灶清除联合后路植骨内固定术[15-16]。开放手术疗效显著,可以彻底清除病灶并提供坚强的内固定,有利于椎间融合和脊柱序列稳定。但其创伤大、手术时间较长、出血多,术后恢复慢,易合并并发症,且老龄合并基础疾病病人更难以耐受。尽管使用脊柱植入物进行脊柱重建手术效果令人满意,但仍有较高的并发症发生率,包括内固定失效、感染复发等[17]。
二、椎间孔镜技术治疗腰椎间隙感染
随着脊柱外科技术的进步和微创理念的发展,椎间孔镜技术在腰椎疾病治疗方面得到广泛应用[18]。1997 年Haaker 等[19]就报道了采用经皮内镜下椎间盘清除治疗椎间隙感染16 例,初期疗效满意。Ito等[20]对15 例经抗生素治疗无效的椎体化脓性炎感染病人采用后外侧脊柱内镜清创和灌注冲洗引流进行处理,术后常规抗感染治疗。所有病人在术后即刻疼痛明显缓解,临床疗效满意。Yang等[21]对32例腰椎间隙感染病人行脊柱内镜治疗,取得了满意疗效。本研究中病人均在局部神经阻滞麻醉下通过椎间孔镜,直视下将椎间盘甚至是硬膜外间隙的感染病灶、坏死组织在内镜监测下清除。通过内镜可精确、安全定位及清除病灶。术中大量生理盐水冲洗,使脓液、病原菌、炎性坏死组织得到大部分清除,病人术后疼痛症状可以大部分缓解。术后持续灌洗引流,充分清除感染区病原菌。此术式为局麻手术,创伤小,未干扰脊柱稳定性结构,对高龄或基础条件差的病人非常适合。术后根据药敏试验给予足量足疗程敏感抗生素已基本成为共识。
本研究中14 例病人均采用经皮椎间孔镜手术治疗,术后1周、1个月、3个月时病人VAS评分与术前比较明显降低。病人ODI 由术前(69.43±5.26)%下降至术后3 个月的(15.71±2.58)%,临床疗效显著,病人生活质量得以大幅改善和提高。病人末次随访时改良MacNab优良率为85.7%,说明此种微创治疗方案临床疗效满意,临床上值得推广。国内学者采用经皮椎间孔镜技术治疗腰椎非特异性感染疾病,病人均获得良好效果,术后症状均明显缓解,且无感染复发情况[6-7]。
三、我们的体会
椎间孔镜技术是治疗腰椎间隙感染或术后感染的有效方法,可以在局麻下完成手术,对于高龄、合并较多基础疾病、不能耐受全麻病人非常适合,其适应证包括病变累及单节段或单间隙硬膜外脓肿病人,脊柱感染早期阶段,椎体轻微或中度破坏性改变。但对于脊柱感染所致的多个椎体的广泛破坏或者脊柱明显畸形失稳,该手术的效果可能有限。我们需重视病人术前检查,选择合适的病例,通过细致的读片和全面临床检查,评估该手术在脊柱感染不同阶段和严重程度下的疗效和适应证。术中调整工作通道和孔镜的镜头方向,在镜下以髓核钳将感染的髓核与终板组织清理干净,并以双极射频刀将病灶周围坏死组织和脓肿壁予以清除,直达周边血运良好组织;若有渗血,行消融电极止血。术中需大量生理盐水进行持续、反复冲洗。术后灌洗引流管需待病人体温正常、引流液清亮、炎症指标明显下降、连续两次以上引流液细菌培养阴性后再拔除。根据药敏结果及时、足量、足疗程使用敏感抗生素。
综上所述,椎间孔镜技术是治疗单节段腰椎间隙感染或合并硬膜外、椎旁脓肿的有效选择。其可以获得细菌学诊断,还能有效缓解病人的症状,临床疗效满意。但目前尚无大宗证据表明脊柱内镜技术可以成为治疗椎间隙感染的常规治疗技术。由于腰椎间隙感染病例较少,需进行手术治疗的病例更少,本研究受样本数量限制,疗效评价需进行更进一步的研究。椎间孔镜下病灶清除联合置管冲洗引流可以作为开放手术的有效补充手段。

