miR-1247通过靶向CC趋化因子配体16调控肺炎幼鼠巨噬细胞极化和过敏性炎症
秦霞 姚娟
肺炎是下呼吸道感染疾病,是5岁以下儿童死亡和发病的重要原因。急性小儿肺炎严重威胁儿童患者的生命[1]。因此,迫切需要阐明婴儿性肺炎的关键机制[2]。最近研究表明,微小RNA(micro RNA,miRNA)可能具有塑造M1和M2巨噬细胞极化平衡的能力并歪曲免疫应答[3]。已经确定了几种miRNA参与了肺炎的发病机制[4]。最近,miR-1247被证明可调节胃癌细胞的生长和迁移[5]。miR-1247的异位表达可以抑制胰腺癌细胞的恶性行为和致瘤性[6]。而且,miR-1247的抑制作用可促进非小细胞肺癌细胞的侵袭和迁移[7]。miR-1247在癌症领域中的作用越来越多,但miR-1247对肺炎发展的影响尚不清楚。巨噬细胞是炎症的起始,传播和消退的主要参与者[8]。触发巨噬细胞的激活对消除入侵的病原体或刺激至关重要[9]。但是,一旦清除了传染性或有害性物质,就必须消除炎症信号,以防止自身破坏。因此,应同时重视巨噬细胞的正确激活和从炎症状态到免疫抑制状态的转变[10]。本文对miR-1247通过靶向CCL16调控肺炎幼鼠巨噬细胞极化和过敏性炎症进行详细研究为婴幼儿肺炎的诊断和治疗提供理论基础和新的见解。
1 材料与方法
1.1 动物实验
1.1.1 实验幼鼠:BALB/C幼鼠购自湖北医药学院动物试验中心[动物合格证号:SCXK(鄂)2021-0008],并维持在特定的无病原体条件下的医学院动物设施中。所有实验使用年龄和性别匹配的对照小鼠。
1.1.2 肺炎模型:腹膜内麻醉小鼠,加入盐酸氯胺酮(100 mg/kg)和甲苯噻嗪(10 mg/kg)。气管内滴注miR-1247模拟物(2 mg/kg)。24 h后,在指定的时间段内给予PBS或LPS(1 mg/kg,气管内)。在LPS暴露后24 h处死小鼠,并进行随后的功能分析。在短期研究中,LPS注射3 h后从小鼠收集血液,并测量血清中的细胞因子水平。
1.1.3 医学伦理学问题:动物实验均根据美国国立卫生研究院实验动物的护理和使用指南,以及杭州师范大学医学院动物护理和使用委员会的批准进行。
1.2 实验方法
1.2.1 细胞培养及腹膜巨噬细胞和肺泡巨噬细胞的产生:RAW264.7细胞系获自美国典型培养物保藏中心,并在含有10%(V/V)热灭活的FBS的DMEM(生命技术)中生长。为了制备鼠腹膜巨噬细胞,经腹膜内注射8周龄小鼠。含3%巯基乙酸盐的肉汤。72 h后,收获腹膜细胞,并通过快速粘附富集巨噬细胞。对于肺泡巨噬细胞,将收集的血液铺在12孔板中,反复洗涤后通过粘附选择巨噬细胞。
1.2.2 RNA分离和定量实时PCR分析:用RNeasy Plus Mini Kit(Qiagen,Hilden,德国)分离总RNA,并用SuperScript II(Life Technologies)合成cDNA模板。通过在ABI Prism 7300检测系统上使用SYBR Green Universal 2x qPCR Master Mix(Applied Biosystems,Foster City,CA),一式三份进行定量RT-PCR。如Livak和Schmittgen所述,使用2-ΔΔCT方法分析数据。将mRNA水平相对于内部对照基因(β-肌动蛋白)进行标准化。
1.2.3 质粒转染和荧光素酶报告基因检测:将编码小鼠miR-1247的cDNA插入pcDNA3.1载体(Invitrogen)。使用QuickChange定点诱变试剂盒(Stratagene)通过PCR诱变靶向CCL16氨基酸残基。将完整或突变的CCL16构建体与含有miR-1247启动子的荧光素酶构建体一起通过JetPEI转染试剂(PolyPlus)转染到RAW细胞中。为了检测miR-1247对CCL16表达的影响,从基因组DNA扩增了CCL16 3’非翻译区(UTR),并将其克隆到pMIR-REPORT载体(Ambion)中。通过基于PCR的定点诱变生成pMIR-CCL16-mut,以删除miR-1247识别序列。使用siPORT NeoFX脂质体(Ambion)将pMIR-CCL16,pMIR-CCL16-mut或对照载体与miRNA共转染到RAW细胞中。24 h后收获细胞并分析荧光素酶活性。
1.2.4 免疫荧光:对于免疫荧光染色,在室温下用PBS中的10%封闭血清封闭非特异性结合1 h,将组织样品与针对绿色荧光蛋白(GFP;克隆4B10)和一抗孵育在4℃下过夜。加入与荧光偶联的第二抗体,并将载玻片在室温下孵育1 h。在相同条件下使用同型匹配的阴性对照抗体(R&D Systems)。细胞核用4’,6-二mid基-2-苯基吲哚(Invitrogen)复染色。将切片用ProLong金抗褪色试剂盒(分子探针,纽约州格兰德岛)安装,并用装有DS-Fi2相机(尼康)的Nikon Eclipse Ti-U显微镜观察。
1.2.5 ELISA测定细胞因子水平:通过ELISA测量血液中TNF-α,IL-6和IL-10的水平。
1.2.6 流式细胞仪:细胞在冰冷的流式细胞仪缓冲液(PBS中的2%[V/V]FCS和2 mmol/L EDTA,pH值7.5)中洗涤。阻断非特异性结合后,将细胞与荧光偶联的Ab孵育30 min,并用流式细胞仪缓冲液洗涤3次。在适当的地方使用适当的同型对照。根据前向和侧向散射对流式细胞术事件进行门控,选择F4/80+细胞进行M1/M2标记分析。在FACSCalibur流式细胞仪(BD Biosciences)上获取数据,并使用FlowJo(Tree Star)进行分析。
1.2.7 免疫印迹分析:通过在含有蛋白酶抑制剂混合物片剂(Roche Diagnostics)的裂解缓冲液(1%Triton X-100、1%脱氧胆酸盐,0.1%NaN3)中裂解2×106个细胞来制备细胞裂解液。在10%SDS-聚丙烯酰胺微型凝胶上分离等量的蛋白质,转移到Immobilon聚偏二氟乙烯膜(Millipore)上。在含有5%BSA的TBST中封闭后,将膜与适当的一级抗体孵育,与偶联至HRP的二级抗体(Santa Cruz Biotechnology)孵育。使用ECL Western印迹试剂盒(Amersham Biosciences)可视化信号。所有实验至少进行3次。
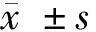
2 结果
2.1 miR-1247和CCL16 mRNA表达水平比较 肺炎抑制miR-1247表达,促进CCL16表达。肺炎组较对照组miR-1247 mRNA表达降低,CCL16 mRNA表达升高(P<0.05)。见图1,表1。
2.2 荧光素酶测定miR-1247靶向CCL16 与模拟对照组比较,miR-1247模拟组抑制了CCL16 3’UTR野生型的相对荧光素酶活性(P<0.05),miR-1247模拟组对CCL16 3’UTR突变型的相对荧光素酶活性没有显著影响,差异无统计学意义(P>0.05)。荧光素酶测定证实miR-1247靶向CCL16。见图2,表2。
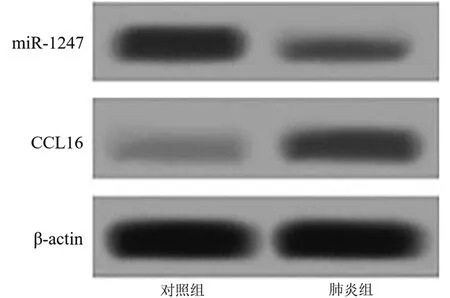
图1 miR-1247和CCL16mRNA表达水平
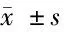
表1 miR-1247和CCL16mRNA表达水平

图2 CCL16和miR-1247的预测结合序列
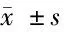
表2 荧光素酶测定(光密度值)
2.3 miR-1247调控凋亡蛋白(Bcl-2 、Bax和Caspase-3)表达 肺炎组较对照组Bcl-2 表达降低,Bax和Caspase-3表达水平升高(P<0.05),miR-1247模拟组较肺炎组Bcl-2 表达升高,Bax和Caspase-3表达水平降低(P<0.05)。见表3。
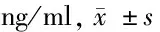
表3 凋亡蛋白的表达水平
2.4 miR-1247调控炎性因子(TNF-α、IL-6和IL-10)表达 肺炎组较对照组TNF-α和IL-6表达水平升高,IL-10表达水平降低(P<0.05),miR-1247模拟组较肺炎组TNF-α和IL-6表达水平降低,IL-10表达水平升高(P<0.05)。见表4。
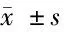
表4 炎性因子表达水平
2.5 M1和M2标记基因表达水平 miR-1247抑制M1标记基因表达,同时促进M2标记基因表达。肺炎组较对照组iNOS和IL-1β表达水平升高,Arg1和Mrc1表达水平降低,差异均有统计学意义(P<0.05),miR-1247模拟组较肺炎组iNOS和IL-1β表达水平降低,Arg1和Mrc1表达水平升高,差异有统计学意义(P<0.05)。数据表明,miR-1247在M1/M2巨噬细胞极化中起作用,miR-1247可以促进M1促炎性巨噬细胞的激活,同时限制M2极化巨噬细胞的发育。见表5。
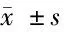
表5 M1和M2标记基因表达水平
2.6 miR-1247抑制JNK活性以促进M2巨噬细胞发育 肺炎组较对照组p-p38、p-p65、p-ERK和p-JNK蛋白表达水平升高,差异均有统计学意义(P<0.05),miR-1247模拟组较肺炎组p-p38、p-p65、p-ERK和p-JNK蛋白表达水平降低,差异均有统计学意义(P<0.05)。见表6,图3。
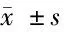
表6 miR-1247抑制JNK活性
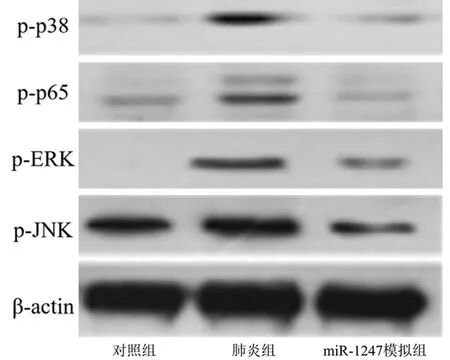
图3 蛋白质免疫印迹检测p-p38、p-p65、p-ERK和p-JNK蛋白表达水平
3 讨论
巨噬细胞是高度可塑性的,它们的功能表型取决于微环境提示。LPS诱导肺炎过程中,巨噬细胞会发生称为经典激活的巨噬细胞或M1巨噬细胞的表型,会产生高水平的促炎细胞因子,例如TNF-α、IL-6、IL-1β以及活性氧和氮物种[11]。相反,响应于诸如IL-4和IL-13的细胞因子,产生了交替活化的巨噬细胞,也就是M2巨噬细胞,并且高表达M2相关基因,例如甘露糖受体(Mrc)1/2,巨噬细胞半乳糖型钙。型凝集素(Mgl)1/2,几丁质酶3样3(Chi3l3或Ym1)和精氨酸酶1(Arg1)[12]。M1巨噬细胞在保护宿主免受感染中起着中心作用,但它们也有助于炎症和退行性疾病的发病机制。相反,M2巨噬细胞可抑制效应T细胞并促进肿瘤发展,但它们对消炎和组织修复有益。因此,极化的巨噬细胞反应的协调对于免疫力和体内平衡至关重要[13]。miRNA是一类内源性表达的小型非编码RNA,可通过调节mRNA的稳定性和翻译来调节基因表达。作为一种灵活而强大的调控系统,miRNA被认为是从发育、致癌到细胞增殖和分化等基本生物学过程的组成部分[14]。研究已经开始揭示miRNA在巨噬细胞激活和分化调控中的作用。
miRNA通过调节其靶基因而参与了广泛的生物学过程,因此我们在本研究中研究了miR-1247的潜在靶基因。miR-1247在胚胎中高表达,并与肺发育,胎盘形成和细胞凋亡有关。事实证明,miR-1247的异常表达与前列腺癌,膀胱癌和结肠癌有关[15]。值得注意的是,miR-1247在与炎症相关的肺部疾病(如肺纤维化,博来霉素或免疫复合物诱导的肺损伤和炎症)中被诱导,表明miR-1247在肝癌、炎症信号和肺部病理中的潜在作用。但是,miR-1247的确切作用和涉及的机制在很大程度上尚未确定。急性肺损伤是一种普遍存在的炎症性肺部疾病,其特征是促炎性介质的过度生成,炎性细胞的积累以及血纤蛋白和浮肿液的沉积[16]。促炎性巨噬细胞的持续活化被认为在急性肺损伤的发病机制中起重要作用。然而,未能将促炎性M1转化为抗炎性M2表型也说明了炎症病理的进展。
我们的结果表明,CCL16被确认为miR-1247的功能靶基因。已发现CCL16是一种强大的炎性细胞因子,在溃疡性结肠炎的炎性反应中起关键作用。CCL16也被认为是上皮来源的炎性介体,可在子宫内膜异位症的发展中介导炎症。CCL16在结节病患者的支气管肺泡灌洗液中也被上调。这些数据暗示了CCL16在几种疾病中的病理作用,包括炎性疾病。此外,肝表达的趋化因子/CCL16在嗜酸性粒细胞和肺炎嗜酸性粒细胞性肺炎患者的肺中积累中起着关键作用。在我们的研究中,敲低CCL16可以减轻LPS诱导的细胞损伤,而miR-1247抑制和CCL16敲低的组合可以逆转单独的CCL16敲低对LPS诱导的细胞损伤的影响。尽管尚未完全研究CCL16在肺炎中的作用,但我们的结果促使我们推测miR-1247可能通过靶向CCL16参与LPS诱导的急性肺炎。
我们证明了miR-1247抑制了M1偏向巨噬细胞的发育,同时促进了M2标记基因的转录。机制研究表明,miR-1247上调了B细胞淋巴瘤(Bcl)6的表达,抑制了JNK的激活和促炎性M1巨噬细胞的发育。
一项研究表明,随着ARPE-19细胞中氧化应激的增加,miR-1247的表达上调,并且发现谷胱甘肽S-转移酶pi 1(GSTP1)作为miR-1247的靶标[17]。此外,发现GSTP1的甲基化状态与肺癌的发病机制和恶性程度相关。miR-1247是否通过靶向GSTP1在肺炎的发展中起关键作用还需要进一步研究。此外,还研究了miR-1247与JNK或NF-κB通路之间的关系,以进一步探索miR-1247的调节机制。JNK途径是应激激活的蛋白激酶途径之一,被发现与组织稳态有关。JNK信号通路是介导TNF-α/IL-32轴在调节气道炎症中的关键机制。铜绿假单胞菌定植可以通过JNK信号通路促进小鼠呼吸机相关性肺炎。另外,NF-κB信号通路是重要的细胞信号通路,也被发现与人类疾病有关。该途径可在免疫和炎性反应中发挥关键作用,抑制κBα蛋白可以通过抑制NF-κB的活化来抑制严重的肺炎[18]。在我们的研究中,我们发现miR-1247超表达抑制了JNK和NF-κB途径。因此,我们推测miR-1247-CCL16轴可能通过JNK和NF-κB途径的激活而促进急性肺炎的发展。
综上所述,miR-1247的过表达可通过靶向CCL16减轻肺炎幼鼠巨噬细胞损伤。JNK和NF-κB通路可能是调节miR-1247在肺炎幼鼠巨噬细胞损伤中的作用的关键机制。我们的发现将为婴幼儿肺炎的治疗提供有希望的治疗策略。

