苹果树腐烂病病原种类及其亲缘关系分析
李亚鹏,张王斌,2,仪子博
(1塔里木大学植物科学学院,新疆阿拉尔 843300;2塔里木大学南疆农业有害生物综合治理重点实验室,新疆阿拉尔 843300)
0 引 言
【研究意义】我国苹果树的栽植面积、总产量均位于世界第一[1]。新疆独特的气候光热资源和区域比较优势,为阿克苏地区发展优势特色林果业提供得天独厚的自然条件[2-3],阿克苏地区苹果果面光滑细腻、色泽光亮、皮薄、肉质脆、口感风味极佳。阿克苏地区的苹果种植业属于典型的沙漠绿洲农业,不仅具有极高的经济价值,而且还起着防风固沙的作用[4]。苹果树腐烂病(Valsamali)是苹果树上一种具有毁灭性的病害。苹果树腐烂病在国内已有记录[5-7],2008新疆生产建设兵团第四师苹果树腐烂病大爆发,果树死亡率达40%;2013~2014年阿克苏地区10年树龄的苹果树上腐烂病平均发生率为30%,发病严重的果园发病率高达80%[8]。苹果树腐烂病主要危害苹果树的枝干,可使苹果树树皮腐烂坏死,刮开发病部位为褐色,当侧枝上的树皮坏死1周时会导致营养输送终止,使病部以上部分不能结果,导致产量降低。当主干发病严重时,会严重影响树体运输营养物质,导致树势衰弱,最终导致树体死亡,阿克苏地区的苹果树腐烂病发生日益严重,研究苹果树腐烂病菌的种类及其亲缘关系,对有效防治苹果树腐烂病有重要意义[9-10]。【前人研究进展】苹果树腐烂病主要由壳囊孢属真菌引起,壳囊孢属(Cytospora)属于子囊菌门(Asco-mycota)、粪壳菌纲(Sordariomycetes)、间座壳目(Diaporthales)、黑腐皮壳科(Valsaceae)。将病原菌命名为ValsamaliMiyabeet[11]。臧睿和桂腾茸等[12-13]的研究已明确我国的苹果树腐烂病菌是由V.maliMiyabeetYamada、V.malicolaZ.Urb、V.persoonii(=Leucostompersoonii)和V.ceratosperma4个种类组成。其中V.mali种下又可以划分为Valsamalivar.Mali(Vmm)和Valsamalivar.Pyri(Vmp)2个不同的变种,并明确Vmm为我国苹果树腐烂病中最主要的致病菌;杜琴等[14]的研究鉴定出新疆林木腐烂病菌主要为V.malicola、V.sordida、V.ceratosperma;刘应敏等[15]已对新疆苹果树腐烂病菌的Cytosporaschulzeri(有性型V.malicola)进行具体研究。【本研究切入点】目前相关研究多集中于如何提高果品果质及经济效益,且该地区的苹果树腐烂病菌种类还尚未明确。需研究苹果树腐烂病菌的种类及其亲缘关系。【拟解决的关键问题】以阿克苏地区不同区域苹果树腐烂病病样为材料,采用常规组织分离法和枝条烫伤接种法分离和鉴定菌株,记录形态学特征和发病情况,研究阿克苏地区苹果树腐烂病病菌种类、培养形状、致病性等,为病害的诊断及抗病品种筛选提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 发病枝条与树皮
随机采集从阿克苏地区红旗坡农场(N41°15′23″E 81°17′54″)和新疆生产建设兵团农一师5团7连(N41°22′26″E 80°45′19″)苹果园6份发病枝条和树皮(含有健康组织),放置于牛皮纸袋备用。表1

表1 样品采集信息
培养基:马铃薯葡萄糖琼脂培养基[16](PDA):马铃薯200 g、葡萄糖20 g、琼脂条20 g、蒸馏水1 000 mL;马铃薯葡萄糖水培养液(PD培养液):马铃薯200 g、葡萄糖20 g、蒸馏水 1 000 mL。
接种枝条:从塔里木大学校园内采集1~2年生健康苹果树枝条。
1.1.2 仪器
中科美菱超低温冷冻储存箱、SW-CJ-2FD超净工作台、DHG-9240(A)数显鼓风干燥箱、THZ-C气浴恒温振荡器、MLS-3750桌上型蒸汽灭菌锅、GXZ-436B智能光照恒温培养箱、AL204电子分析天平、D8023CTL-K4微波炉、Power Basic基础型电泳仪电源、Chemi Dos XRS荧光和化学放光成像分析系统、nexus GSX1基因扩增仪、Mastercycler pros梯度PCR仪C1000、HH-S4数显恒温水浴锅、ML203电子天平、Heraeus Pico21小型离心机、Multifuge XIR高速冷冻离心机。
1.2 方 法
1.2.1 病原菌分离、培养及保存
病原菌分离采用常规组织分离法[15],用无菌手术刀片在枝条及树皮刮取5×5(mm)含有典型腐烂病病征的组织块,然后用75%的乙醇消毒30s,0.1%升汞消毒30s,无菌水反复浸洗3次,将组织块置于无菌滤纸晾干后移至准备好的PDA平板上(每个平板放3~5块组织块)。于25℃恒温光暗交替培养3 d,待长出菌落后,纯培养,获得纯化菌株。接种于PDA斜面试管中,置于4℃冰箱保存备用。
1.2.2 培养性状观察
将接种纯化菌株的PDA平板置于25℃培养箱中暗培养。从第2 d开始每天定点观察菌落的颜色、形状、菌丝生长量、及菌丝气生情况,记录产孢体的形成时间、大小、数目及分布,采用十字交叉法测量菌落生长速度。
1.2.3 致病性测定
参考臧睿等[17]的接种方法加以改动。在塔里木大学校园内选取1~2年生健康的苹果枝条,截成15~20 cm的小段,自来水冲洗干净后用75%的乙醇浸泡10 min,用无菌水冲洗。将枝条表皮用烧热的打孔器(直径5 mm)间隔一定距离烫伤。从已在PDA平板上生长3 d的各分离株菌落边缘打取直径5 mm的菌饼,将带有菌丝的一面贴在烫伤处并将枝条放置在装有少量无菌水的锥形瓶中。每个锥形瓶中3根枝条,每根枝条上2个接种点,每个菌株3个重复,以无菌PDA饼作为对照。将锥形瓶置25℃恒温培养箱中光暗交替培养,于第5、10和15 d观察记录发病情况,采用十字交叉法测量病斑扩展速度。
1.2.4 菌株DNA提取
1.2.4.1 药品及试剂
(1)PD培养液:马铃薯200 g,葡萄糖20 g,水1 000 mL,制作方法同PDA培养基,高压灭菌后室温保存。
(2)0.5 mol/L EDTA(乙二胺四乙酸,pH 8.0):将18.61 g Na2EDTA·2H2O溶于70 mL ddH2O,滴加10 mol/L NaOH溶液调节pH值至8.0,用ddH2O定容至100 mL,高压灭菌后室温保存。
(3)2.0 mol/L Tris-HCl(pH 8.0):将24.20 g Trisbase溶于80 L ddH2O,滴加浓盐酸调节pH值至8.0,用ddH2O定容至100 mL,高压灭菌后室温保存。
(4)2%(w/v)CTAB提取缓冲液(十六烷基三甲基溴化铵):将2 g CTAB溶于50 mL ddH2O,分别加入5 mL 2.0 mol/L Tris-HCl、4 mL 0.5 mol/L EDTA、28 mL 5.0 mol/L NaCl溶液,然后定容至100 mL,封装后高压灭菌。
(5)TE缓冲液(pH 8.0):0.5 mL 2.0 mol/L Tris-HCl(pH 8.0),0.2 mL 0.5 mol/L EDTA(pH 8.0),定容至100 mL,封装后高压灭菌。
(6)1.4 mol/L NaAc(醋酸钠):将11.48 g NaAc溶解于80 mL ddH2O,然后定容至100 mL,封装后高压灭菌。
(7)5.0 mol/L NaCl溶液:将29.22 g NaCl溶于90 mL ddH2O,全部溶解后定容至100 mL。
(8)苯酚:氯仿:异戊醇(V/V/V=25∶24∶1)溶液:将50 mL苯酚、48 mL氯仿、2 mL异戊醇相溶,棕色玻璃瓶避光保存。
(9)氯仿:异戊醇(V/V=24∶1)溶液:将96 mL氯仿、4 mL异戊醇相溶,棕色玻璃瓶避光保存。
1.2.4.2 菌丝提取
将分离的菌株接种在PDA平板上,在25℃光照培养箱内培养3 d后,用直径5 mm的打孔器打取菌饼转接到含有100 mL PD培养液的锥形瓶中,置于25℃恒温摇床160 r/min震荡培养5 d。之后用4层灭菌纱布过滤菌丝体,再用无菌水冲洗3遍,用灭菌的吸水纸吸出多余水分,并用烘干箱烘干,将烘干的菌丝转移到离心管,置于-80℃超低温冰箱中保存备用。
1.2.4.3 菌株基因组DNA提取
参考唐俊煜等[18]采用改良的CTAB法提取腐烂病菌株基因组总DNA。将CTAB缓冲液放置于65℃水浴锅预热1 h,将异戊醇和NaAc置于-20℃的冰箱内预冷。将菌丝体放入研钵中,加入液氮将菌丝体快速研磨成粉,转移至离心管内。将预热完成的CTAB缓冲液加入到离心管中并充分震荡摇匀,置于65℃水浴40~60 min,期间轻摇3~4次;加入等体积的苯酚:氯仿:异戊醇(25∶24∶1),震荡摇匀10 min,4℃、8 000 r/min离心10 min,取上清液;加入等量氯仿:异戊醇(24∶1),震荡摇匀10 min,4℃、13 000 r/min离心5 min,取上清液;加入1/10体积的1.4 mol/L NaAc和等体积的异丙醇,将离心管置于-20℃冰箱中沉淀2 h;沉淀完成后4℃、13 000 r/min离心5 min,取沉淀,用75%的乙醇洗涤2~3次,加入适量的TE缓冲液溶解沉淀。1%琼脂糖凝胶电泳检测后置于-20℃冰箱保存备用。
1.2.4.4 基因片段的PCR扩增
选取β-tubulin和EF-1α2个基因片段进行PCR扩增,β-tubulin基因的扩增选用通用引物Bt2a(5′-GGTAACCAAATCGGTGCTGCTTTC-3′)和Bt2b(5′-ACCCTCAGTGTAGTGACCCTTGGC-3′),EF-1α基因的扩增选用引物EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和EF-986R(5′-TACTTGAAGGAACCCTTACC-3′)。2种基因片段的PCR反应体系和扩增程序参照唐俊煜[18]的方法进行:β-tubulin 基因PCR扩增程序为:94℃预变性3 min,94℃变性30 s,61℃退火30 s,72℃延伸1 min,共38个循环,72℃延伸10 min,终止反应;EF-1α基因PCR扩增程序为:94℃预变性4 min,94℃变性30 s,55℃退火45 s,72℃延伸30 s,共40个循环,72℃延伸10 min,终止反应。将扩增出的PCR产物送至上海生工科技股份有限公司测序。
1.3 数据处理
获得β-tubulin和EF-1α序列后,在GenBank(https://www.ncbi.nlm.nih.gov/)网站上BLAST进行同源性对比及分析,并下载同源序列。利用MEGA7.0软件,采用邻接法[19](Neighbor-Joining,NJ)建立系统发育树。
2 结果与分析
2.1 PDA培养3 d菌落形态差异
研究表明,从病样的典型病斑处经过分离、纯化出11个真菌菌株。根据培养3 d时的菌落颜色可分为淡黄色和乳白色两类菌株,其中淡黄色菌株有7个,分别为:HQP2-1、HQP2-2、HQP2-3、HQP2-4、YLC3-1、YLC3-2,占63.64%;乳白色菌株有4个,分别为:HQP3-1、YLC1-1、YLC1-2、YLC2-1,占36.36%。图1

图1 PDA培养3 d时的菌落形态
2.2 两类菌株培养性状比较
2.2.1 培养性状
研究表明,15 d时的菌落颜色主要以黄褐色为主;各菌落平均生长速度为20 mm/d,且2 d时的菌落直径存在一定的差异淡黄色菌落平均生长速率高于乳白色菌株;淡黄色菌落为放射状,乳白色菌落为羽毛状,且均未产生气生菌丝。在阿克苏地区以无气生菌丝的苹果树腐烂病菌为主要种。表2

表2 两类菌株培养性状
2.2.2 致病性关系比较
研究表明,分离出的11株菌株均可使健康苹果枝条发病,在接种3 d后开始出现明显的水渍状病斑,发病部位皱缩且内陷,与健康部位交界处有明显的界限。在接种15 d后病斑蔓延至整根枝条,表皮下的组织全部呈褐色,且有酒糟味。乳白色菌株接种的枝条上出现明显的黑色点状物,淡黄色菌株接种的枝条均未产生黑色点状物,2种类型的菌株致病性存在一定的差异。从各个发病枝条上再分离得到与原来相同的菌株。其中只有2株产生黑色点状物,占18.18%,说明不产生黑色点状物的菌株为优势种。图2

图2 致病性
2.3 菌株的分子生物学鉴定
2.3.1 β-tubulin序列
研究表明,HQP2-1、HQP2-2、HQP2-3、HQP2-4和V.ceratosperma(KC840674.1)及其无性型C.sacculus(KP195740.1、KP195741.1)聚为一枝,相似度为100%,以上4个菌株均为V.ceratosperma亲缘关系很近的生理小种。YLC3-1,YLC1-1、YLC1-2和YLC2-1分别与登录号为KT934370.1、KT934367.1的V.mali聚为一枝,相似度分别为93%和87%,这4个菌株均为与V.mali具有一定遗传分化的小种。图3
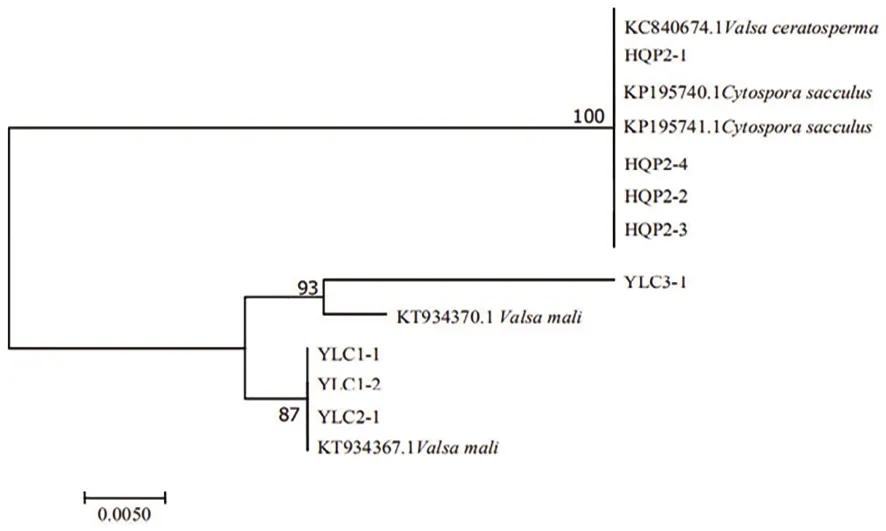
图3 β-tubulin序列构建的系统发育树(NJ)
2.3.2 EF-1α序列
研究表明,HQP3-1,YLC1-1、YLC1-2、YLC3-1、YLC3-2,HQP2-1、HQP2-2、HQP2-3、HQP2-4与V.mali及其无性型C.mali不同登录号聚为一枝,相似度分别为100%、99%、95%,以上9个菌株均为与V.mali亲缘关系较近或具有一定遗传分化的小种。图4
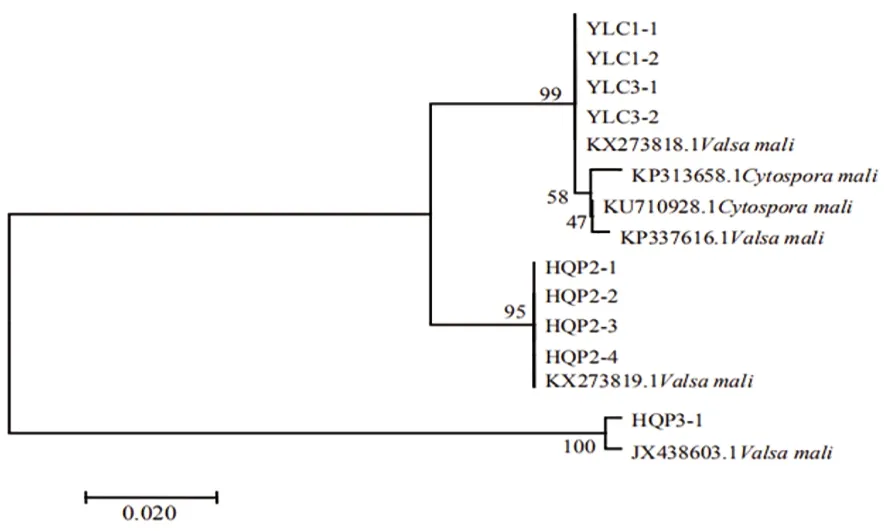
图4 EF-1α序列构建的系统发育树(NJ)
2.3.3 病原鉴定结果
研究表明,共鉴定出10个菌株,4个乳白色菌株和2个淡黄色菌株鉴定结果为V.mali,占60%,说明V.mali在PDA上的培养性状具有不同类型,且以乳白色类型为主;其余4个淡黄色菌株鉴定结果为V.ceratosperma,占40%。表3
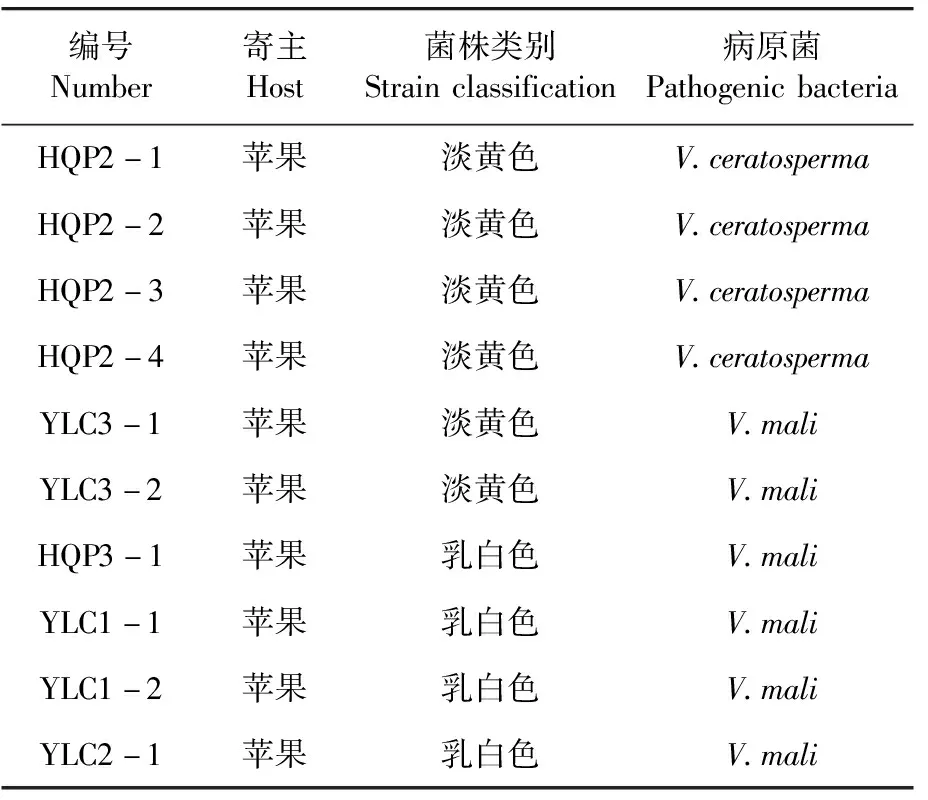
表3 苹果树腐烂病菌鉴定
3 讨 论
根据菌株类型及在PDA上培养性状发现,研究与郭开发[20]对V.mali和V.ceratosperma的研究结果一致,但是壳囊孢属Cytospora种类较多,分布范围广,种间的形态特征和培养性状具有很高的相似性,仅依靠传统形态学准确鉴定十分困难。因此,研究结合β-tubulin、EF-1α序列分析对病原菌进行鉴定。但2种分析方法在结果上也存在一定的差异,仅通过β-tubulin或EF-1α一种序列分析无法鉴定病原菌到具体的种类,每种序列片段分析存在一定的局限性,在研究系统发育时需要采用多基因序列分析法,才能使结果的准确性得到提高。
鉴定得各菌株为V.mali或V.ceratosperma,且V.mali为天山南簏苹果树腐烂病主要致病种,这与臧睿[17]和桂腾茸[13]等的研究结果一致。杜琴[14]和郭开发[20]均在新疆苹果树上分离得到V.malicola,且刘应敏等[15]证实V.malicola的无性型C.schulzeri可使新疆苹果树发病。研究并未分离出V.malicola,其余结果与杜琴及郭开发等研究结果一致。V.malicola在杜琴和郭开发分离出的菌株中占比未达1%,该菌在新疆的分布少,由于采集地点不同和研究样品数量较少导致研究未能分离得V.malicola。
4 结 论
淡黄色菌株为V.mali或V.ceratosperma,乳白色菌株为V.mali。故天山南簏苹果树腐烂病菌为黑腐皮壳属V.mali(无性型C.mali)和V.ceratosperma(无性型C.sacculus),其中V.mali为天山南簏的主要致病种,在PDA上存在不同类型的培养性状。

