参苓白术散对溃疡性结肠炎大鼠Th17/Treg免疫平衡的影响※
齐云菲,牛明了,张龙江
(1.河南中医药大学第二附属医院,河南 郑州 450002;2.河南省中医院,河南 郑州 450002)
溃疡性结肠炎(ulcerative colitis,UC)属于炎症性疾病中的一种,又称为非特异性溃疡性结肠炎。UC病变以结肠黏膜层溃疡为主,可累及整个结肠,病变主要为结肠与直肠黏膜及下层弥漫性、连续性、非特异性炎症[1]。近年来,随着人们生活习惯与饮食结构的改变,全球UC发病率呈逐渐升高趋势[2]。UC病程漫长,常迁延难愈,甚至可发生癌变,严重降低患者的生活质量[3]。目前,UC发病机制尚未完全阐明,临床治疗以糖皮质激素、免疫抑制剂、水杨酸类药物及抗生素为主,虽可缓解相关症状,但长期使用存在严重的不良反应,患者依存性差,且停药后易复发。中医治疗疾病重视辨证论治,标本兼治,不仅疗效良好,且不良反应少。参苓白术散常用于治疗脾胃气虚、湿阻气滞证,是临床治疗UC的常用方剂,疗效确切[4]。实验研究表明,参苓白术散可改善UC模型大鼠的症状、体征,调节血清炎症因子表达,减轻UC肠黏膜损伤[5]。本研究通过建立UC大鼠模型,观察参苓白术散对UC大鼠血清白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、Th17和Treg细胞水平及相关转录因子表达的影响,以探讨参苓白术散改善UC的作用机制。
1 实验材料
1.1 动物 选择SPF级SD大鼠60只,体质量160~180 g,由河南省实验动物中心提供,动物生产合格证:SYXK(豫)2018-0014。本研究经河南中医药大学实验动物伦理委员会批准(审批号:DWLL2018030032)。
1.2 药品与试剂 中药由河南中医药大学第二附属医院中药房提供,参苓白术散处方:麸炒白术、山药、茯苓、白参各15 g,白扁豆12 g,莲子肉、麸炒薏苡仁各10 g,炙甘草9 g,砂仁(后下)、桔梗各6 g。美沙拉嗪(牡丹江恒远药业股份有限公司),水合氯醛(天津市科密欧化学试剂有限公司),5%三硝基苯磺酸(TNBS,Sigma公司),IL-6酶联免疫吸附试验试剂盒(武汉伊莱瑞特生物科技股份有限公司),IL-10酶联免疫吸附试验试剂盒(武汉基因美生物科技有限公司),RIPA裂解液(上海碧云天生物技术有限公司),增强型化学发光剂(ECL)Prime蛋白印迹试剂(赛默飞世尔科技有限公司),RORγt抗体(北京博奥森生物技术有限公司),β-肌动蛋白(β-actin)抗体、HRP-羊抗大鼠二抗、FoxP3抗体(武汉爱博泰克生物科技有限公司)。
1.3 仪器 TGL-16C型高速离心机(上海安亭科学仪器厂),全自动酶标仪(美国Bio-Tek公司),CytoFLEX流式细胞仪(美国Beckman公司),AE160型精密天平秤(Mettler公司),蛋白印迹电泳系统(北京六一仪器厂)。
2 实验方法
2.1 药物制备 将参苓白术散先浸泡30 min,再加水煎煮2次,合并2次药液,并浓缩至含生药2.26 g/m L。
2.2 分组与造模 将60只SPF级SD大鼠适应性喂养1周后随机分为空白组、模型组、参苓白术散低剂量组、参苓白术散中剂量组、参苓白术散高剂量组和沙美拉嗪组,每组10只。除空白组外,其余5组大鼠均采用TNBS-乙醇灌肠法造模。大鼠造模前禁食不禁水24 h,以300 mg/kg水合氯醛进行腹腔注射麻醉,然后用2 mm的硅胶管插入大鼠肛门约5 cm处,缓慢注入5%TNBS+50%乙醇,剂量为0.02 m L/kg,灌注结束后,轻柔大鼠腹部并提起尾巴,使其头部朝下10 min,待其清醒后正常喂养,若动物出现黏液脓血便、腹泻,则造模成功。空白组大鼠除5%TNBS替换为0.9%氯化钠注射液外,其余操作与造模大鼠相同。
2.3 给药 根据动物体表系数换算法得出大鼠参苓白术散用量为22.6 g/kg。参苓白术散低、中、高剂量组分别给予11.3、22.6、45.2 g/kg参苓白术散水煎液灌胃,美沙拉嗪组给予0.4 g/kg美沙拉嗪灌胃,空白组与模型组分别给予与美沙拉嗪组等体积0.9%氯化钠注射液灌胃,连续给药14 d。
2.4 取材 大鼠给药14 d后禁食12 h,用300 mg/kg水合氯醛进行腹腔注射麻醉,腹主动脉取血,离心、收集血清,置于-80℃冰箱冻存。另取结肠组织,用0.9%氯化钠注射液冲洗后置于-80℃冰箱冻存。
2.5 实验指标 ①疾病活动指数(DAI):主要观察大鼠体质量、粪便性状及直肠出血情况。评分标准:体质量下降率<1%计0分,下降率1%~5%计1分,下降率6%~10%计2分,下降率>10%计3分;粪便颗粒与硬度适中计0分,粪便颗粒成形、较软、不黏附肛门计1分,粪便颗粒柔软且黏附肛门计2分,粪便不成形、黏附肛门、腹泻计3分;粪便无异常计0分,粪便有暗红色斑点计1分,粪便有暗红色斑点、肛门可见出血计3分,粪便深红色、肛门周围有血液黏附计3分。DAI评分=(体质量下降率评分+粪便评分+大便潜血评分)/3,于给药第7、14日进行评定。②血清IL-6、IL-10水平:采用酶联免疫吸附试验法测定。③大鼠外周血Th17、Treg细胞水平及Th17/Treg值:给药14 d后取大鼠尾静脉血,用机械法获取单个核细胞悬液,加入细胞分离液,2 000 r/min离心20 min,去掉中间单个核细胞,计数并稀释到所需浓度,分别加入相应抗体,用流式细胞仪检测。④结肠组织RORγt、FoxP3表达:提取结肠组织总蛋白,分装,-20℃保存,根据标准蛋白浓度和相应的OD值计算直线回归方程,求出样品蛋白浓度。制胶、电泳、转膜,用含5%脱脂奶粉的缓冲液室温摇床封闭2 h,加入一抗(RORγt或FoxP3抗体),4℃孵育过夜,清洗后加入二抗(HRP-羊抗大鼠抗体),37℃摇床孵育2 h,清洗多余二抗,ECL显色,用BandScan软件分析胶片灰度值。
2.6 统计学方法 采用SPSS 25.0统计软件分析数据,计量资料符合正态分布时以均数±标准差(±s)表示,多组间数据使用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 DAI评分比较 药7 d后,参苓白术散中、高剂量组及美沙拉嗪组DAI评分均低于模型组(P<0.05),参苓白术散高剂量组与美沙拉嗪组比较无显著差异(P>0.05)。给药14 d后,参苓白术散各组及美沙拉嗪组DAI评分均低于模型组(P<0.05),且参苓白术散高剂量组高于美沙拉嗪组(P<0.05)。见表1。
表1 6组大鼠不同治疗时间疾病活动指数评分比较(分,±s)
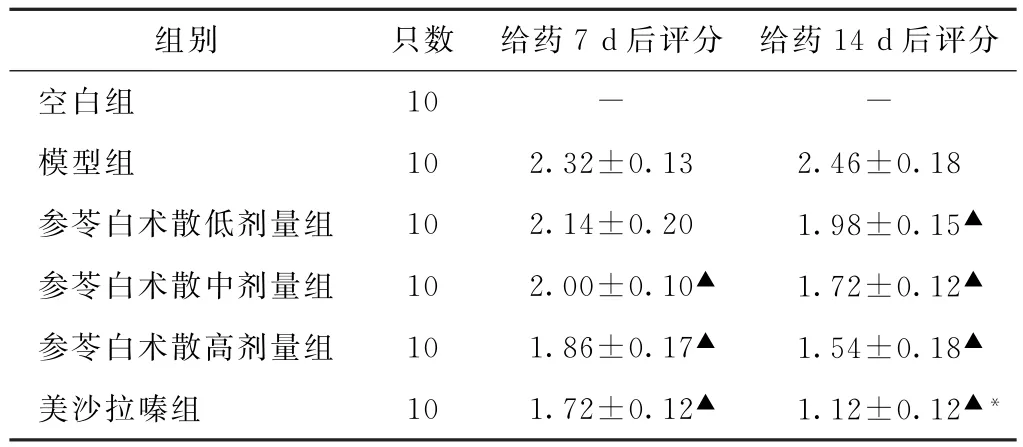
表1 6组大鼠不同治疗时间疾病活动指数评分比较(分,±s)
注:与模型组同期比较,▲P<0.05;与参苓白术散高剂量组同期比较,*P<0.05。
组别 只数 给药7 d后评分 给药14 d后评分空白组 10 - -模型组 10 2.32±0.13 2.46±0.18参苓白术散低剂量组 10 2.14±0.20 1.98±0.15▲参苓白术散中剂量组 10 2.00±0.10▲ 1.72±0.12▲参苓白术散高剂量组 10 1.86±0.17▲ 1.54±0.18▲美沙拉嗪组 10 1.72±0.12▲ 1.12±0.12▲*
3.2 血清IL-6、IL-10水平比较 给药14 d后,模型组血清IL-6水平高于空白组(P<0.05),参苓白术散各组及美沙拉嗪组均低于模型组(P<0.05),参苓白术散中、高剂量组高于美沙拉嗪组(P<0.05);模型组IL-10水平低于空白组(P<0.05),参苓白术散中、高剂量组及美沙拉嗪组均高于模型组(P<0.05),参苓白术散中、高剂量组与美沙拉嗪组比较无显著差异(P<0.05)。见表2。
表2 6组大鼠给药14 d后血清白细胞介素-6、白细胞介素-10水平比较(ng/g,±s)

表2 6组大鼠给药14 d后血清白细胞介素-6、白细胞介素-10水平比较(ng/g,±s)
注:与空白组比较,△P<0.05;与模型组比较,▲P<0.05;与参苓白术散高剂量组比较,*P<0.05。
组别 只数 白细胞介素-6 白细胞介素-10空白组 10 46.23±7.01 12.95±1.30模型组 10 260.31±7.01△ 7.75±0.16△参苓白术散低剂量组 10 195.04±5.17▲ 8.58±0.81参苓白术散中剂量组 10 144.80±7.44▲ 9.70±0.34▲参苓白术散高剂量组 10 113.13±5.33▲ 10.96±0.57▲美沙拉嗪组 10 88.06±2.36▲*12.03±0.74▲
3.3 外周血Th17、Treg细胞水平及Th17/Treg值比较 给药14 d后,模型组外周血Th17细胞水平及Th17/Treg值均高于空白组(P<0.05),参苓白术散各组及美沙拉嗪组均低于模型组(P<0.05),参苓白术散中、高剂量组高于美沙拉嗪组(P<0.05);模型组Treg细胞水平低于空白组(P<0.05),参苓白术散各组及美沙拉嗪组高于模型组(P<0.05),参苓白术散高剂量组高于美沙拉嗪组(P<0.05)。见表3。
表3 6组大鼠给药14 d后外周血Th17、Treg细胞水平及Th17/Treg值比较(±s)
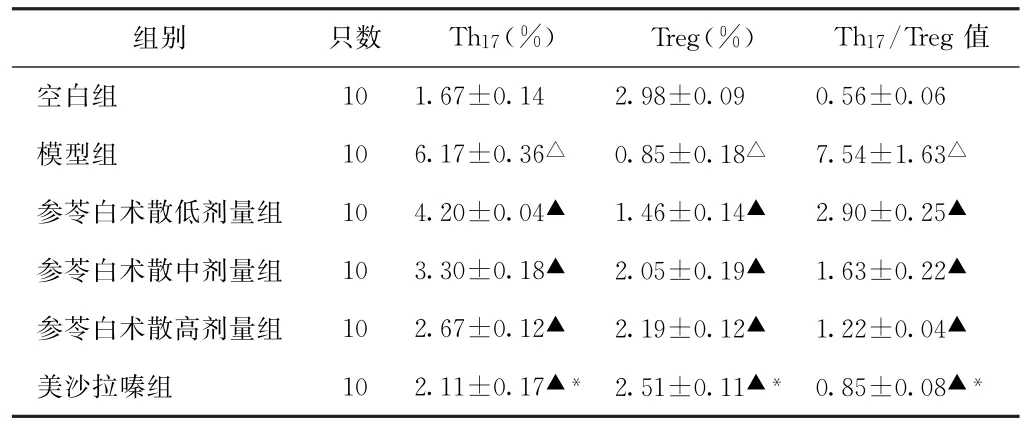
表3 6组大鼠给药14 d后外周血Th17、Treg细胞水平及Th17/Treg值比较(±s)
注:与空白组比较,△P<0.05;与模型组比较,▲P<0.05;与参苓白术散高剂量组比较,*P<0.05。
组别 只数 Th17(%) Treg(%) Th17/Treg值空白组 10 1.67±0.14 2.98±0.09 0.56±0.06模型组 10 6.17±0.36△ 0.85±0.18△ 7.54±1.63△参苓白术散低剂量组 10 4.20±0.04▲ 1.46±0.14▲ 2.90±0.25▲参苓白术散中剂量组 10 3.30±0.18▲ 2.05±0.19▲ 1.63±0.22▲参苓白术散高剂量组 10 2.67±0.12▲ 2.19±0.12▲ 1.22±0.04▲美沙拉嗪组 10 2.11±0.17▲*2.51±0.11▲*0.85±0.08▲*
3.4 结肠组织RORγt、Fox P3表达水平比较 给药14 d后,模型组结肠组织RORγt表达水平高于空白组(P<0.05),参苓白术散中、高剂量组和美沙拉嗪组均低于模型组(P<0.05),参苓白术散高剂量组高于美沙拉嗪组(P<0.05);模型组结肠组织FoxP3表达水平低于空白组(P<0.05),参苓白术散各组和美沙拉嗪组高于模型组(P<0.05),但组间比较无显著差异(P>0.05)。见表4、图1(图1见标题处二维码)。
表4 6组大鼠给药14 d后结肠组织RORγt、FoxP3蛋白表达水平比较(±s)
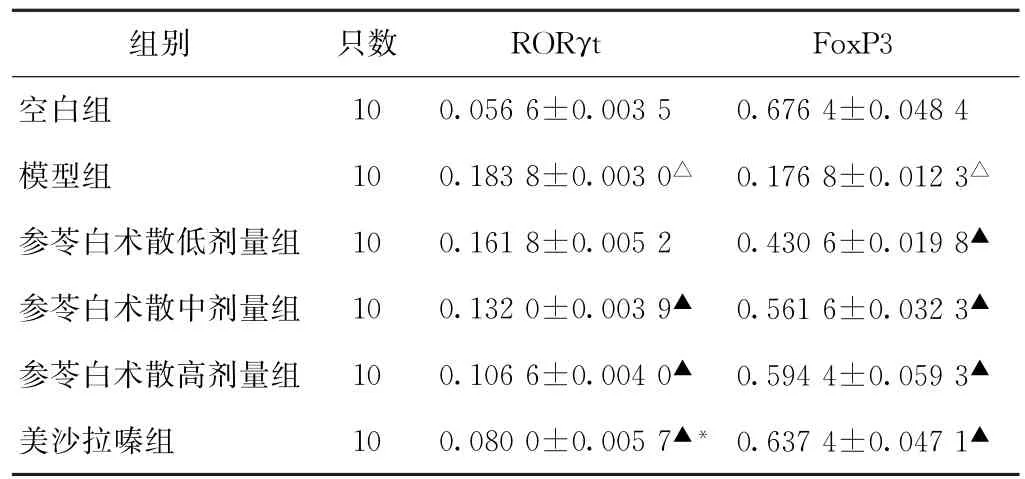
表4 6组大鼠给药14 d后结肠组织RORγt、FoxP3蛋白表达水平比较(±s)
注:与空白组比较,△P<0.05;与模型组比较,▲P<0.05;与参苓白术散高剂量组比较,*P<0.05。
组别 只数 RORγt FoxP3空白组 10 0.056 6±0.003 5 0.676 4±0.048 4模型组 10 0.183 8±0.003 0△ 0.176 8±0.012 3△参苓白术散低剂量组 10 0.161 8±0.005 2 0.430 6±0.019 8▲参苓白术散中剂量组 10 0.132 0±0.003 9▲ 0.561 6±0.032 3▲参苓白术散高剂量组 10 0.106 6±0.004 0▲ 0.594 4±0.059 3▲美沙拉嗪组 10 0.080 0±0.005 7▲*0.637 4±0.047 1▲
4 讨论
研究显示,UC的发病机制较为复杂,通常认为与遗传、饮食、免疫等因素有关,其中免疫反应失调是UC发病的重要因素,过度的免疫活动是UC发病的最终环节。当肠道出现过度的免疫活动时,促炎细胞因子与抑炎细胞因子表达失衡,巨噬细胞释放IL-6、白细胞介素-8(IL-8)、白细胞介素-18(IL-18)等促炎细胞因子损伤消化道,破坏肠黏膜屏障,产生免疫损伤效应,导致UC发生[6]。西医治疗UC的药物包括水杨酸制剂、皮质类固醇、免疫抑制剂、生物制剂等,虽起效快,但无法根治,激素依赖及抵抗、不良反应、耐药性等难题亟待解决[7]。
UC归属于中医“痢疾”“肠癖”“久痢”等范畴,多因脾肺气虚导致气机不畅、瘀血内生而致。脾虚则运化失司,机体津液代谢障碍,形成痰湿,痰湿与瘀血互结,困于肠道,使肠络瘀阻,出现血败肉腐、肠腑溃结之证。该病属本虚标实之证,本虚为脾肺气虚,标实为湿热瘀毒蕴结肠道[8]。参苓白术散是临床治疗脾虚湿盛证的代表方剂之一,出自《太平惠民和剂局方》,具有益气健脾、祛湿止泻功效,契合UC病机[9]。本研究结果显示,参苓白术散干预后,中、高剂量组DAI评分显著降低,提示适宜剂量的参苓白术散可有效减轻UC模型大鼠的病变程度。
Th17介导炎性反应,Treg介导免疫耐受与自稳,两者功能相反,处于动态平衡,二者失衡则导致机体免疫力和抗炎能力下降,引发各种炎症性疾病[10]。研究发现,Th17/Treg失衡参与了肠道疾病的发生与发展,在炎症性肠病中,Th17/Treg值与病情程度密切相关[11]。Th17可通过介导炎性反应,促进炎症细胞因子分泌,如IL-6、肿瘤坏死因子-α(TNF-α)等,导致组织炎性浸润和组织破坏,出现肠黏膜损伤[12]。而Treg可分泌IL-10等抗炎细胞因子,具有抑制炎性反应等作用[13]。研究显示,RORγt是Th17分化的重要转录因子,而FoxP3是公认的CD4+CD25+Treg细胞特异性标志因子[14]。当IL-6等细胞因子功能亢进时,RORγt表达升高,而Fox P3表达降低,造成 Th17/Treg向Th17倾斜,使促炎作用增强[15]。李姿慧等[16]研究发现,参苓白术散可降低UC模型大鼠血清IL-6水平,控制大鼠的炎性反应,减少结肠黏膜充血、水肿及溃疡形成,改善肠黏膜损伤。本研究结果显示,与空白组相比,模型组大鼠血清IL-6水平、结肠组织RORγt表达及外周血Th17/Treg值显著升高,血清IL-10水平、FoxP3表达水平显著降低。参苓白术散干预后,大鼠血清IL-6水平、结肠组织RORγt表达水平及外周血Th17/Treg值明显下调,血清IL-10水平、结肠组织FoxP3表达水平明显上调,提示参苓白术散可能通过调节RORγt、FoxP3表达,进而纠正UC大鼠Th17/Treg失衡现象,缓解炎性反应,达到治疗UC的目的。
中医运用辨证论治,注重整体观念,对UC的治疗具有疗效确切、不良反应小等优势,但仍存在问题,如参苓白术散为复方,成分复杂,其确切的抗UC成分及作用机制还有待进一步深入研究。

