血尿素氮水平与子痫前期并发胎儿生长受限的关系及其诊断价值▲
刘 倩 梁婵玉 朱燕莉 黄晓燕 孙 波,3 赵卫华
(1 广东省深圳市第二人民医院产科,深圳市 518035,电子邮箱:2636828965@qq.com; 2 广西河池市人民医院产科,河池市 547000; 3 暨南大学附属深圳市宝安区妇幼保健院产科,广东省深圳市 518035)
胎儿生长受限(fetal growth restriction,FGR)是导致围产儿患病和死亡的重要原因之一[1]。FGR与子痫前期关系密切,二者同属“重大产科综合征”,严重者可危害母亲及胎儿健康[2]。研究表明,约15%的FGR患者出现子痫前期[3],70%的早发型FGR(≤34周)与妊娠期高血压疾病相关[4],而子痫前期患者比非子痫前期患者发生FGR的风险更高[5]。FGR的早期识别和诊断较为困难,缺乏高质量的预测指标,尤其在母体出现多种复杂合并症及并发症的情况下。血尿素氮是监测肾功能损害情况的主要血清学指标,其子痫前期的预测和辅助诊断价值已得到广泛的认可[6-7],但其对子痫前期并发FGR是否同样具有诊断价值仍未知。本研究探讨血尿素氮水平与子痫前期并发FGR的关系及其诊断价值,为FGR的预防和诊疗提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2016 年 1 月至2020年 12 月在广西壮族自治区河池市人民医院住院分娩的381例子痫前期患者的临床资料,以新生儿出生体重小于同胎龄体重第10 百分位数的167例患者为子痫前期并发FGR组(FGR组),其余214例患者为子痫前期未并发FGR组(非FGR组)。纳入标准:(1)单胎妊娠;(2)子痫前期诊断均符合第9版《妇产科学》[8]中的诊断标准;(3)诊断准确、临床资料完整且随访结果可靠者。排除标准:(1)年龄≤15岁;(2)妊娠前已患高血压;(3)妊娠合并慢性肾炎;(4)妊娠合并糖尿病;(5)妊娠合并其他严重内科疾病;(6)胎儿畸形、染色体异常者;(7)产后失访、临床资料不完整者。本研究符合2013年修订的《世界医学协会赫尔辛基宣言》要求并获得河池市人民医院伦理委员会批准。
1.2 研究方法
1.2.1 一般临床资料收集:查阅病历,收集孕妇的年龄、民族、孕产次、分娩入院时的体质指数、收缩压、舒张压、住院天数及医疗费用等资料。 将子痫前期患者分为重度子痫前期(severe preeclampsia,sPE)和轻度子痫前期。其中,子痫前期伴有以下任何一种表现则定义为sPE[8]:(1)收缩压≥160 mmHg,或舒张压≥110 mmHg;(2)血小板减少(血小板<100×109/L);(3)肝功能损害(血清转氨酶水平为正常值2 倍以上),严重持续性右上腹或上腹疼痛,不能用其他疾病解释,或二者均存在;(4)肾功能损害;(5)肺水肿;(6)新发生的中枢神经系统异常或视觉障碍。另外,按照是否在孕34周前发病[9]分为早发型子痫前期(early onset preeclampsia,eoPE)和晚发型子痫前期。
1.2.2 肾功能检测指标收集:于入院当天(药物治疗前)抽取外周静脉血3 mL,采用全自动生化检测仪(德国 Roche ELescys 2010)检测肾功能,主要包括血尿素氮、血肌酐、血尿素氮/血肌酐、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)等指标。
1.3 统计学分析 采用SPSS 23.0及EmpowerStats 2.2软件进行统计学分析。服从正态分布的计量资料以(x±s)表示,两组间比较采用成组设计两样本t检验;不服从正态分布的计量资料以中位数和四分位数间距[M(Q)]表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验,如有总样本量<40或理论频数<1,则采用Fisher确切概率法检验。影响因素分析采用多因素Logistic回归,采用受试者工作特征(receiver operator characteristic,ROC)曲线分析血尿素氮水平对子痫前期并发FGR的诊断价值。所有检验均为双侧检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 FGR组与非FGR组产妇一般临床资料的比较 两组患者的年龄、民族、体质指数、孕产次、住院天数及医疗费用比较,差异均无统计学意义(均P>0.05),但FGR组患者的收缩压、舒张压、eoPE及 sPE比例均高于非FGR组( 均P<0.05) 。见表 1。
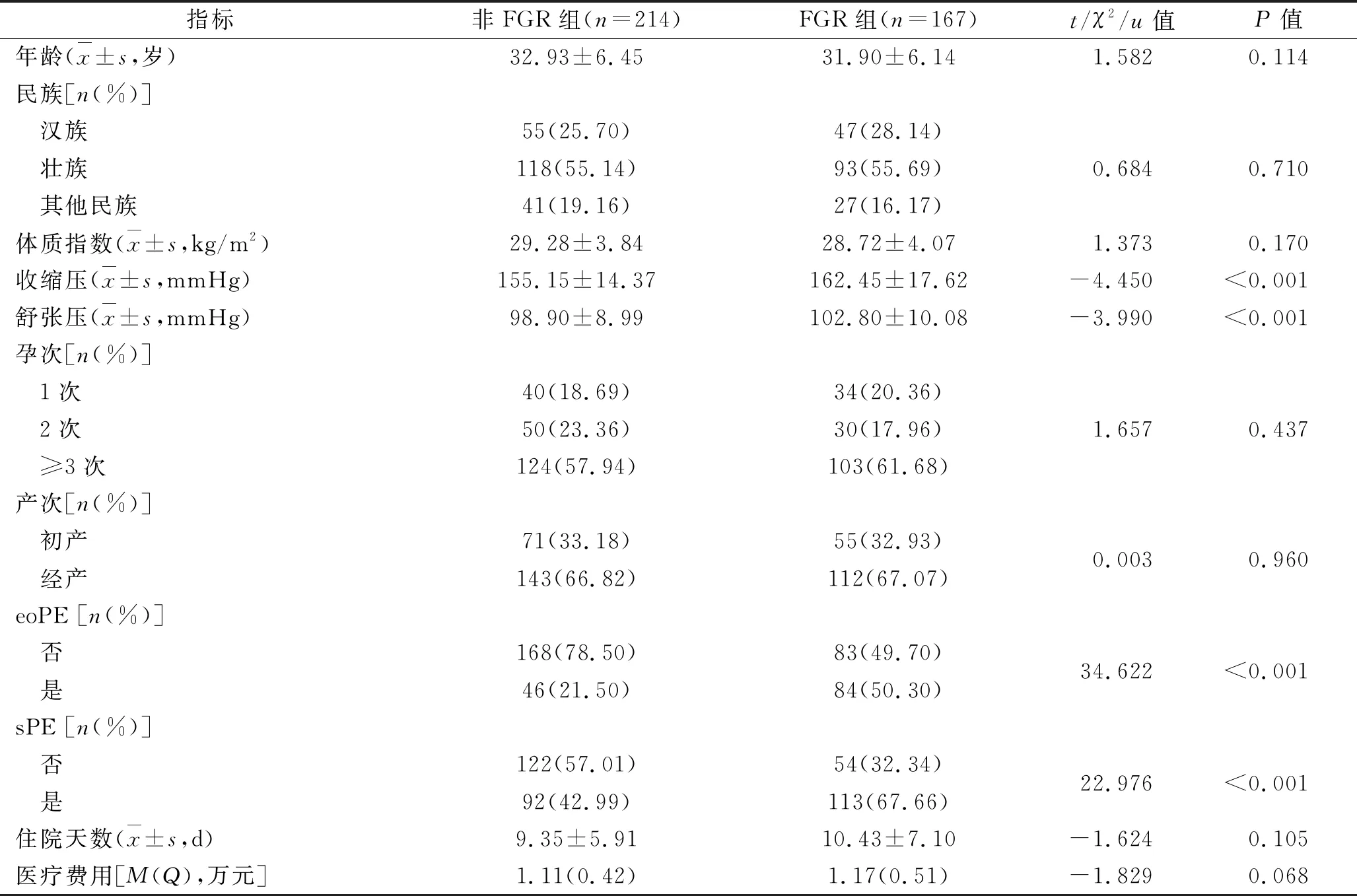
表1 两组孕妇一般临床资料的比较
2.2 两组产妇肾功能检测指标的比较 FGR组的血尿素氮、血肌酐水平均高于非FGR组,FGR组的eGFR低于非FGR组(均P<0.05) ,非FGR组与FGR组间的血尿素氮/血肌酐差异无统计学意义(P>0.05) 。见表2。

表2 两组孕妇肾功能指标的比较
2.3 子痫前期患者并发FGR的危险因素分析 以子痫前期患者是否并发FGR为因变量,以上述单因素分析中具有统计学意义的变量及临床上认为有意义的因素作为自变量,纳入多因素Logistic回归模型中进行分析,变量赋值情况见表3。结果显示,血压升高、eoPE下降、sPE下降、eGFR下降、血尿素氮水平升高及血肌酐水平升高是子痫前期患者并发FGR的危险因素(均P<0.05),见表4。

表3 变量赋值情况
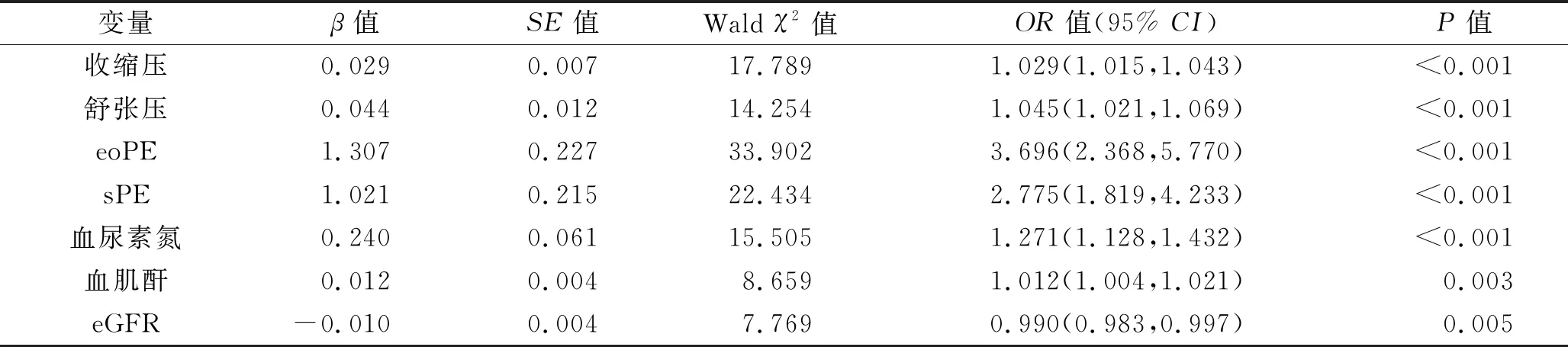
表4 影响子痫前期并发FGR的多因素Logistic回归分析
2.4 血尿素氮水平与子痫前期患者并发FGR的关系的多因素Logistic分析 有103例子痫前期患者血尿素氮处于(4.76~7.14)mmol/L之间,其中61例并发FGR。根据血尿素氮水平三等分法将患者分为G1组(≤3.44 mmol/L)125例、G2组(3.45~4.75 mmol/L)129例、G3组(≥4.76 mmol/L)127例。多因素Logistic回归分析结果显示,血尿素氮水平升高是子痫前期患者并发FGR的独立危险因素(P<0.05),校正相关混杂因素后,血尿素氮水平每增加一个单位,子痫前期患者并发FGR的风险增加0.167倍;与G1组相比,G2组并发FGR的风险增加1.469倍,G3组并发FGR的风险增加2.082倍(均P<0.05)。见表5。
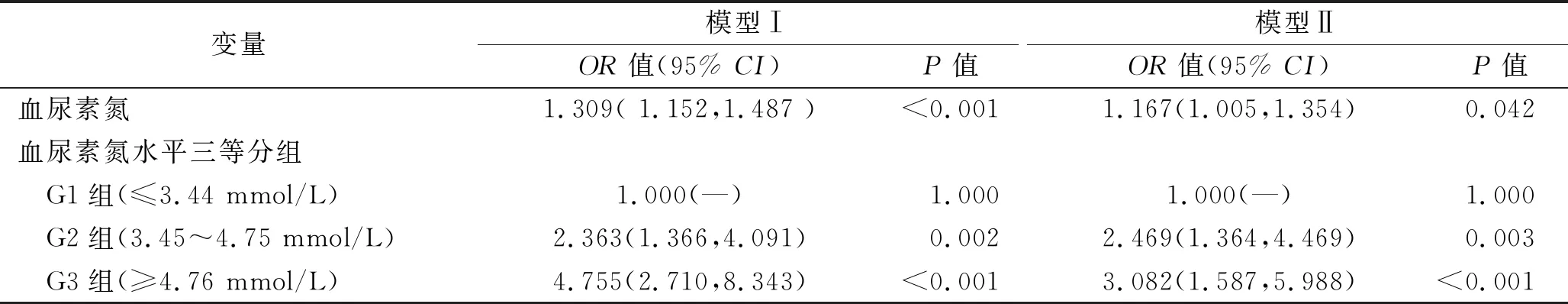
表5 血尿素氮水平与子痫前期并发FGR的关系的Logistic回归分析
2.5 血尿素氮水平对子痫前期患者并发FGR的诊断价值 ROC曲线分析结果显示,血尿素氮水平诊断年龄<35岁与年龄35~<40岁的子痫前期患者并发FGR的ROC曲线下面积分别为0.623、0.729(均P<0.05),敏感度分别为75.5%、57.5%,特异度分别为50.4%、79.6%;诊断年龄段≥40岁的子痫前期患者并发FGR的模型无统计学意义(P>0.05)。见表6和图1。
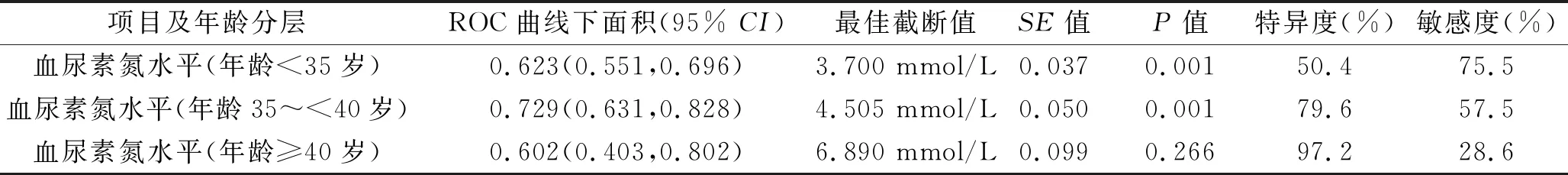
表6 血尿素氮水平对子痫前期患者并发FGR的诊断价值
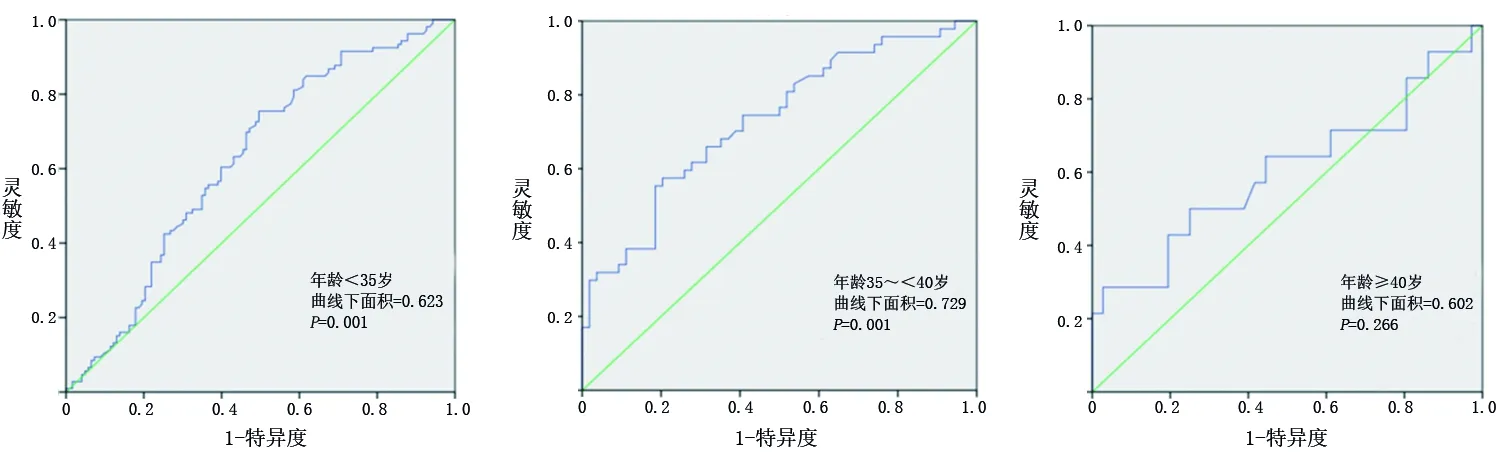
图1 血尿素氮水平诊断子痫前期并发FGR的ROC曲线
3 讨 论
FGR 最常见的病因是胎盘功能异常导致的胎盘灌注不良,在所有妊娠合并症和并发症中,诱发胎盘功能异常最常见的疾病是妊娠期高血压疾病[10-12]。子痫前期作为妊娠期高血压疾病的一种,与FGR紧密相关[4-5],两者均具有胎盘发育异常和功能异常表现。FGR缺乏精准的预测指标,既往胎儿超声检查在辅助诊断FGR的过程中占据主导地位[13]。超声不仅能够探查胎儿结构性畸形,还可以通过多普勒血流检测预测胎儿酸中毒,从而可在严重酸中毒之前进行治疗,以避免胎儿发生不可逆的器官损伤和死亡[1]。但也有学者[14]认为,不可过分夸大超声在FGR诊断中的作用,过多的监测势必导致更多的医疗干预。虽然定期超声检查对小于胎龄儿的产前FGR诊断具有较大帮助,但超声检查受孕妇腹壁脂肪层厚度、胎位、胎儿是否入盆及超声医生熟练程度等因素的影响,存在较高的假阳性[15]。在缺乏其他有效辅助诊断手段的情况下,必然会造成临床医生对超声检查的过分依赖及对FGR的过度诊断,而患者面对异常超声结果的焦虑及恐慌心理又迫使临床医生过分关注与干预,因此,应积极寻找FGR的其他预测指标和辅助诊断方法。
子痫前期患者最为突出的临床表现是进行性血压升高伴随尿蛋白阳性,可见肾脏代谢问题在其中扮演着重要角色。血尿素氮是评估肾脏功能的主要指标,可独立预测子痫前期发生的风险[7],然而目前国内尚未见相关研究探讨其在子痫前期合并FGR中的预测或诊断价值。因此,本研究以子痫前期患者为研究对象,分析子痫前期并发FGR患者的肾功能情况,探讨血尿素氮水平与子痫前期并发FGR的关系及其在子痫前期合并FGR中的诊断价值。
既往研究表明,血压升高、子痫前期发病早、病情严重,均会对子痫前期患者全身脏器功能,尤其是胎盘形成及胎盘灌注方面造成不良影响,导致胎盘功能异常,胎儿缺血缺氧,增加FGR的发病率[16]。本研究多因素Logistic回归分析结果显示,血压升高、eoPE、sPE、血尿素氮及血肌酐水平升高、eGFR下降均为子痫前期并发FGR的危险因素(均P<0.05)。进一步调整年龄、民族、 体质指数、孕次、 产次等变量后,血尿素氮水平升高仍为子痫前期并发FGR的独立危险因素(P<0.05),且血尿素氮水平每增加一个单位,子痫前期患者并发FGR的风险增加0.167倍。血尿素氮水平≥4.76 mmol/L的子痫前期患者与血尿素氮水平≤3.44 mmol/L的子痫前期患者相比,并发FGR的风险增加2.082倍(P<0.05)。本研究结果还显示,约有27.03%(103/381)的子痫前期患者血尿素氮水平处于(4.76~7.14)mmol/L之间(正常妊娠状态血尿素氮水平参考值范围为1.8~7.14 mmol/L),但其中却有59.22%(61/103)的患者发生了FGR,这表明临床医师仍应重视所有血尿素氮水平正常的子痫前期患者,警惕FGR的发生。肾脏的排泄能力决定了循环中的血尿素氮水平,子痫前期的病理生理改变是全身小动脉痉挛,肾小动脉痉挛会诱发肾小球肿胀、肾血流量减少、肾小球滤过率下降,进而导致肾脏排泄功能障碍,肾脏代谢产物清除受阻,最终表现为血尿素氮水平升高[17]。因而有学者认为血尿素氮水平可作为sPE的预测指标[7]。Luders等[18]调查了93名接受血液透析的孕妇,发现血尿素氮水平升高是胎儿低体重的独立危险因素,当血尿素氮水平≥35 mg/dL(1.94 mmol/L)时,不良妊娠(小于胎龄儿、早产、围产儿死亡)的发生率明显增加。Park等[19]对出生时低体重的儿童进行调查,发现其儿童期血尿素氮水平升高的比例较高,其可能是由于母体孕期高血压状态导致胎儿肾单位数量减少,从而诱发了儿童的永久性肾损伤。目前关于血尿素氮水平与FGR发生的关系的研究报道较少,本研究中血尿素氮水平与FGR发生的相关性是建立在子痫前期存在的基础上。血尿素氮水平升高提示肾功能受损,为子痫前期进展的标志,当子痫前期病情进展至严重状态,可引发子宫螺旋小动脉广泛痉挛、血管管腔变窄,胎盘循环血量锐减,营养物质供应受阻,从而促进FGR的发生和发展[20]。但由于我们的样本量较小,未能对子痫前期类型及严重程度作分组研究,因此,未来有待增加样本量进一步研究探讨。
有研究[21]表明,随着年龄的增加FGR的发生风险增加。本研究通过对年龄进行分层,评估了血尿素氮水平对不同年龄层子痫前期患者并发FGR的诊断价值,结果显示血尿素氮水平对年龄<35岁与35~<40岁的子痫前期患者并发FGR均具有一定的辅助诊断价值(均P<0.05),但其特异度和敏感度仍不理想,需要继续深入研究寻找更有效的辅助诊断指标或者进行联合指标检测以提高诊断效能。本研究中,血尿素氮水平对年龄≥40岁子痫前期患者并发FGR的诊断模型无统计学意义(P>0.05),可能与该组FGR病例数较少有关。
综上所述,血尿素氮水平升高是子痫前期并发FGR的独立危险因素,在子痫前期并发FGR方面有一定的辅助诊断价值。因此,临床上应加强对子痫前期患者肾功能相关指标的检测,更为积极地评估和治疗,防治FGR的发生,改善母婴预后。

