基于网络药理学探讨芍药甘草汤治疗肝癌癌痛的作用机制▲
梁 媛 吴浩源 张馨月 梁 健
(1 广西中医药大学研究生院,南宁市 530000,电子邮箱:805347258@qq.com;2 广西大学医学院,南宁市 530004)
肝癌是我国消化系统疾病中最常见的恶性肿瘤,发病率和死亡率均较高[1],且发病呈年轻化趋势。由于肿瘤压迫、致痛介质(炎性因子等)分泌、癌细胞浸润转移等原因,约有70%的中晚期肝癌患者伴有疼痛表现[2]。因此疼痛成为困扰癌症患者的主要症状之一,直接影响患者的个人生活。当前临床使用的癌痛治疗方法是世界卫生组织推荐的“三阶梯止痛法”[3],根据患者的疼痛程度,给予不同强度的阿片或非阿片类止痛药以提高患者的生存质量。然而,采用该原则进行治疗会导致溃疡、尿潴留,甚至耐药、成瘾等不良反应。近年来,中医药逐渐成为临床治疗癌痛的辅助手段,有研究证实中医药与止痛药的结合使用,可以提高止痛药的疗效并减轻副作用[4]。有学者探讨了芍药甘草汤治疗肝癌晚期疼痛的效果[5],但没有进一步分析其作用机制。本文采用网络药理学方法分析芍药甘草汤方药的有效活性成分和作用靶点,初步探讨芍药甘草汤治疗肝癌癌痛的作用机制。
1 材料与方法
1.1 芍药甘草汤药物活性成分和相关靶点的筛选 利用中药系统药理学数据库与分析平台(https://tcmsp-e.com/)收集芍药甘草汤中白芍、甘草的化学成分[6]。以口服生物利用度≥30%、药物相似性≥0.18为阈值设置ADME属性,获取药物相关活性成分。再利用该平台获取活性成分作用的蛋白质靶点信息;筛选完成后合并、去重,然后使用UniProt蛋白数据库(https://www.uniprot.org)对收集到的靶点进行统一规范,以方便后续的研究。
1.2 肝癌癌痛相关靶点的筛选 以“liver cancer” “hepatocellular carcinoma”和“cancer pain”作为关键词,搜索GeneCards数据库(https://www.genecards.org)、OMIM数据库(https://www.omim.org)、DrugBank数据库(https://go.drugbank.com)中与肝癌、癌痛相关的靶点。在GeneCards数据库中输入关键词后分别以Score≥19.66、Score≥9.485和Score≥13.985为筛选条件,找到相对应的肝癌、癌痛靶点。
1.3 芍药甘草汤活性成分-肝癌癌痛靶点的可视化网络的构建 利用网络在线工具Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/),针对芍药甘草汤活性成分的作用靶点与肝癌、癌痛的靶点绘制韦恩图,所得的交集靶点即为芍药甘草汤作用于肝癌癌痛的靶点。利用Cytoscape 3.7.1对前期收集到的关于药物成分和交集靶点的数据进行可视化处理,构建“药物活性成分-肝癌癌痛靶点”网络,选择软件自带工具中的“Analyze Network”进行网络拓扑分析。
1.4 蛋白互作网络图的构建及关键靶点的获取 将交集靶点导入STRING 11.0数据库(https://string-db.org)构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络模型,选择生物种类为“Home sapiens”,相互作用值设为“highest confidence”(>0.9),其余设置均不改变,得到PPI图。通过Cytoscape 3.7.1软件中的插件cytoHubba对PPI网络进行分析、筛选,获得关键靶点。
1.5 基因本体论功能富集分析、京都基因和基因组百科全书通路富集分析 将芍药甘草汤治疗肝癌癌痛的相关靶点导入Metascape数据平台(https://metascape.org/gp/index.html),设置P<0.01,进行基因本体论(Gene Ontology,GO)功能富集分析及京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,选排前20位的条目进行可视化分析。
2 结 果
2.1 芍药甘草汤药物活性成分和相关作用靶点 共获得白芍化学成分85种、甘草化学成分280种。筛选后得到白芍活性成分13种及其作用靶点123个;甘草活性成分92种及其作用靶点1 769个。经过合并去重,最终获得芍药甘草汤活性成分作用的靶点231个,对应活性成分共93种,其中白芍5种,甘草85种,共有成分3种。
2.2 肝癌癌痛靶点 在GeneCards数据库中根据关键词“liver cancer”“hepatocellular carcinoma”分别获得肝癌相关靶点1 033个、927个,合并删除重复值,最终获得肝癌相关靶点1 339个;根据关键词“cancer pain”获得癌痛相关靶点1 476个。使用同样的关键词结合检索策略,在OMIM与DrugBank数据库中进行相关靶点的筛选,将3个数据库的筛选结果合并后去重,最终获取肝癌相关靶点1 498个,癌痛相关靶点1 873个。
2.3 芍药甘草汤活性成分-肝癌-癌痛靶点的可视化网络 将筛选出的药物有效成分靶点与肝癌、癌痛靶点取交集,绘制韦恩图,获得交集靶点125个,芍药甘草汤作用于肝癌癌痛靶基因的映射率为5.1%,见图1。交集靶点对应芍药甘草汤中的90个化学成分,其中甘草83种,白芍4种,甘草和白芍共有成分3种,见表1。使用Cytoscape 3.7.1软件对药物活性成分和交集靶点数据进行处理,构建相关网络图,结果显示网络中共有节点216个,边1 175条,见图2。拓扑分析结果显示,按度值大小排序,度值最高的药物活性成分为槲皮素(度值为99,介度为0.188 776,紧密度为0.582 66),其次为山柰酚(度值为34,介度为0.034 042,紧密度为0.439 67)、柚皮素(度值为24,介度为0.020 178,紧密度为0.417 48),推测槲皮素、山柰酚和柚皮素为芍药甘草汤治疗肝癌癌痛的主要成分,见表2。

图1 芍药甘草汤活性成分-肝癌-癌痛的共有靶点

表1 芍药甘草汤干预肝癌癌痛的活性成分及其对应药物

续表1

图2 芍药甘草汤活性成分-肝癌癌痛靶点网络

表2 芍药甘草汤主要药物活性成分的网络节点特征参数
2.4 PPI网络构建及关键靶点的获取 将交集靶点数据导入STRING数据库后得到PPI网络,见图3。使用Cytoscape 3.7.1中的插件cytoHubba选出关键靶点。使用该插件的MCC算法对网络进行分析,通过Score排序,选取排前10的靶点(节点颜色越深代表分值越高)作为关键靶点,即是原癌基因JUN、肿瘤坏死因子(tumor necrosis factor,TNF)、信号转导子和转录激活剂3(signal transducer and activator of transcription 3,STAT3)、白细胞介素(interleukin,IL)-1β、IL-6、IL-4、C-X-C基序趋化因子配体8(C-X-C motif chemokine ligand 8,CXCL8)、C-C基序趋化因子2(C-C motif chemokine 2,CCL2)、丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、肿瘤蛋白P53(tumor protein P53,TP53),见图4。

图3 芍药甘草汤活性成分肝癌癌痛交集靶点的PPI网络
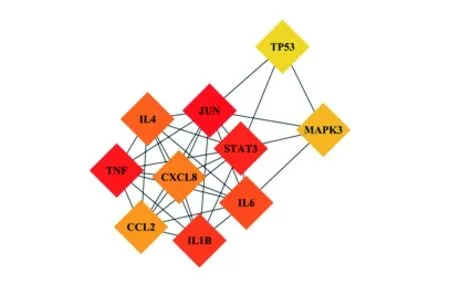
图4 关键靶点网络图
2.5 GO功能富集分析及KEGG通路富集分析 GO功能富集分析结果显示,芍药甘草汤治疗肝癌癌痛相关靶点参与的生物进程主要包括对无机物的反应、对有毒物质的反应、细胞因子介导的信号通路、细胞对脂质的反应等;涉及的主要细胞组分包括膜筏、膜微区、膜区、转录因子复合体等;涉及的主要分子功能包括蛋白激酶结合、激酶结合、蛋白激酶活性、转录因子结合、以醇基为受体的磷酸转移酶活性等,见图5。参与的通路主要有癌症通路、磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、糖尿病并发症中的糖基化终末产物(advanced glycation end products,AGE)-糖基化终末产物受体(receptor for advanced glycation end products,RAGE)信号通路、IL-17信号通路、缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)信号通路等,见图6。

图5 GO功能富集分析(仅展示前20个条目)

图6 KEGG通路富集分析(仅展示前20位)
3 讨 论
中医学认为,肝癌病位在肝,属于“积聚” “黄疸” “腹水”等范畴,多由于早期情志不畅,肝气不舒,以致气机瘀滞失于宣发,经络血脉瘀阻,日渐成积。晚期癌痛的病因病机为机体正气不足,病势迁延缠绵,日久则耗气伤阴,气阴两虚,脏腑经脉失养而痛。当以益气滋阴、养血止痛为基本治疗原则。芍药甘草汤出自张仲景的《伤寒论》,该方由白芍、甘草组成,用于治疗阴液不足、机体筋脉失于濡养所致的挛急疼痛。方中白芍苦寒为君,甘草甘平为臣,君臣相互配伍,酸甘同用以增强滋阴养血、补益津液之功效,调和肝脾以发挥缓急止痛之功效。当代药理学研究显示,芍药甘草汤有明显的镇痛、抗炎作用[7]。其中,白芍能显著抑制包括肝癌在内的癌细胞增殖,诱导癌细胞自噬[8];并减少化学药物诱导的急性肝损伤,降低肝组织中 IL-6和TNF-α的表达水平,发挥抗炎护肝的作用[9-10]。甘草不仅能保护肝脏、改善肝脏的炎性环境,还能影响细胞周期、诱导癌细胞自噬、抑制肿瘤增殖[11]。
本研究获得芍药甘草汤与疾病的交集靶点共125个,芍药甘草汤作用于肝癌癌痛靶基因的映射率为5.1%,说明芍药甘草汤存在干预肝癌癌痛的作用靶点,对肝癌癌痛有一定的特异性治疗作用。经初步筛选后发现,芍药甘草汤调治肝癌癌痛的主要活性成分为黄酮类化合物,包括槲皮素、山柰酚和柚皮素等。槲皮素的抗癌作用已在几种癌症中[12-14]表现出来,包括肝癌[15]。既往研究显示,槲皮素能显著降低Toll样受体4蛋白和mRNA的表达,促使髓样分化因子88、细胞核因子κB(nuclear factor κB,NF-κB)、IL-6及IL-17的失活,发挥保肝的作用[16];同时靶向蛋白酶激活受体2/瞬时感受器电位香草酸受体1通路,降低TNF-α和IL-1β的表达水平,从而抑制癌痛的发生[17]。山柰酚作为一种常见的中药成分,不仅能抑制肝癌细胞增殖,诱导癌细胞凋亡[18],减轻氧化应激,保护正常肝细胞[19];还能通过直接减少AGE的形成来抑制神经元细胞凋亡,显著抑制TNF-α、IL-1β和IL-6的释放,提高热痛觉和机械痛觉的阈值,对疼痛具有一定的缓解作用[20]。柚皮素有抗氧化、抗病毒的作用,促进肝癌细胞凋亡[21],同时还能抑制炎性因子TNF-α和IL-1β的释放,缓解炎症性疼痛[22]。
本研究的PPI网络分析结果显示,芍药甘草汤治疗肝癌癌痛的靶点主要包括JUN、TNF、STAT3、IL-1β、IL-6等。JUN属于转录因子活化蛋白1,包括c-Jun、JunB、JunD,其中多以c-Jun为主。c-Jun被活性氧激活后,可上调基质金属蛋白酶2表达,从而增强癌细胞的侵袭和迁移能力,促进癌细胞扩散,加速癌症病程进展,加重症状表现[23]。TNF参与全身炎症反应,有临床研究报告疼痛不明显的肝癌患者体内TNF与IL-6水平较低[24]。同样,STAT3在炎症和慢性疼痛中也有显著改变,研究显示,抑制JAK2/STAT3通路后,患者体内IL-6与IL-1β表达水平降低,疼痛表现也相应减轻[25]。炎症是肝癌微环境的重要特征之一[26],限制炎症因子的释放,抑制炎症级联反应及下调相关信号表达,癌症相关症候群(疼痛、恶心、睡眠障碍等)的症状能得到显著改善[27]。
芍药甘草汤治疗肝癌癌痛的主要通路有AGE-RAGE信号通路、IL-17信号通路、HIF-1信号通路等。AGE-RAGE信号通路参与肝脏疾病(如肝损伤、炎症反应、肝纤维化)的发生和发展过程,在肝癌组织中AGE与RAGE蛋白表达上调,可促进肿瘤的增殖、血管新生和侵袭[28-29]。IL-17信号通路与炎症反应有关,是诊断和治疗肝癌的有效靶点[30]。IL-17可与TNF-α共同诱导细胞产生炎症因子IL-6,而IL-6不仅可促进C反应蛋白的生成,也对IL-17有正向反馈作用,三者互相影响加重炎症反应;同时肝脏炎症可导致肝损伤,因此,IL-17可以协同TNF-α通过提高IL-6水平诱导体内C反应蛋白和AST水平升高,进而介导肝脏炎症反应[31]。此外,已有学者发现IL-17与其他疾病(如多发性硬化症[32])的疼痛症状有关,但在肝癌癌痛中的作用机制还未可知。HIF-1在机体的缺氧应答中至关重要,在肿瘤的生长中发挥着积极的作用,可以促进肿瘤的血管新生,维持能量代谢,促进肿瘤增殖、浸润和转移[33]。一项临床试验研究表明,相对于肝癌疼痛不明显的患者,肝癌疼痛明显的患者血清样本中的HIF-1及其下游因子血管内皮生长因子水平显著升高,患者疼痛发生率和疼痛程度也与这两个指标的表达水平呈正相关[34]。
综上所述,芍药甘草汤可能通过槲皮素、山柰酚、柚皮素等活性成分作用于JUN、TNF、STAT3等相关靶点,影响AGE-RAGE、IL-17、HIF-1等通路,阻止肝癌细胞增殖,减少致痛介质释放,缓解因肿瘤生长引起的牵涉痛及炎性因子相关性疼痛,从而达到治疗肝癌癌痛的目的。然而,本研究存在一定局限性,没有考虑实际用药剂量、药物在体内代谢等因素的影响,今后仍需进行相关实验,进一步阐释芍药甘草汤缓解肝癌癌痛的作用机制。

