高中化学“化学平衡”教学札记二则
张子宏
(甘肃省永登县连铝学校,甘肃 永登)
化学平衡是高中化学的重要内容之一,对于帮助学生构建科学思想体系、提升化学学科核心素养有重要意义。在多年高中化学教育教学的实践中发现,学生对化学平衡的概念理解相对容易,但对于一定条件下,通过不同途径建立化学平衡状态的“等效平衡”理解较难,往往不能灵活地运用“等效平衡”的思想解决相关问题。本文旨在:(1)依据多年教学心得感悟,结合问题实例的讲解,帮助学生构建“等效平衡”思想;(2)“化学平衡常数K”在解决化学平衡相关问题中运用的理解,从“定性”与“定量”两个维度助力学生加深对“等效平衡”概念内涵的理解,促进学生“平衡思想”化学核心素养的形成,进一步提升学生在新情境下解决问题的迁移能力。
一、构建“等效平衡”思想,提高解决化学平衡相关问题能力
“等效平衡”概念的理解,核心在于通过不同途径建立的平衡,若平衡时各平衡中相关组分的物质的量的分数相同,则等效。“等效”者相当也,“相当”者可相同,也可不同而相当也。
“等效平衡”的构建依据基于化学平衡的性质,化学平衡是状态函数,只与状态有关,与平衡建立的途径无关,与建立平衡所需的时间无关。构建“等效平衡”的根本依据是“平衡时各平衡中相关组分的物质的量的分数相同”。
【例题1】已知反应2H2(g)+ CO(g)⇌CH3OH(g)△H = -99 kJ·mol-1。恒温恒容下,向三个容积相同的密闭容器中分别充入气体:(X)2 mol H2和1 mol CO;(Y)1 mol H2和 0.5 mol CO;(Z)1 mol CH3OH。恒温恒容下反应达到平衡时,比较反应放出或吸收热量的数值Q:QX、QY、QZ的关系。
解析:由X、Y、Z 三种途径中各物质的量的关系可知,X、Z 属于等效平衡,但QX与 QZ的关系究竟如何呢?通过以下定量化推导可知:设该条件下,X 中CO 的转化率为 a,则 Z 中 CH3OH 的转化率为(1-a)。
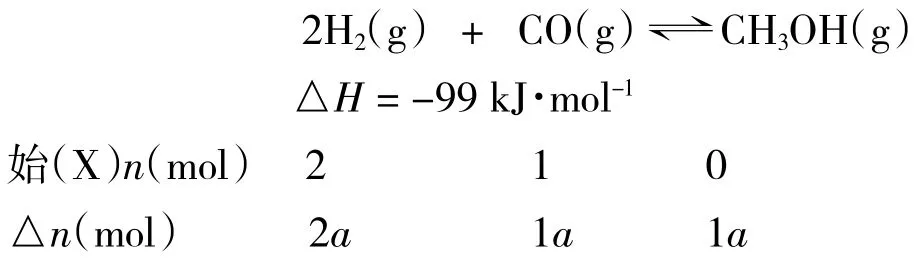
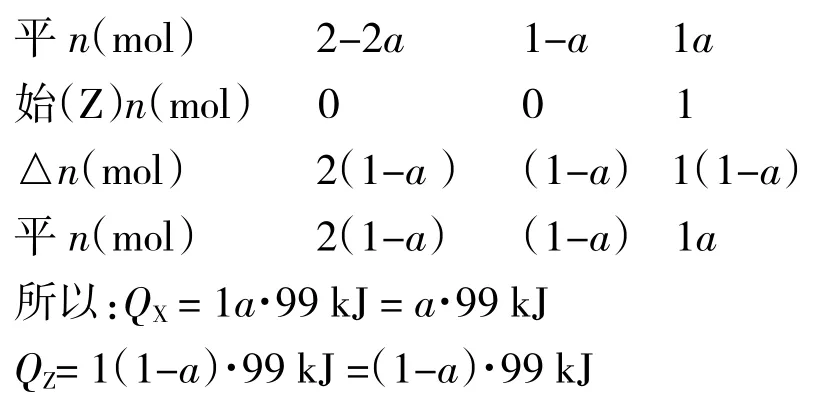
显然,只有当转化率a=0.5 时,QX=QZ;当转化率a<0.5 时,QX<QZ;当转化率 a>0.5 时,QX>QZ。
X、Y 相比,Y 相当于减压使容器的容积变为原容积的2 倍,减压会使该平衡逆向移动即 QX>2QY。
【例题 2】可逆反应 A(g)+3B(g)⇌2C(g)△H=-Q(Q>0)kJ·mol-1。现两个密闭容器 M、N,容积相同且不变。向M 中加入xmolA 和3xmolB,一定条件下达到平衡,放出Q1kJ 的热量;在同条件下,向N 容器中加入2x mol的C,达到平衡后吸收Q2kJ 的热量,已知,Q1=3Q2,求N途径中C 的转化率。
解析:M、N 两种途径是等效平衡,且 M、N 两种途径平衡时反应各组分的物质的量完全相同。
设M 途径达到平衡时A 的转化率为a,则N 途径达到平衡时 C 的转化率为(1-a),Q1=1xa:·Q kJ,则 Q2=2x(1-a)/2:·Q kJ=(1-a)x·Q kJ。
根据已知:Q1=3Q2,解得:a=0.75。
所以,N 途径中 C 的转换率为:1-a=0.25。
【例题3】已知可逆反应PCl3(g)+Cl2(g)⇌PCl5(g)△H = -Q(Q>0)kJ·mol-1。往容积一定的密闭容器中充入2.0mol PCl3和1.0 mol Cl2,条件一定发生反应且达到平衡,PCl5为 0.40 mol,此时移走 1.0 mol PCl3和0.50 mol Cl2,相同条件下再次达到平衡,求此过程中反应的热效应。
解析:该过程属于化学平衡移动问题,要求此过程中的反应热,需利用该温度下的平衡常数,再求出PCl5的变化的物质的量,方可求出此过程的反应热。
设该容器的容积为V L,过程Ⅱ达到平衡时PCl5的物质的量为a mol。
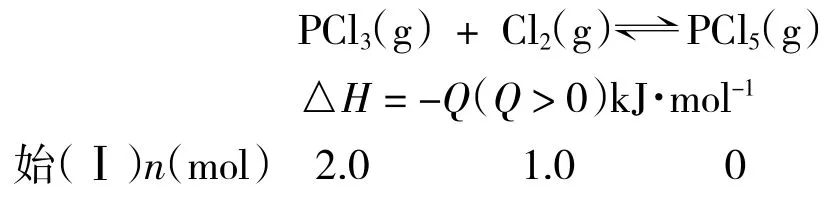

平衡常数只与温度有关:
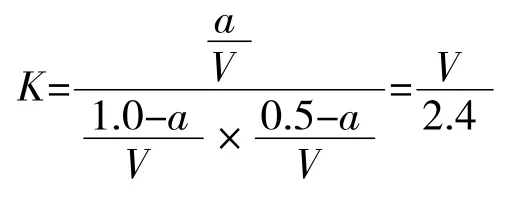
解得:a=0.135 mol,因为过程Ⅱ平衡逆向移动为吸热反应,所以过程Ⅱ的热效应为:Q吸=(0.4-0.135)Q kJ=0.265 Q kJ。
二、“等效平衡”颉颃“平衡常数K”提升化学平衡核心素养——对一道教材习题的拓展研究
“化学平衡常数K”是化学平衡性质的数学表达式,揭示了一定条件下建立的化学平衡中相关组分浓度的量化关系,是解决化学平衡相关问题的重要依据、桥梁、手段。对某些问题通过“等效平衡”的“定性”解释和利用“化学平衡常数K”的“定量”解释,可以促进学生对化学平衡性质的理解,也可增强学生对“等效平衡”思想的自信,还可激发学生的发散思维,提高学生的创新能力。
【例题4】体积不变的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,条件一定时,发生反应:PCl3(g)+ Cl2(g)⇌PCl5(g),平衡时,PCl5为0.40 mol,如果移走1.0 mol PCl3和0.5 mol Cl2,相同温度下再平衡时,PCl5的物质的量是 ( )
A.0.40 mol
B.0.20 mol
C.小于0.20 mol
D.大于 0.20 mol,小于 0.40 mol
解法一:等效虚拟定性推导法
根据等效平衡原理,题中原途径Ⅰ达成的平衡可以看成下列两种途径Ⅱ、Ⅲ虚拟组合而达成的平衡:
途径Ⅱ、Ⅲ分别达到平衡后,可以将平衡Ⅲ中的气体抽象地转移到平衡Ⅱ的容器中,容器的容积不变。设途径Ⅱ、Ⅲ分别达到平衡时PCl5(g)的物质的量为x mol、x mol;又因为该反应 ΔV(g)<0,气体混合后,平衡向正反应方向移动,设平衡移动达到新的平衡后PCl5的增加量为Δx,与途径Ⅰ达到的平衡一样(等效且一样)。
所以有:2x+Δx=0.40,
因为 Δx> 0,所以 x < 0.20。
解法二:平衡常数定量计算法
解:设容器的容积为VL,则原平衡中的平衡常数为K,
当平衡后移走1.0 mol PCl3和0.5 mol Cl2时,平衡向逆反应方向移动,设达到新的平衡时,有x mol PCl3、Cl2生成。则有:
注:本例中学生对容器容积V L 的设定比较困难,需适当引导。
解法三:等效平衡定量计算法
注:本例中根据化学平衡原理,结合题干信息,实现途径Ⅰ和途径Ⅱ的等效转换是学生学习时的难点,较难灵活应用。教学中应加强学生对“等效平衡”概念的深刻理解。
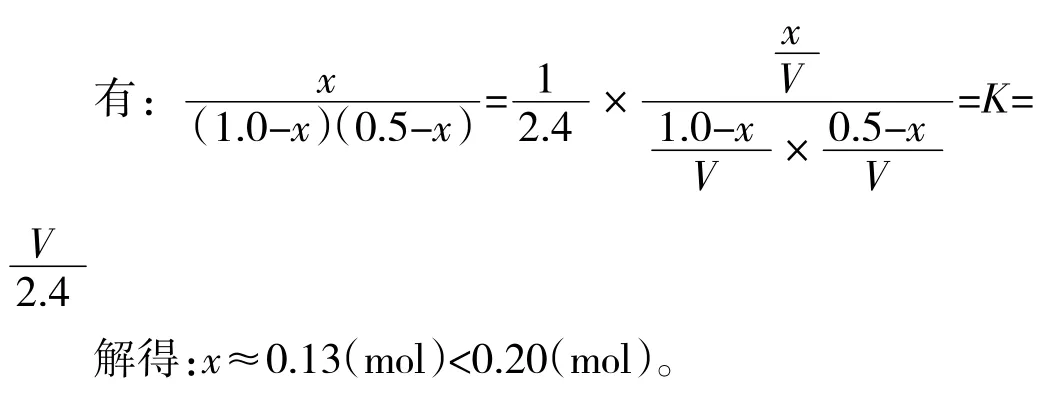
教师在教学中设计教学目标时既要重视学科教学目标,也要结合教学对象的实际认知水平设计教学方案;既要重视原理、理论教学,也要重视在具体情境中理解原理、运用原理,进一步加深对原理的理解,有助于学生学习迁移能力的提升和学科核心素养的形成,并提高相关问题的解决能力。

