不同生理条件下CD36/LKB1/AMPK信号通路在骨骼肌脂肪酸氧化代谢调控中的作用机制研究
孙婧瑜,苏亚娟,董静梅
骨骼肌作为脂肪酸氧化代谢的主要场所,在维持机体能量稳态中起到了重要的调控作用(Sanchez et al.,2012)。目前,研究认为骨骼肌脂肪酸摄入的增加和/或氧化的减少导致骨骼肌脂肪酸堆积,过多的脂肪酸堆积又将进一步损害胰岛素信号通路,从而导致糖脂代谢紊乱,最终发生2型糖尿病(Goodpaster et al.,2004)。然而,骨骼肌脂肪酸代谢紊乱与胰岛素抵抗间的分子联系尚未阐明。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)广泛存在于各种真核细胞中,被认为是2型糖尿病和代谢综合征治疗中一种有效的胰岛素增效药物,能将细胞内脂肪酸代谢与胰岛素代谢信号通路联系起来(Smith et al.,2017)。AMPK的激活一方面导致骨骼肌脂肪酸氧化代谢增加(O’Neill et al.,2014),另一方面促进线粒体生物发生(O’Neill et al.,2013),从而调节骨骼肌脂肪酸的代谢平衡,最终改善胰岛素敏感性。近期研究显示,AMPK的激活除了受AMP/ATP比值的主要调控外,还受其他分子机制的调控,即依赖AMP/ATP比值的改变和不依赖AMP/ATP比值的改变(Ke et al.,2018)。肝激酶B1(liver kinase B1,LKB1)被认为是胰岛素外周组织中激活AMPK的主要上游激酶,可直接磷酸化AMPK,调节细胞能量代谢(Lee et al.,2007)。目前,多数研究认为,运动可能通过影响AMP/ATP的比值,促进LKB1激酶对AMPK的激活(Jeppesen et al.,2013)。然而,是否还有其他途径激活LKB1-AMPK信号通路,尚不清楚。另外,不同生理条件下LKB1如何激活AMPK,亦不明确。因此,本研究着重探讨不同生理条件下激活AMPK的上游信号通路及其在改善骨骼肌脂肪酸氧化代谢中的作用。
近年来,与脂肪酸代谢有关的膜蛋白相继被发现。脂肪酸转运蛋白-1(fatty acid transport protein-1,FATP-1)、膜脂肪酸结合蛋白(plasma membrane fatty acid binding proteins,FABPpm)及脂肪酸转位酶(fatty acid translocase,FAT/CD36)在肌肉中均有大量表达(Febbraio et al.,2008)。其中,CD36更以分布广泛且功能机制复杂多样而备受关注。鉴于脂肪酸氧化代谢与胰岛素抵抗和2型糖尿病间的密切关系,许多研究开始关注CD36在胰岛素抵抗防治中的作用。我们前期研究结果显示,CD36通过介导Fyn-LKB1复合物在胞内的动态变化及相互作用,激活AMPK,从而对骨骼肌脂肪酸氧化代谢进行直接调控(Samovski et al.,2015)。另有研究显示,与其他脂肪酸转运蛋白相比,CD36在运动等能量需求较大时,对骨骼肌脂肪酸代谢的调控作用可能更为重要(Holloway et al.,2009)。因此,本研究以CD36-LKB1信号通路为切入点,通过构建两种不同的生理条件(高脂膳食与有氧运动)动物模型,借助细胞分子生物学技术,着重探讨CD36是如何通过激活AMPK对骨骼肌脂肪酸氧化代谢进行调控的。
1 材料与方法
1.1 C2C12细胞培养及siRNA干扰
小鼠骨骼肌C2C12细胞系在6孔板内培养,以生长培养基(高糖DMEM、10%小牛血清、1%谷氨酸、1%青霉素/链霉素)培养2天后,改用分化培养基(高糖DMEM、2%马血清、1%谷氨酸、1%青霉素/链霉素)进行分化培养4~6天。在C2C12细胞分化第3天时,换用无抗生素的分化培养基,分别对各组细胞进行siRNA干扰:siCont、siCD36(#1和#2)。siCont:5’-UUCUCCGAACGUGUCACGUTT-3’;siCD36-1:5’-GGAUGACAACUUCACAGUUTT-3’;siCD36-2:5’-CCACAUUUCCUACAUGCAATT-3’购买于 Gene Phar‐ma公司。
6孔板中每孔加入A液(150 μl Optimem、1.5 μl 20 umol/L siRNA)和B液(150 μl Optimem、3 μl Lipofectamine RNAiMAX)(Life Technologies公司)后,将混合物于室温放置5 min,加入C2C12细胞,于37℃培养箱孵育6 h后,换回分化培养基,继续分化培养2天。然后,对细胞进行低糖DMEM及无血清饥饿过夜,并用含磷酸酶抑制剂的蛋白裂解液裂解细胞,用于后续检测。
1.2 实验动物与分组
17只8周龄C57BL/6雄性小鼠(上海斯莱克实验动物有限公司)于同济大学实验动物中心饲养训练。小鼠自由进食饮水。环境温度20℃~24℃,相对湿度40%~60%,通风良好,昼夜12 h/12 h循环照明。所有操作均严格遵守同济大学道德伦理委员会的要求。小鼠随机分为对照组(control group,CON;n=6)、高脂组(high fat diet group,HFD;n=6)和有氧运动组(exercise group,EX;n=5)。对照组方案:自由饮食,以基础饲料喂养8周。高脂膳食方案:高脂饲料(脂肪:60%kcal、碳水化合物:20%kcal、蛋白质:20%kcal)喂养8周。有氧运动方案:小鼠给予基础饲料喂养,适应性跑台训练1周后,以20 m/min跑速,6次/周,60 min/次进行运动并持续至第8周。基础饲料及高脂饲料均由上海斯莱克实验动物中心提供。
1.3 动物取材
最后一次实验干预后,对小鼠禁食12 h,然后取材。小鼠麻醉后颈椎脱位致死,迅速分离双侧腓肠肌,进行蛋白质印迹、免疫荧光、电镜、酶活等实验检测。剩余组织置于-80℃冰箱冷冻待用。
1.4 蛋白质印迹实验
取60~80 mg腓肠肌置于含磷酸酶抑制剂的RIPA裂解液(Beyotime公司)中,剪碎后充分匀浆(或C2C12细胞裂解液),冰上静置30 min后,离心机12 000 rpm、4℃离心10 min,取上清。BCA法(#20201ES76,YESEN公司)测定蛋白样品浓度后进行煮沸变性。蛋白样品经过SDSPAGE电泳、转膜、5%脱脂奶粉室温封闭1 h后,一抗(1∶1 000)4℃孵育过夜。p AMPK(T172)(#2535)、p ACC(S79)(#3661)购买于 Cell signaling公司,CD36(AF2519)购买于R&D systems公司,PGC-1α(H-300)(sc-13067)购买于 Santa Cruz Biotechnology公司 ,GAPDH(G8795)购买于Sigma-Aldrich公司。TBST洗膜3次,每次 5 min,二抗(1∶5 000)室温孵育 1 h。采用 ECL(#36208ES60,YESEN公司)发光法检测目标蛋白条带,并用Image J软件分析条带灰度值。
1.5 免疫荧光双标实验
制备腓肠肌冰冻切片,置于4%多聚甲醛冰上固定60 min,室温封闭 60 min后,加入 LKB1一抗(LKB1,1∶200,5c10,Millipore公司),4℃孵育过夜。然后加入Alexa Fluor 488标记的二抗(1∶500),室温孵育 60 min。滴加含DAPI的抗荧光淬灭剂(#36308ES11,YESEN公司)封片。使用Zeiss LSM700激光共聚焦显微镜观察并采集图像。荧光强度反映LKB1蛋白表达的变化情况,共定位程度反映LKB1向细胞质转位的情况。
1.6 超微结构透射电镜实验
剪取体积为3 mm×3 mm×3 mm的骨骼肌组织,取材过程中尽量减小对组织的牵拉、挫伤与挤压等机械损伤,迅速投入2.5%戊二醛固定液中,4℃固定3 h以上。然后用0.1 mol/L磷酸缓冲液PBS(pH 7.4)漂洗3次,每次10 min,0.5%的锇酸0.1 mol/L固定3 h,0.1 mol/L磷酸缓冲液PBS(pH 7.4)漂洗3次,每次10 min,依次放入50%、70%、80%、90%、95%、100% 酒精中脱水,每次 15 min。Spurr树脂浸透包埋,70℃聚合48 h。切片机切60~80 nm超薄切片,铀铅双染色(2%醋酸双氧铀、柠檬酸铅,各染色10 min),切片室温干燥,于透射电子显微镜下进行拍摄。
1.7 线粒体呼吸链酶活性检测
根据说明书,使用相应的分析试剂盒(南京建城生物工程研究所)测定骨骼肌中腺苷三磷酸酶(ATP synthase,ATPase)及柠檬酸合成酶(citrate synthetase,CS)的活性。用TECAN微孔板法记录吸光度。
1.8 数据处理
实验数据采用SPSS 20.0软件处理,结果以平均数±标准误(M±SEM)表示。组间比较采用ANOVA单因素方差分析,显著性差异水平设置为P<0.05。
2 实验结果
2.1 CD36缺乏对骨骼肌细胞脂肪酸氧化代谢信号通路AMPK/ACC激活的影响
图1显示,经siCD36干扰后的C2C12细胞中CD36蛋白表达水平显著下降(P<0.001),说明本实验中的CD36基因敲低效率较好。进一步研究发现,经siCD36干扰后的C2C12细胞,AMPK、乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)磷酸化水平显著增加(P<0.01,P<0.05),说明CD36基因缺乏能够激活骨骼肌细胞脂肪酸氧化信号通路。

图1 CD36缺乏对C2C12小鼠骨骼肌细胞相关蛋白表达水平的影响Figure 1.Effect of CD36 Deficiency on Related Protein Expression Levels in C2C12 Cells
2.2 不同生理条件对小鼠骨骼肌CD36总蛋白表达水平的影响
图2显示,与CON组小鼠相比,8周高脂膳食能够诱导小鼠骨骼肌CD36总蛋白表达水平的增加(P<0.01);然而,经过8周有氧运动的小鼠骨骼肌CD36总蛋白表达水平虽有增加的趋势,但无显著性差异(P>0.05)。进一步研究发现,与HFD组相比,EX组小鼠骨骼肌CD36蛋白表达水平显著降低(P<0.05)。该结果说明,不同生理条件下,小鼠骨骼肌CD36蛋白表达水平不同。
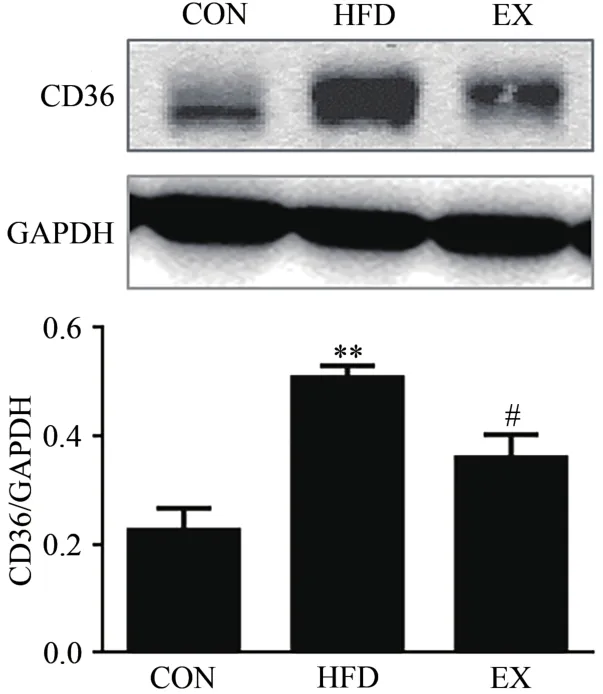
图2 不同生理条件对小鼠骨骼肌CD36蛋白表达水平的影响Figure 2. Effect of Different Physiological Conditions on the Expression Levels of CD36 Protein in Skeletal Muscle of Mice
2.3 不同生理条件对小鼠骨骼肌AMPK/ACC信号通路激活的影响
与CON组小鼠相比,经过8周高脂膳食干预的小鼠骨骼肌AMPK、ACC蛋白磷酸化水平显著降低(P<0.05,P<0.05,图3);经过8周有氧运动的小鼠骨骼肌AMPK蛋白磷酸化水平显著增加(P<0.05)。与高脂膳食组小鼠相比,经过8周有氧运动的小鼠骨骼肌AMPK、ACC蛋白磷酸化水平显著增加(P<0.01,P<0.05)。结果说明,不同生理条件刺激对小鼠骨骼肌AMPK/ACC信号通路激活程度不同。
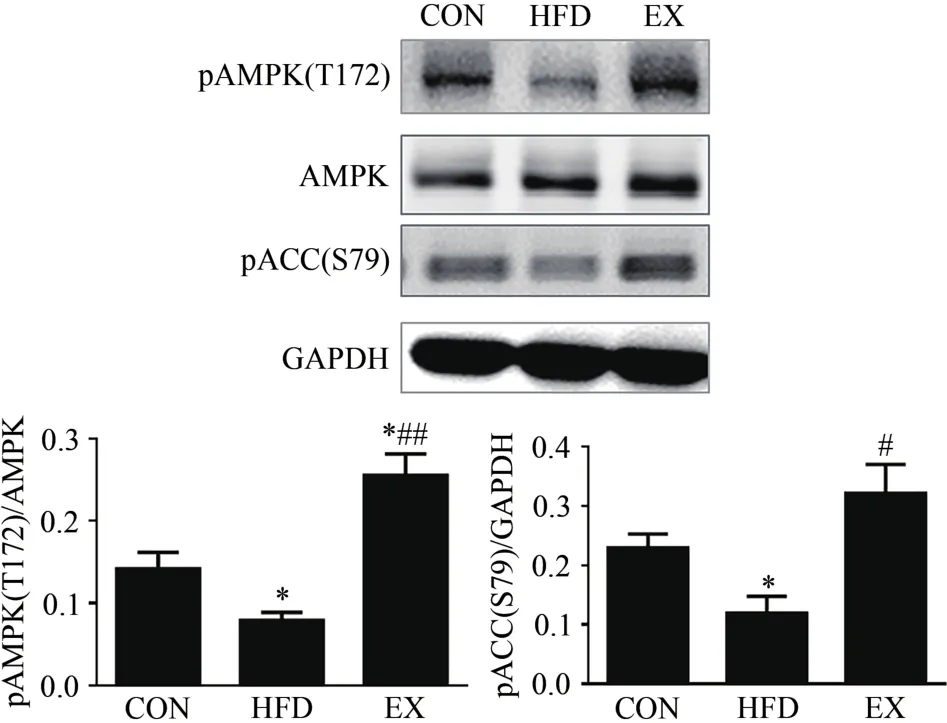
图3 不同生理条件对小鼠骨骼肌AMPK/ACC信号通路激活的影响Figure 3.Effect of Different Physiological Conditions on the AMPK/ACC Signaling Pathway Activation in Skeletal Muscle of Mice
2.4 不同生理条件对小鼠骨骼肌LKB1向细胞核转位的影响
本研究进一步评估不同生理条件下LKB1的胞内动态转位。小鼠骨骼肌组织LKB1免疫荧光检测结果显示,LKB1被标记为绿色荧光,细胞核被DAPI标记为蓝色,二者的共定位重叠区域为蓝绿色(图4)。本研究结果显示,与CON组相比,HFD组绿色荧光与细胞核共定位程度较为明显,说明HFD能够诱导LKB1向细胞核聚集。与HFD组相比,EX组绿色荧光与细胞核共定位区域减少。
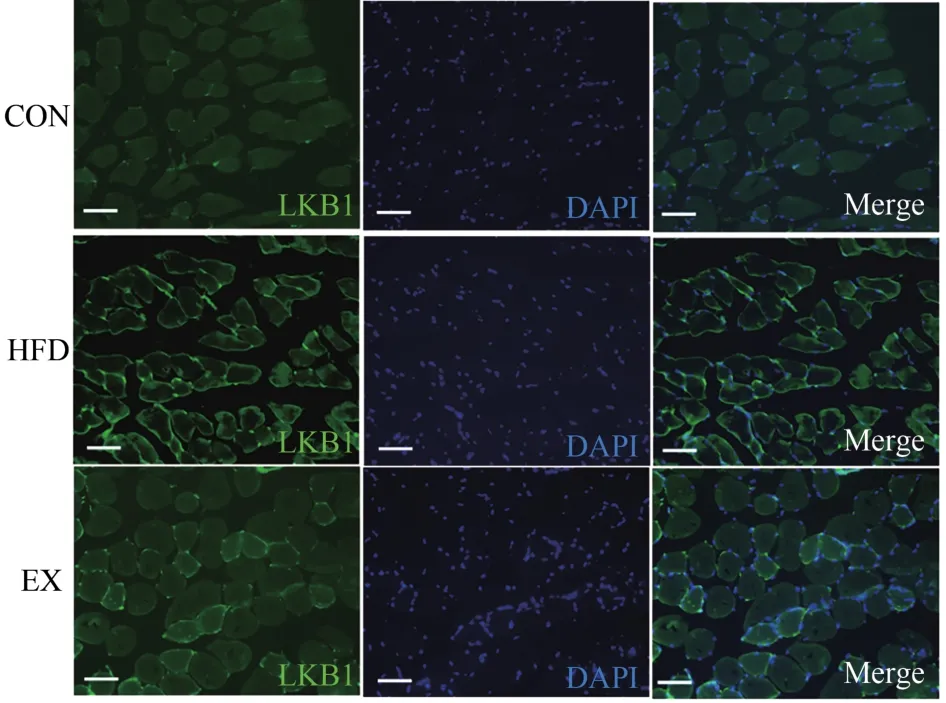
图4 不同生理条件对小鼠骨骼肌LKB1向细胞核转位的影响(×400)Figure 4.Effect of Different Physiological Conditions on LKB1 Translocation to Cell Nucleus in Skeletal Muscle of Mice(×400)
2.5 不同生理条件对小鼠骨骼肌线粒体生物发生调控因子PGC-1α蛋白表达水平的影响
图5显示,与CON组小鼠相比,经过8周有氧运动干预的小鼠骨骼肌过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coacti‐vator-1,PGC-1α)蛋白表达水平显著增加(P<0.05),该结果说明,有氧运动可能通过增加PGC-1α的表达,促进线粒体生物发生。然而,与CON组相比,经过8周高脂膳食干预的小鼠骨骼肌PGC-1α蛋白表达水平无显著差异(P>0.05)。
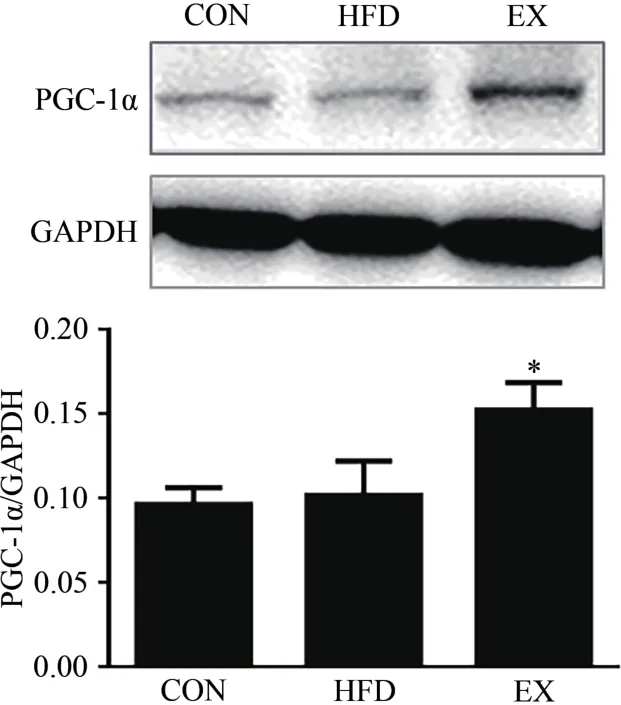
图5 不同生理条件对小鼠骨骼肌PGC-1α总蛋白表达水平的影响Figure 5. Effect of Different Physiological Conditions on the Expression Levels of PGC-1α Protein in Skeletal Muscle of Mice
2.6 不同生理条件对小鼠骨骼肌线粒体结构的影响
在透射电镜下观察发现,CON组小鼠骨骼肌肌丝结构清晰,肌小节排列整齐,横纹清楚,Z线、M线结构清晰,肌丝间线粒体排列整齐,呈椭圆形,嵴结构清晰,排列密集。HFD组骨骼肌肌丝结构明显紊乱,典型肌小节结构消失,大部分线粒体超微结构发生了明显的破坏,表现为线粒体排列紊乱,肿胀,部分严重的线粒体嵴和基质消失出现空泡样改变。EX组骨骼肌结构较为清晰、肌小节排列较整齐,线粒体数量增多、体积增大、形态较HFD明显改善(图6)。

图6 透射电镜下不同生理条件小鼠骨骼肌线粒体超微结构形态学改变Figure 6.Ultrastructural Changes of Muscular Mitochondria Under Transmission Electron Microscope
2.7 不同生理条件对小鼠骨骼肌线粒体相关酶活性的影响
线粒体呼吸链相关酶的活性已广泛应用于线粒体功能的估计(Lobo-Jarne et al.,2008)。因此,我们通过检测ATPase活性和CS活性来评估不同生理条件对骨骼肌线粒体功能的影响。研究结果表明,有氧运动干预显著增加ATPase活性(P<0.05),而高脂膳食干预显著降低CS的活性(P<0.05)。说明高脂膳食能降低线粒体功能,运动干预能改善线粒体功能。
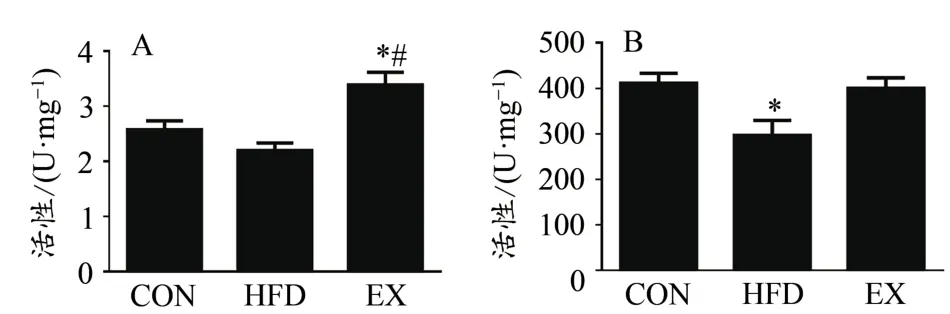
图7 不同生理条件对小鼠骨骼肌线粒体酶活性的影响Figure 7.Effect of Different Physiological Conditions on Mitochondrial Related Enzymes Activities in Skeletal Muscle of Mice
3 分析与讨论
高脂膳食是导致饮食性肥胖发生的重要原因之一,而适量的运动是目前国际上公认的控制饮食性肥胖安全、有效的途径。AMPK作为一种细胞内能量传感器和调节剂,在细胞能量消耗时被激活,从而诱导ACC的失活,增加骨骼肌脂肪酸的氧化代谢。然而,激活AMPK/ACC的上游信号分子,尚不清楚。因此,本研究利用高脂膳食及有氧运动两种不同生理条件,着重探讨了CD36作为信号分子,可能通过诱导LKB1的胞内转位,激活AMPK/ACC信号通路,并且通过调控PGC-1α改善线粒体数量及功能,最终对骨骼肌脂肪酸氧化代谢进行调控。
3.1 不同生理条件对CD36-AMPK信号通路的影响
CD36是细胞表面重要的FA受体,与骨骼肌胰岛素抵抗的发生关系密切(Samovski et al.,2018)。在肥胖人群及2型糖尿病患者的骨骼肌细胞膜上均发现了CD36高表达,从而导致脂质过量累积,这可能是骨骼肌胰岛素抵抗发生的重要原因之一(Bonen et al.,2004)。激活的AMPK一方面通过诱导GLUT4和CD36向细胞膜转位(Hames et al.,2014),增加骨骼肌胰岛素敏感性;另一方面,激活的AMPK通过ACC的失活来增加长链脂肪酸β氧化,从而增加细胞内脂质消耗。因此,骨骼肌中AMPK信号受损与FA氧化能力下降及胰岛素抵抗发生有关(Tanaka et al.,2001)。与AMPK相似,CD36能够促进FA向细胞膜的转运,从而影响骨骼肌脂肪酸的摄取及氧化。禁食、机械收缩等生理条件均能诱导CD36向细胞膜的转位(Silverstein et al.,2009)。因此,CD36诱导的FA摄取和氧化的协同增加有助于胰岛素抵抗骨骼肌细胞FA代谢。
本研究首先利用小RNA干扰技术,在细胞水平上探讨CD36缺失对AMPK/ACC信号通路的影响。结果表明,CD36基因沉默能够显著增加AMPK/ACC磷酸化水平,说明CD36基因缺乏能够激活骨骼肌细胞脂肪酸氧化代谢信号通路。然后,进一步研究不同生理条件下CD36对AMPK/ACC信号通路激活的影响,结果发现,与对照组相比,在CD36高表达的高脂膳食组,AMPK/ACC磷酸化水平显著降低;与高脂膳食组相比,在CD36低表达的有氧运动组,AMPK/ACC磷酸化水平显著增加。该结果进一步验证了细胞水平上的结论,即CD36可能作为信号分子对AMPK激活进行调控。然而,有氧运动对小鼠骨骼肌CD36的表达无显著影响,说明有氧运动可能不通过CD36总蛋白的调控激活AMPK/ACC信号通路。
高脂膳食能够增加CD36蛋白表达,该结果与Roep‐storff等(2004)的研究相一致。这可能是因为在高脂膳食的持续作用下,CD36作为骨骼肌中重要的脂肪酸转运载体,通过诱导自身表达的变化,增加外源性脂肪酸的摄入,以促进线粒体的氧化代谢,从而消耗掉摄入的过量脂肪酸,对骨骼肌脂质堆积起到保护作用。然而,经过长时间耐力运动后,骨骼肌CD36总蛋白的表达水平呈现多元化的调控。有研究显示,急性耐力运动能够诱导人体骨骼肌CD36总蛋白表达水平的增加(Holloway et al.,2006)。然而,对有两年以上耐力训练经历的受试者进行检测,发现长期的耐力训练并不能提高股外侧肌CD36总蛋白的表达(Kiens et al.,2004)。本研究结果显示,与对照组小鼠相比,经过8周有氧运动的小鼠骨骼肌CD36总蛋白表达水平虽有增加的趋势,但无显著性差异。结合他人的研究结果,推测CD36蛋白表达水平可能与有氧运动干预的时间及干预方式有关。比如,骨骼肌CD36蛋白表达水平的升高可能是对运动训练初期的一个暂时性的适应过程,而这种适应性的过程可能会随着运动训练时间的延长而逐渐消退。因此,在今后的研究中,可以选取运动初期、运动中期以及运动末期的多个时间点进行检测,从而可以更清晰地反映CD36总蛋白含量在运动适应过程中的变化。
研究显示,长期高脂膳食诱导的肥胖或胰岛素抵抗大鼠骨骼肌中AMPK磷酸化水平显著减少(Lessard et al.,2007)。Liu等(2006)发现,5个月的高脂膳食能够导致骨骼肌AMPK、ACC蛋白的磷酸化水平显著下降,导致胰岛素抵抗的发生。主要原因可能是,长期的高脂膳食一方面可能通过降低AMPK/ACC的磷酸化水平,损伤骨骼肌脂肪酸氧化代谢;另一方面,在高脂膳食的作用下,进一步导致骨骼肌内脂肪酸的堆积,从而影响胰岛素敏感性。本研究结果亦显示,高脂膳食能显著降低骨骼肌AMPK、ACC蛋白磷酸化水平。另外,本研究结果显示,有氧运动干预能增加骨骼肌AMPK、ACC的蛋白磷酸化水平,该结果与Cao等(2012)的研究结果相一致。这可能是由于有氧运动诱导的骨骼肌AMPK、ACC磷酸化水平增加是对能量失衡的一种代偿性适应过程。综上所述,CD36可能作为信号分子激活AMPK。然而,CD36激活AMPK的途径,尚不清楚。
3.2 不同生理条件下LKB1胞内转位对AMPK激活的作用
LKB1作为AMPK上游分子,可以对AMPK进行直接调控,从而参与骨骼肌FA氧化代谢(Hardie et al,2013)。然而,不同生理条件下LKB1对AMPK的激活作用,尚不清楚。目前,对蛋白胞内动态变化的研究技术相对成熟。因此,我们前期工作已有效锁定LKB1胞内动态变化对AMPK激活的效应方式,即棕榈酸作为CD36的配体,通过减少CD36与Fyn的结合能力,减少Fyn对LKB1的激活,从而抑制LKB1向细胞核的转位,使滞留在细胞质内的LKB1增多,从而激活AMPK,最终对脂肪酸氧化代谢起到调控作用(Samovski et al.,2015)。然而,不同生理条件下是否也通过影响CD36,抑制LKB1向细胞核的转位,激活AMPK信号通路,从而改善骨骼肌脂肪酸氧化代谢,尚不清楚。因此,我们进一步评估了不同生理条件下LKB1的胞内动态转位。研究结果显示,HFD组LKB1与细胞核共定位程度较为明显,说明高脂膳食干预能够诱导LKB1从细胞质向细胞核的转位,这可能是激活AMPK的重要原因,该结果与Thomson等(2007)的研究结果相一致。然而,有研究发现,AMPK缺失对AICAR诱导的FA氧化代谢无影响(Dzamko et al.,2008)。这可能是因为LKB1的下游靶点除了AMPK外,还有其他下游靶点对FA氧化代谢进行调控。因此,我们进一步探讨了不同生理条件下LKB1胞内转位激活的其他下游靶点。
在线粒体能量代谢过程中,PGC-1α作为一种激活剂,在协调线粒体生物发生及代谢相关信号通路中起着重要的作用。最直接的证据是PGC-1α基因的过表达能够增加线粒体数量,提高线粒体功能。相反,PGC-1α的缺失导致线粒体功能障碍及代谢紊乱(Handschin et al.,2007)。因此,PGC-1α可能是LKB1作用的下游靶点之一。进一步研究发现,AMPK可能通过调控骨骼肌PGC-1α和线粒体相关酶的表达,改善线粒体功能(Jager et al.,2007)。本研究结果显示,运动能激活小鼠骨骼肌AMPK,增加PGC-1α表达及线粒体数量。结果表明,AMPK激活至少可以部分通过调控PGC-1α,增加线粒体的数量及其功能。这可能是因为运动导致的能量缺乏,通过增加AMP/ATP的比率启动了AMPK/PGC-1α途径。AMPK/PGC-1α是调控线粒体能量代谢的重要信号途径,通过感知细胞内的能量状态对线粒体生物发生及其功能进行直接调控,与糖尿病发生、发展关系密切(Wu et al.,2016)。
综上所述,我们提出以下科学假设:HFD诱导的CD36高表达,促进LKB1从细胞质向细胞核的转位,使滞留在细胞质内的LKB1减少,从而减少了LKB1对AMPK的激活作用。AMPK激活的减少,一方面能够抑制ACC的磷酸化,减少脂肪酸的氧化代谢;另一方面通过调控线粒体相关基因,减少线粒体的数量,损伤线粒体功能(图8)。
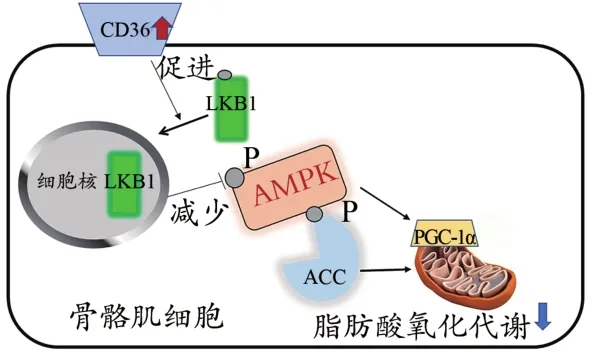
图8 CD36/LKB1/AMPK信号通路在调控骨骼肌脂肪酸氧化代谢中的作用机制示意图Figure 8.The Role of CD36/LKB1/AMPK Signaling Pathway in Regulating Skeletal Muscle FA Oxidation Metabolism
4 结论
本研究在细胞及组织层面上证实CD36作为信号分子,而非脂肪酸转运载体,当siRNA诱导CD36低表达时,激活AMPK;而HFD诱导CD36高表达时,通过诱导LKB1从细胞质向细胞核的转位,抑制AMPK/ACC信号通路激活,从而对脂肪酸氧化代谢进行调控。

