基于纳米压痕测试的骨骼力学特性解剖学区域差异研究
张冠军 顾红跃 陈萍 李振涛 贾晓航
摘要:厘清骨骼不同解剖学区域的力学性能差异可为构建高生物逼真度的骨骼有限元模型提供重要依据.从牛股骨中段的前、后、内、外四个解剖学区域各制备一个试样,采用玻式压头对每个试样分别进行18个点的纳米压痕试验,记录加载力和压入深度的时间历程曲线,获得各压痕点的压入模量和硬度.结果显示长骨前侧、后侧、外侧、内侧的压入模量分别为20.78±2.66GPa、18.66±2.57GPa、16.39±2.29GPa、21.57±2.19GPa,硬度分别为0.65±0.79GPa、0.58±0.08GPa、0.44±0.06GPa、0.61±0.15GPa.方差分析表明,解剖学区域对压入模量和硬度的影响显著(p<0.001);组间多重比较表明,前侧试样的压入模量和硬度显著高于外侧试样,内侧试样的压入模量和硬度显著高于外侧试样,后侧试样的硬度显著高于外侧试样,内侧试样的压入模量显著高于外侧试样.因此,采用非均一材料将有助于提升长骨有限元模型的生物逼真度.
关键词:纳米压痕测试;力学特性;骨骼;壓入模量;解剖学区域
中图分类号:U461.91
文献标志码:A
收稿日期:2021-02-26
基金项目:国家自然科学基金创新研究群体项目(51621004),湖南省自然科学基金项目(2019JJ40034),
作者简介:张冠军(1981-),男,山东济宁人,湖南大学副教授,博士
†通信联系人,E-mail:zgjhuda@163.com
骨骼是一种具有层次结构的复合材料,对其力学性能的研究一直广受关注.皮质骨主要由矿物质
(50%-60%)、胶原蛋白(30%-40%)和水(10%-20%)组成,矿物质比较坚硬,而胶原蛋白比较松软,二者的相互作用决定了骨骼的微观力学性能[1].皮质骨的力学性能不仅仅取决于其组成成分,也受微观结构的影响[2].皮质骨的微观结构主要有环骨板、骨单位以及间质骨,大型哺乳动物在生长发育过程还会形成层状骨[3].由于这几种结构在骨骼的分布不均匀,骨骼不同区域的力学性能也不相同.准确地获取皮质骨的微观力学性能不仅对理解骨骼的整体力学性能至关重要,而且对建立更加精细的有限元模型以模拟骨骼裂纹损伤也起着相当关键的作用.
目前,很多学者探究了骨骼不同解剖学区域的力学性能.Bonney等[4]采用三点弯曲试验探究了猪股骨不同解剖学区域的力学性能与成分之间的变化趋势;Li等[5]采用三点弯曲试验探究了牛股骨不同解剖学区域的断裂韧性;Li等[6]采用压缩和拉伸试验方式分析了牛股骨不同解剖学区域的力学性能变化;Abdel-Wahab等[7]采用拉伸试验研究了骨骼不同解剖学区域以及不同方向的力学性能;Duchemin等[8]采用拉伸和压缩试验探究了骨骼不同解剖区域的密度与弹性模量之间的关系;Espinoza Orías等[9]采用超声波测试探究了骨骼的弹性各向异性和不均匀性在不同解剖学区域的变化规律;Malo等[10]采用声学显微镜探究了骨骼弹性系数在不同解剖学区域的变化.受限于传统试验方法对试样尺寸、形状等的要求,上述研究难以从微观层面分析解剖学区域对骨骼力学性能的影响.
微纳米压痕测试方法能够在微/纳米尺度上开展力学测试.Rasoulian等[11]采用参考点压痕技术(RPI)探究了骨骼不同解剖学区域力学性能与成分之间的关系.Bosiakov等[12]采用纳米压痕技术探究了骨骼不同象限的弹性性能和韧性.得益于纳米压痕技术的微观尺度,上述研究在微观层面上研究了骨骼不同解剖学区域的力学性能.由于骨骼试样的生物多样性,统计分析是研究骨骼解剖学区域力学差异的必要方法,但上述文献在这方面存在局限性.
针对目前研究存在的不足,本文以牛股骨皮质骨为研究对象,利用纳米压痕试验方法测试了骨骼不同解剖学区域的力学性能,采用统计方法分析了骨骼力学性能在不同解剖学区域的差异.
1试样制备与试验
1.1压痕试样制备
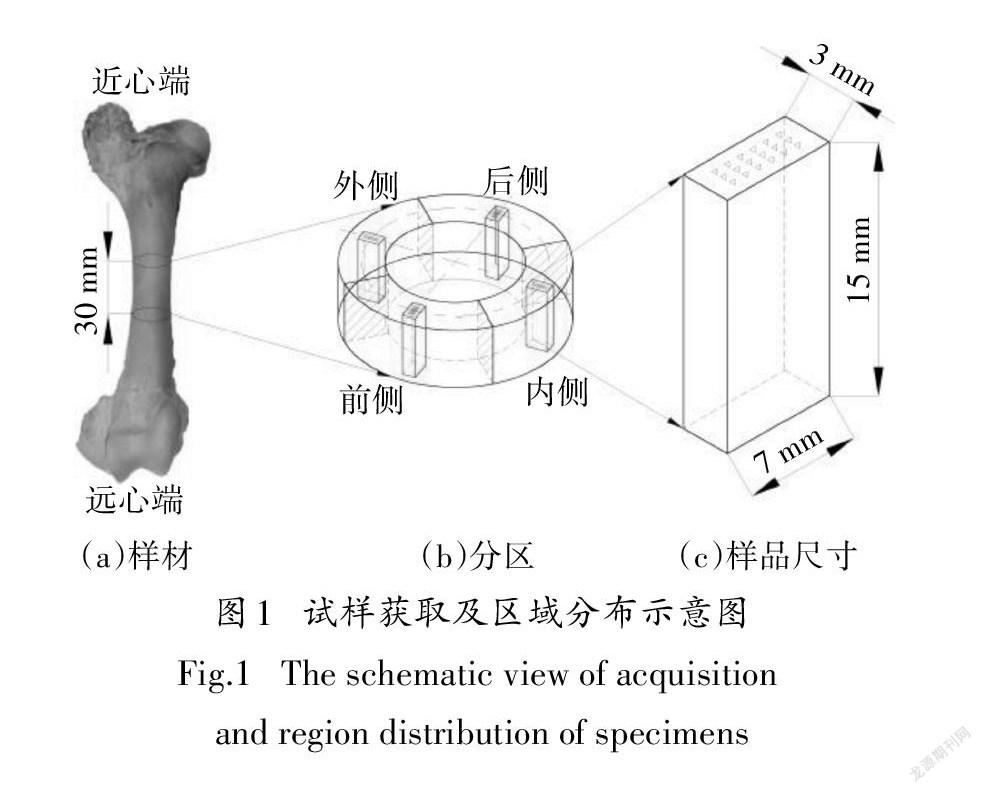
从本地的屠宰场获取一根新鲜的牛股骨,牛的年龄为18-24个月(成年).首先使用手术刀等工具剔除肌肉组织,进行CT检查以排除病变等可能对力学性能有影响的骨骼缺陷.然后使用马克笔在股骨中段标记切割区域,使用手工锯按照标记从骨干中段获取一个厚度为30mm的骨环,如图1(a)所示.再用马克笔在骨环表面按照解剖学区域将骨环划分为前、后、内、外四个区域,使用手工锯将骨环分割成四个扇形块,如图1(b)所示.随后使用马克笔在扇形切片的中部画出长方体试样的横截面(10mm×5mm),使用手工锯切割得到4个10mm×5mm×30mm的长方体试样.最后用粗糙度为320的碳化硅砂纸(ASC,耕耘,中国)对试样表面进行打磨,最终尺寸为7mm×3mm×15mm,如图1(c)所示.在每个试样的六个面标记其方位(近心端P、远心端D)和解剖学区域(前侧A、后侧P、内侧M、外侧L).整个切割和打磨过程不停地喷洒浓度为0.9%的生理盐水,以避免温度过高对骨骼力学性能产生影响.
为方便试样打磨以获得光滑的测试面,通常将骨骼试样镶嵌在某种基材中.有文献表明,环氧树脂具有高黏度和快速固化的特点,能够有效避免环氧树脂渗透到骨骼的孔隙中影响骨骼的纳米压痕试验结果[13].因此,本文选取环氧树脂作为镶嵌基材.镶嵌时,需要将环氧树脂和固化剂按比例混合并搅拌,待混合液清澈后浇注于放置了皮质骨的模具中,在室温下固化后进行脱模以获得环氧树脂包裹的纳米压痕试样,如图2所示.
对镶嵌好的试样进行打磨抛光以确保试样的被测试面达到纳米压痕测试的粗糙度要求.分别使用粗糙度为P600、P1200、P1500、P2500、P4000的碳化硅砂纸(ASC250A,耕耘,中国)依次对试样表面进行打磨,再使用3μm、1μm和0.25μm的抛光绒布
(MPF250A,耕耘,中国)配合相同规格的金刚石悬浮液(MDS,耕耘,中国)对试样进行初抛光,最后采用0.05μm的抛光绒布(MPF250A,耕耘,中国)配合相同颗粒大小的氧化铝悬浮液(OPS,耕耘,中国)进行最终抛光.打磨抛光过程中喷洒0.9%生理盐水保持试样水合.抛光完成后对试样进行超声波洗涤以去除所有残留物.清洗完的试样利用光学显微镜(Pri⁃motech,Zeiss,Germany)观察其表面形貌以确保试样所有试样制备过程中,非处理的试样均用0.9%生理盐水浸润的纱布包裹后放入试管密封,在-20°C环境中冷冻保存.试验前在室温(25°C)环境下将冷冻试样浸入0.9%的生理盐水中解冻水合2h.
1.2纳米压痕试验
使用纳米压痕试验机(NHT3,Anton Paar,Swit⁃zerlandandAustria)[14-19]对试样进行测试,如图4所示,其载荷分辨率和位移分辨率分别为0.02μN和0.01nm.由于玻氏压头具有压头端部曲率半径小、低载荷就能引起材料的塑性變形、接触区域易于表征、清晰度高等优势,在骨骼纳米压痕测试中获得了广泛应用[2,3,13,19-23],因此本文采用玻氏压头进行加载.由于温度及湿度对试验结果有较大影响,典型的测试环境温度范围为10~35°C,相对湿度范围为20%~80%[24],因此本文的测试环境选为室温(25°C),湿度为45%~50%.
测试前使用熔融的石英作为参考样品对机器进行校准[25].本试验采用载荷控制方式进行加载,以80mN/min的恒定速率加载至最大载荷45mN,然后保压10s以消除蠕变效应,最后以80mN/min的恒定速率进行卸载,如图5所示.根据骨环厚度和四个解剖学区域,确定每个试样的中心位置.以中心为基点,沿骨环径向分别向内、向外确定6个点,点间距为1mm;沿骨环切向分别向两侧确定3个点,点间距为0.5mm.在试验过程中,如遇到骨骼孔隙,压痕点在骨环径向平移0.5mm.每个试样测试18个点,如图6所示.4个试样共计72个压痕点.纳米压痕试验输出加载力和压入深度的时间历程曲线,处理得到载荷-位移曲线.利用归一化及再还原方法[26]获得平均载荷-位移曲线.
1.3试验结果处理利用试验输出的载荷-位移曲线,使用Oliver-
Pharr法[25,27]计算测试点的压入模量及硬度.该方法假设卸载曲线初始阶段为线性区域[24,25,27],将卸载曲线在最大压入深度处的斜率作为接触刚度S,如式(1)所示:
式中:F是载荷,h为压入深度,B、b和hf为根据卸载曲线采用最小二乘法拟合得到的系数,hm为最大压入深度.
其次,通过接触刚度S和接触面积的投影面积Ac获得压入折合模量Er,如式(2)所示:
式中:β是与压头形状相关的常数,玻氏压头为1.034[25,27,28];Ac是接触面积,与最初到达最大载荷时的压入深度有关,玻氏压头的面积公式为A=24.5h2c1mm1mm(a)前侧试样.
压入折合模量Er反映压头材料参数以及试样材料参数的复合模量[13],通过式(3)计算试样的压入模内侧内侧量EIT:
式中:v为骨骼的泊松比,通常取0.3[3,13,29];vi为玻氏压头的泊松比,本研究中为0.07;Ei为玻氏压头的压入模量,本研究中为1140GPa.
硬度反映材料抵抗弹塑性变形的能力,可通过最大压入载荷和接触面积的投影面积得到,如式(4)所示:
式中:Fm为最大压入载荷,本文取45mN.
1.4统计分析
本文使用SPSS软件(IBM Corporation,Somers,NY,USA)对压入模量和硬度进行统计学分析.利用Shapiro-Wilks方法进行正态性检验(p》0.05),利用Levene检验进行方差齐性检验(p》0.05).对符合正态分布且满足方差齐性的参数进行单因素方差分析(one-way ANOVA),否则使用非参数Kruskal-Wallis检验,以判断解剖学区域是否显著影响压入模量和硬度.同时,对压入模量和硬度进行组间多重比较;符合方差分析条件时使用Tukey方法,符合非参数检验条件时使用Bonferroni法,以研究骨骼在不同解剖学区域上的力学差异.本研究中,显著性水平取0.05.
2结果
纳米压痕测试得到的各压痕点的载荷-位移曲线和各解剖区域的平均载荷-位移曲线分别如图7和图8所示.
根据纳米压痕测试曲线,计算出的不同解剖学区域的压入模量和硬度如表1所示.分别使用Shapiro-Wilks正态性检验和Levene方差齐性检验分析各解剖学区域的压入模量和硬度是否符合正态分布及方差齐性,结果表明不同解剖学区域的测试点的压入模量不满足正态分布(p<0.05),硬度不满足方差齐性(p<0.05),所以使用非参数Kruskal-Wallis检验分析解剖学区域对压入模量和硬度是否存在显著影响.Kruskal-Wallis检验结果如表2所示,解剖学区域对压入模量(H=34.177,p<0.001)和硬度(H=32.985,p<0.001)均有显著影响.
由于Kruskal-Wallis检验不能给出不同解剖学区域间骨骼的压入模量和硬度是否存在显著差异,进一步采用Bonferroni法进行组间多重比较,如图9所示.对于压入模量,外侧试样最小,内侧试样最大;内侧和前侧试样分别比外侧试样显著高31.6%(p<0.001)和26.8%(p<0.001);内侧试样也比后侧试样显著高15.6%(p=0.006).对于硬度,前侧试样最大,外侧试样最小;前侧、内侧、后侧试样分别比外侧试样显著高46.1%(p<0.001)、30.2%(p<0.001)和37.4%(p=0.003).
3讨论
本研究利用牛股骨皮质骨开展了纳米压痕测试,研究了不同解剖学区域对牛股骨皮质骨压入模量和硬度的影响.与文献相比,本文测试得到的牛股骨皮质骨的平均压入模量(19.32±3.12GPa)与Car⁃nelli等[30]、Isaksson等[31]、Akhtar等[32]的结果基本吻合,略小于Hengsberger等[33]的结果(如图10所示).本文测试得到的牛股骨皮质骨的平均硬度(0.57±0.12GPa)与Akhtar等[32]的结果基本吻合,略小于Carnelli等[30]、Isaksson等[31]的试验结果.本文试验结果略小的原因,可能与本研究所用试样为湿润水合骨骼有关.有文献指出,干燥骨骼的压入模量和硬度比水合骨骼增加20%~30%[34],这种现象不仅存在于牛骨中,在人类骨骼以及其他动物骨骼中也同样存在[34-36].与文献对比(如表3),本试验得到的骨骼不同解剖学区域的压入模量和Li等(2013)[6]、Abdel-Wahab等(2011)[7]的结果吻合,略小于Rasoulian等(2013)[11]的结果,这可能与试样物种有关,本文采用的是牛股骨,而Rasoulian采用的是人类股骨.
本文研究发现,骨骼不同解剖学区域的压入模量之间存在显著差异,不同解剖学部位的压入模量由大到小的顺序为:内侧>前侧>后侧>外侧.这种差异与骨骼各组成成分的含量密切相关.牛股骨皮质骨主要由丛状骨、骨单位以及间质骨构成,其中丛状骨的压入模量最大,骨单位的最小[6].Li等(2013)[6]使用光学显微镜对牛股骨中间骨干横截面进行了光学测试,实验结果表明,牛股骨皮质骨前侧和内侧中丛状骨占多数,后侧和外侧中骨单位占多数.因此,可以推测前侧和内侧区域的压入模量大,而后侧和外侧区域的压入模量小,这与本文的研究结果(内侧显著大于后侧和外侧、前侧显著大于外侧)吻合.有文献指出,骨骼压入模量和硬度之间存在很强的相关性[37](R2=0.68,p<0.01)[21,37].本文的结果也表明,骨骼压入模量和硬度之间有高度的相關性(R2=0.586,p<0.01),例如内侧的压入模量显著大于外侧,并且内侧的硬度也显著大于外侧;前侧的压入模量显著大于外侧,并且前侧的硬度也显著大于外侧.当然,从图7中也可以看出,本文中骨骼不同解剖学区域的压入模量和硬度的显著性差异并不完全一致.原因可能是压入模量代表了骨骼的弹性能力,而硬度更多的是与骨骼的微观破坏机制有关,比如胶原-矿物界面的移动[38-40],这两者分别代表骨骼不同时期的受力情况.另外,有限的试样数量也可能是一个影响因素.
4结论
本文以牛股骨为试验对象,使用纳米压痕测试方法获取载荷-深度曲线,使用Oliver-Pharr法计算了皮质骨试样的压入模量和硬度.非参数Kruskal-Wallis分析表明,牛股骨皮质骨不同解剖学区域的压入模量和硬度存在显著差异(p<0.001).组间多重比较表明,前侧试样的压入模量和硬度显著高于外侧试样,内侧试样的压入模量和硬度显著高于外侧试样,后侧试样的硬度显著高于外侧试样,内侧试样的压入模量显著高于外侧试样.在建立长骨有限元模型时,有必要采用非均一的材料模拟骨骼的生物力学响应.
参考文献
[1] PATHAK S,SWADENER J G,KALIDINDI S R,et al.Measuring the dynamic mechanical response of hydrated mouse bone by na⁃noindentation[J]. J Mech Behav Biomed Mater,2011,4(1): 34-43.
[2] WAHAB A A A,SILBERSCHMIDT V V.Plastic behaviour of mi⁃crostructural constituents of cortical bone tissue:a nanoindentation study[J]. International Journal of Experimental and Computa⁃tional Biomechanics,2013,2(2):136.
[3] FENG L,CHITTENDEN M,SCHIRER J,et al.Mechanical prop⁃erties of porcine femoral cortical bone measured by nanoindenta⁃tion[J].Journal of Biomechanics,2012,45(10):1775-1782.
[4] BONNEY H,COLSTON B J,GOODMAN A M.Regional varia⁃tion in the mechanical properties of cortical bone from the porcine femur[J]. Medical Engineering & Physics,2011,33(4): 513-520.
[5] LI S M,ABDEL-WAHAB A,SILBERSCHMIDT V V.Analysis of fracture processes in cortical bone tissue[J].Engineering Frac⁃ture Mechanics,2013,110:448-458.
[6] LI S M,DEMIRCI E,SILBERSCHMIDT V V.Variability and an⁃isotropy of mechanical behavior of cortical bone in tension and compression[J].Journal of the Mechanical Behavior of Biomedi⁃cal Materials,2013,21:109-120.
[7] ABDEL-WAHAB A A,ALAM K,SILBERSCHMIDT V V. Analysis of anisotropic viscoelastoplastic properties of cortical bone tissues[J].Journal of the Mechanical Behavior of Biomedi⁃cal Materials,2011,4(5):807-820.
[8] DUCHEMIN L,BOUSSON V,RAOSSANALY C,et al.Predic⁃tion of mechanical properties of cortical bone by quantitative com⁃puted tomography[J].Medical Engineering & Physics,2008,30 ( 3 ):3 2 1 - 3 2 8 .
[9] ESPINOZA ORÍAS A A,DEUERLING J M,LANDRIGAN M D,et al.Anatomic variation in the elastic anisotropy of cortical bone tissue in the human femur[J].Journal of the Mechanical Behav⁃ior of Biomedical Materials,2009,2(3):255-263.
[10] MALO M K H,ROHRBACH D,ISAKSSON H,et al.Longitudi⁃nal elastic properties and porosity of cortical bone tissue vary with ageinhumanproximalfemu[r J].Bone,2013,53(2):451-458.
[11] RASOULIAN R,RAEISI NAJAFI A,CHITTENDEN M,et al. Reference point indentation study of age-related changes in por⁃cine femoral cortical bone[J].Journal of Biomechanics,2013,46 ( 1 0 ):1 6 8 9 - 1 6 9 6 .
[12] BOSIAKOV S M,ALEKSEEV D V,SILBERSCHMIDT V V,et al. Effect of surgical defect localization on ultimate load-bearing ca⁃pacity of human femur:finite-element energy-based assessment [J].Procedia Structural Integrity,2017,6:27-33.
[13] RODRIGUEZ-FLOREZ N,OYEN M L,SHEFELBINE S J. In⁃sight into differences in nanoindentation properties of bone[J]. Journal of the Mechanical Behavior of Biomedical Materials,2013, 1 8 :9 0 - 9 9 .
[14] HERBSTER M,DÖRING J,NOHAVA J,et al.Retrieval study of commercially available knee implant coatings TiN,TiNbN and ZrN on TiAl6V4 and CoCr28Mo[6 J].J Mech Behav Biomed Mater, 2 0 2 0 ,1 1 2 :1 0 4 0 3 4 .
[15] JUNE Y G,JUNG K I,LEE D G,et al. Influence of functional group content in hydroxyl-functionalized urethane methacrylate oligomers on the crosslinking features of clearcoats[J].Journal of Coatings Technology and Research,2021,18(1):229-237.
[16] JUNG K I,HWANG S O,KIM N H,et al.Effect of methacryloxy⁃propyl and phenyl functional groups on crosslinking and rheologi⁃cal and mechanical properties of ladder-like polysilsesquioxane hard coatings[J]. Progress in Organic Coatings,2018,124: 129-136.
[17] JUNG K I,KIM B,LEE D G,et al. Characteristics of dual- curable blocked isocyanate with thermal radical initiator for low- temperature curing of automotive coatings[J]. Progress in Or⁃ganic Coatings,2018,125:160-166.
[18] KIM N H,YOON S,JUNG K I,et al.Crosslinking behaviors and mechanical properties of curable PDMS and PEG films with vari⁃ous contents of glycidyl methacrylate[J].Journal of Applied Poly?mer Science,2019,136(7):47088.
[19] SEMAAN M,KARAM E,BARON C,et al.Estimation of the elas?tic modulus of child cortical bone specimens via microindentation [J].Connective Tissue Research,2019,60(4):399-405.
[20] MIRZAALI M J,SCHWIEDRZIK J J,THAIWICHAI S,et al.Me⁃chanical properties of cortical bone and their relationships with age,gender,composition and microindentation properties in the el⁃d e r l y[ J ]. B o n e ,2 0 1 6 ,9 3 :1 9 6 - 2 1 1 .
[21] CASANOVA M,BALMELLI A,CARNELLI D,et al.Nanoinden⁃tation analysis of the micromechanical anisotropy in mouse cortical bone[J].Royal Society Open Science,2017,4(2):160971.
[22] SUN X D,GUO Y,LI L J,et al.Influence and evolution mecha⁃nism of different sharpness contact forms to mechanical property of cortical bone by nanoindentation[J].AIP Advances,2018,8(3): 035313.
[23] ASGARI M,ABI-RAFEH J,HENDY G N,et al.Material anisot⁃ropy and elasticity of cortical and trabecular bone in the adult mouse femur via AFM indentation[J].Journal of the Mechanical Behavior of Biomedical Materials,2019,93:81-92.
[24] ZHANG T H. Micro- and nano-mechanical testing techniques - Instrumental pressing measurement, analysis, application and standardization[M]. Beijing:Science Press,2013.
[25] OLIVER W C,PHARR G M.Measurement of hardness and elas⁃tic modulus by instrumented indentation:Advances in understand⁃ing and refinements to methodology[J].Journal of Materials Re⁃s e a r c h ,2 0 0 4 ,1 9( 1 ):3 - 2 0 .
[26] LESSLEY D,CRANDALL J,SHAW G,et al. A normalization technique for developing corridors from individual subject re⁃sponses[C]//SAE Technical Paper Series. 400 Commonwealth Drive,Warrendale,PA,United States:SAE International,2004.
[27] OLIVER W C,PHARR G M. An improved technique for deter⁃mining hardness and elastic modulus using load and displacement sensing indentation experiments[J]. Journal of Materials Re⁃s e a r c h ,1992 ,7( 6 ):1 5 6 4 - 1 5 8 3 .
[28] ZHANG T H. Micro- and nano-mechanical testing techniques - Instrumental pressing measurement,analysis,application and standardization[M]. Beijing:Science Press,2013.
[29] PAIETTA R C,CAMPBELL S E,FERGUSON V L.Influences of spherical tip radius,contact depth,and contact area on nanoinden⁃tation properties of bone[J].Journal of Biomechanics,2011,44 ( 2 ):2 8 5 - 2 9 0 .
[30] CARNELLI D,LUCCHINI R,PONZONI M,et al.Nanoindenta⁃tion testing and finite element simulations of cortical bone allowing for anisotropic elastic and inelastic mechanical response[J].Jour⁃nal of Biomechanics,2011,44(10):1852-1858.
[31] ISAKSSON H,NAGAO S,MAŁKIEWICZ M,et al. Precision of nanoindentation protocols for measurement of viscoelasticity in cor⁃tical and trabecular bone[J].Journal of Biomechanics,2010,43 ( 1 2 ):2 4 1 0 - 2 4 1 7 .
[32] AKHTAR R,MORSE S,MUMMERY P M. Nanoindentation of
bone in a physiological environmen[t J].MRS Proceedings,2004, 8 4 4 :Y 2 . 9 / R 2 . 9 .
[33] HENGSBERGER S,ENSTROEM J,PEYRIN F,et al.How is the indentation modulus of bone tissue related to its macroscopic elas⁃tic response?A validation study[J].Journal of Biomechanics, 2 0 0 3 ,3 6( 1 0 ):1 5 0 3 - 1 5 0 9 .
[34] RHO J Y,PHARR G M. Effects of drying on the mechanical prop⁃erties of bovine femur measured by nanoindentation[J]. J Mater Sci Mater Med,1999,10(8):485-488.
[35] HOFFLER C E,GUO X E,ZYSSET P K,et al.An application of nanoindentation technique to measure bone tissue lamellae proper⁃ties[J]. Journal of Biomechanical Engineering,2005,127(7): 1046-1053.
[36] HOFMANN T,HEYROTH F,MEINHARD H,et al. Assessment of composition and anisotropic elastic properties of secondary os⁃teon lamellae[J].Journal of Biomechanics,2006,39(12):2282- 2294.
[37] YANG R,ZHANG T H,JIANG P,et al.Experimental verification and theoretical analysis of the relationships between hardness, elastic modulus,and the work of indentation[J].Applied Physics L e t t e r s ,2 0 0 8 ,9 2( 2 3 ):2 3 1 9 0 6 .
[38] MERCER C,HE M Y,WANG R,et al.Mechanisms governing the inelastic deformation of cortical bone and application to tra?becular bone[J].Acta Biomaterialia,2006,2(1):59-68.
[39] CARDEN A,RAJACHAR R M,MORRIS M D,et al.Ultrastruc⁃tural changes accompanying the mechanical deformation of bone tissue:a Raman imaging study[J].Calcified Tissue International, 2 0 0 3 ,7 2( 2 ):1 6 6 - 1 7 5 .
[40] FANTNER G E,HASSENKAM T,KINDT J H,et al.Sacrificial bonds and hidden length dissipate energy as mineralized fibrils separate during bone fracture[J].Nature Materials,2005,4(8): 612-616.

