卡瑞利珠单抗免疫治疗晚期食管癌的临床疗效
付禄
(江西省吉安市中心人民医院肿瘤科,江西 吉安 343000)
食管癌是原发于食管上皮的恶性肿瘤,常见病因有吸烟、酗酒、食用发霉和热烫食物,晚期食管癌在我国具有较高的发病率和病死率。以往,晚期食管癌患者治疗主要依靠放疗和化疗[1]。目前,临床上晚期食管癌患者常用的免疫治疗药物为卡瑞利珠或帕博丽珠单抗[2-3]。卡瑞利珠单抗是2019年获批上市的一种癌症治疗药物,可对肝癌、食管癌等恶性肿瘤疾病进行免疫治疗,抑制恶性肿瘤增生,促使肿瘤细胞坏死,临床疗效显著[4],但放化疗不良反应较大,而免疫治疗具有疗效确切、不良反应小等优点。本研究旨在探讨卡瑞利珠单抗免疫治疗对晚期食管癌患者的临床疗效、安全性及对患者生活质量和营养状态的影响,现报道如下。
1 资料与方法
1.1 临床资料 选取2019年8月至2020年8月于本院就诊的晚期鳞癌型食管癌患者48例作为研究对象,其中男32例,女16例;平均年龄(53.48±5.35)岁。
1.2 诊断标准 参照《食管癌诊疗规范(2018年版)》[5]中食管癌的诊断标准:①临床上出现进食困难或无法进食,胸骨后针刺、灼烧样疼痛;②胸部CT显示食管壁增厚;③食管造影显示食管黏膜局部粗糙、食管壁局部硬化、溃疡等现象;④内镜或活检确诊为癌;⑤影像学检查显示肿瘤侵犯邻近组织,如肺膜、腹膜、心包等;⑥影像学检查显示肿瘤侵犯脊椎、主动脉等肺部非邻近组织,区域淋巴结转移<6个;⑦影像学检查显示出现原发性肿瘤,区域淋巴结转移>7个。患者符合①②③④,且符合⑤⑥⑦中任意一项即为确诊为晚期食管癌。
1.3 纳入及排除标准 纳入标准:符合上述诊断标准;年龄30~80岁;患者或家属签署知情同意书;卡式(KPS)评分>40分,体力状况评分≤3分;预估生存时间>6个月;肿瘤无远处转移。排除标准:对本研究药物有过敏反应和禁忌证;合并其他严重疾病,如心脑血管疾病、肝肾功能异常;合并意识障碍或认知障碍。
1.4 方法 患者均接受相同的基础治疗(放化疗、适量运动、心理辅导),在此基础上使用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字S20190027,规格:200 mg)进行免疫治疗。用法用量:卡瑞利珠单抗注射剂200 mg+250 ml 0.9%氯化钠溶液,采用无菌技术复溶和稀释后静脉滴注给药,滴注时间60 min(首次90 min),每3周治疗1次,持续治疗3个月。
1.5 观察指标 ①临床疗效:参照RECIST疗效评价标准(2000)判定患者临床疗效。完全缓解(CR):CT检查显示,除目标结节灶外,其他目标病灶彻底消失;目标结节灶短轴均缩小至10 mm以下,所有目标病灶均需检查。部分缓解(PR):所有可测量目标病灶的直径总和<基线的30%;目标结节灶总和使用短径,而其他所有目标病灶的总和使用最长直径;所有目标病灶均需检查。疾病进展(SD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如基线测量值最小,就以基线值为参照);此外,需满足直径和的绝对值增加>5 mm(出现一个或多个新病灶也视为疾病进展)。疾病稳定(PD):所有目标病灶缩小的程度未达到PR,增加的程度也未达到PD水平,介于两者之间,研究时可将直径之和的最小值作为参考。客观缓解率(ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%。②营养状态:检测治疗前后患者营养风险筛查2002(NRS2002)评分及整体营养状况主观评估(PG-SGA)评分。PGSGA评分共4个方面,满分22分;NRS2002评分共3个方面,满分7分;两个评分与患者营养状态呈负相关,评分越高表明患者营养状态越差;抽取患者肘部静脉血,使用酶联免疫法检测治疗前后患者血清总蛋白(TP)及白蛋白(ALB)指标。③免疫功能:采用流式细胞仪检测两组治疗前后T淋巴细胞亚群情况,包括成熟T淋巴细胞(CD3+)、诱导性T细胞/辅助性T细胞(CD4+)、抑制性T细胞/细胞毒性T细胞(CD8+)、CD4+/CD8+、B细胞/淋巴细胞(CD19+)。④不良反应:包括毛细血管增生症、咳嗽、头痛、发热、肺部感染。
1.6 统计学方法 采用SPSS 23.0统计学软件分析数据,计量资料以“±s”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 60例患者中,完全缓解0例,部分缓解24例(40.00%),疾病进展18例(30.00%),疾病稳定18例(30.00%),客观缓解率为40.00%(24/60),疾病控制率为70.00%(42/60)。
2.2 患者治疗前后营养状态比较 治疗后,患者PG-SGA评分、NRS2002评分均低于治疗前,TP、ALB均高于治疗前,差异有统计学意义(P<0.05),见表1。
表1 患者治疗前后营养状态比较(±s)
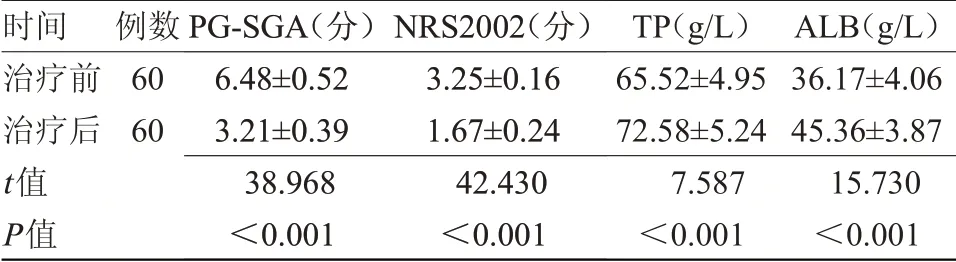
表1 患者治疗前后营养状态比较(±s)
注:PG-SGA,整体营养状况主观评估;NRS2002,营养风险筛查2002;TP,总蛋白;ALB,白蛋白
时间治疗前治疗后t值P值例数60 60 PG-SGA(分)6.48±0.52 3.21±0.39 38.968<0.001 NRS2002(分)3.25±0.16 1.67±0.24 42.430<0.001 TP(g/L)65.52±4.95 72.58±5.24 7.587<0.001 ALB(g/L)36.17±4.06 45.36±3.87 15.730<0.001
2.3 患者治疗前后免疫功能比较 治疗后,患者血清CD3+、CD4+、CD8+、CD4+/CD8+、CD19+均高于治疗前,差异有统计学意义(P<0.05),见表2。
表2 患者治疗前后免疫功能比较(±s)
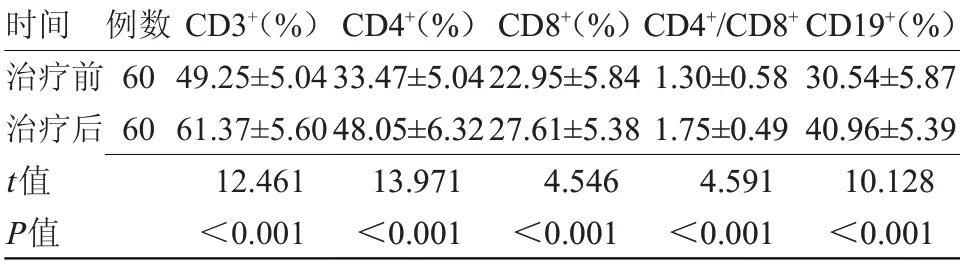
表2 患者治疗前后免疫功能比较(±s)
注:CD3+,成熟T淋巴细胞;CD4+,诱导性T细胞/辅助性T细胞;CD8+,抑制性T细胞/细胞毒性T细胞;CD19+,B细胞/淋巴细胞
时间治疗前治疗后t值P值例数60 60 CD3+(%)49.25±5.04 61.37±5.60 12.461<0.001 CD4+(%)33.47±5.04 48.05±6.32 13.971<0.001 CD8+(%)22.95±5.84 27.61±5.38 4.546<0.001 CD4+/CD8+1.30±0.58 1.75±0.49 4.591<0.001 CD19+(%)30.54±5.87 40.96±5.39 10.128<0.001
2.4 不良反应 治疗后,患者出现毛细血管增生症3例,头痛1例,发热1例,肺部感染1例,不良反应发生率为10.00%(6/60)。
3 讨论
食管癌是发生于食管上皮组织的恶性肿瘤,多为鳞状细胞癌,病因多样,吸烟、酗酒、不良饮食习惯等因素均可引发食管癌,我国是全球食管癌高发国家[6]。食管癌早期临床症状不明显,患者于医院就诊时通常已进入中晚期,晚期食管癌患者的主要治疗方法有放疗、化疗、手术、免疫治疗。食管紧邻多条动脉和神经,手术切除食管肿瘤易造成大出血和神经损伤,食管癌患者以中老年人居多,手术风险较大,且晚期的食管癌患者随着疾病进展,恶性肿瘤细胞扩散范围越大,手术难以根除,术后病情易复发,临床上晚期食管癌患者基本上不建议手术治疗。放疗和化疗可有效杀灭恶性肿瘤细胞,抑制恶性肿瘤细胞增殖和扩散,但放疗和化疗在杀伤恶性肿瘤细胞的同时也会杀灭正常细胞,损害患者的免疫功能,患者放化疗后会出现呕吐、脱发、腹泻等强烈不良反应[7-8]。晚期食管癌免疫治疗通常是使用PD-1单抗或PD-L1单抗药物,卡瑞利珠单抗是一种PD-1单抗药物,PD-1是一种重要的肿瘤免疫抑制调控因子,能抑制机体自身应答,促进肿瘤细胞的增殖和扩散。卡瑞利珠单抗可与PD-1受体结合,切断PD-1/PD-L1信号通路,增强自身免疫,发挥抑制肿瘤细胞生长的作用。本研究中,治疗后,患者客观缓解率为41.00%,疾病控制率为70.00%,表明卡瑞利珠单抗治疗晚期食管癌疗效明显,能有效改善患者免疫功能。
PD-1单抗在切断肿瘤PD-1/PD-L1信号通路的时,也切断了其他正常组织器官的PD-1/PD-L1信号通路,导致正常组织器官免疫功能紊乱,发生咳嗽、头痛、发热、肺部感染等不良反应。毛细血管增生症是卡瑞利珠单抗的特异性不良反应,也是最常见的不良反应,发生机制目前尚不明确,一般认为卡瑞利珠单抗能与靶外组织器官受体特异性结合,刺激血管内皮细胞增殖,造成毛细血管增生症[9]。本研究中,晚期食管癌患者使用卡瑞利珠单抗的不良反应发生率为10.00%,相比同类PD-1单抗或PD-L1单抗,卡瑞利珠的不良反应发生率较低,安全性高[10]。
晚期食管癌患者由于腹痛、腹胀、食管梗阻、食管溃疡和放化疗的不良反应等因素,进食困难,缺少食欲,易导致患者营养不良,免疫功能下降,部分患者食管溃疡引发出血贫血,使患者营养状态进一步恶化。卡瑞利珠单抗具有抗肿瘤的作用,在治疗晚期食管癌时,可促使食管恶性肿瘤缩小,恢复患者进食能力,可间接改善患者营养状态。免疫治疗可降低放化疗的不良反应,减轻患者痛苦,恢复患者食欲。本研究结果显示,治疗后,患者PG-SGA评分、NRS2002评分均低于治疗前,TP、ALB均高于治疗前,差异有统计学意义(P<0.05)。治疗后,患者血清CD3+、CD4+、CD8+、CD4+/CD8+、CD19+均高于治疗前,差异有统计学意义(P<0.05)。
综上所述,卡瑞利珠单抗免疫治疗晚期食管癌效果显著,具有良好的疗效和安全性,能有效改善患者生活质量和营养状态,值得临床推广应用。

