空化射流条件下大豆分离蛋白糖基化产物乳液特性研究
王中江 郭亚男 任双鹤 李柏良,2 孟凡迪 郭增旺
(1.东北农业大学食品学院, 哈尔滨 150030; 2.山东省禹王生态食业有限公司, 德州 253000)
0 引言
大豆蛋白质含量丰富,质量分数通常在40%~50%之间[1]。而且大豆蛋白更符合人体必需氨基酸组成、含量充足,且相比较于其他植物蛋白,消化吸收率较高,是一种优质植物蛋白资源[2-3],并因其良好的功能特性在食品领域中得到了广泛的应用。但常规生产的大豆蛋白功能特性不稳定,受环境因素影响较大,因此引入适当的改性手段对大豆蛋白结构和功能进行改善是生产专用型蛋白的常用手段。糖基化属于化学改性法,是将蛋白质分子中的氨基与还原糖中的羰基以共价键的形式相结合发生一系列复杂反应[4],得到蛋白质-多糖复合物。研究发现,蛋白质与糖共价复合后其稳定性大大增强,不易受pH值、温度等外界因素变化的影响[5],且该方法成本低、条件温和、操作简单,得到的改性产物具有较好的溶解性、乳化性、稳定性等特性[6]。但在糖基化改性处理过程中,干热法反应时间较长、反应条件难以控制、工业生产困难,而湿热法接枝效果不佳,从而限制了糖基化在蛋白改性中的应用[7]。因此,需要利用外场辅助技术复合糖基化改性蛋白质。目前用于改善糖基化的辅助技术主要有超声波、高压均质、动态高压微射流等,但超声处理的改性效果不显著,高压均质和动态高压微射流难以实现产业化生产[8],均不能很好地应用于辅助糖基化生产改性大豆蛋白。
空化射流是含有空化现象的水射流,属于外场辅助手段的一种,可以产生空化效应。通过人为手段使液流系统中的局部压力低于相应温度下该液体的饱和蒸气压,诱导液体迅速汽化形成许多空泡,这些空泡随液体流入高压区后,发生收缩、渍灭,产生空化效应[9-10],这种空化效应能够诱导和强化生物大分子物理、化学以及结构性质的变化[10]。已有研究表明,空化射流能够辅助糖基化改善大豆蛋白的结构和溶解性、乳化性等功能性质[7],但空化射流技术能否对糖基化产物乳液特性起到改善作用尚不明确。
因此,为了探究空化射流对大豆蛋白糖基化产物乳液特性的影响,本文以大豆分离蛋白、葡萄糖、葡聚糖为原料,采用空化射流辅助湿热法糖基化反应分别制备大豆分离蛋白-葡萄糖、大豆分离蛋白-葡聚糖共价复合物乳液,并对其进行空化射流处理,通过测定乳液粒径、ζ-电位、微观结构、乳析指数、蛋白质吸附率及抗氧化性(还原力、DPPH自由基清除能力),进一步探讨空化射流时间(20、40、60、80、100、120 min)对大豆分离蛋白糖基化产物乳液特性的影响,以期为研究空化射流辅助湿法糖基化对蛋白乳液特性的影响及空化射流处理在食品方面的应用提供前期理论参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(SPI,纯度94.2%),山东禹王生态食业有限公司;葡萄糖(分析纯),中国医药集团上海化学试剂有限公司;葡聚糖(分子质量10 000 ku,分析纯),中国医药集团上海化学试剂有限公司;大豆油,九三粮油工业集团有限公司;磷酸盐缓冲溶液粉剂,索莱宝生物科技有限公司;0.000 1 g/mL尼罗红和0.001 g/mL尼罗蓝,美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
电子分析天平(0.000 1 g),北京赛多利斯仪器系统有限公司;THZ-80型水浴恒温振荡器,江苏金坛亿通电子有限公司;空化射流机,北京中森汇嘉科技发展有限责任公司;FD5-3型冷冻干燥机,美国SIM公司;JJ-1型增力电动搅拌器,江苏省金坛市金城国胜实验仪器厂;ZetaPALS型ζ-电位仪,美国布鲁克海文仪器公司;Malvern Mastersizer 2000型激光粒度仪,英国马尔文仪器有限公司;F-4500型荧光分光光度计,日本HITACHI公司。
1.3 大豆分离蛋白糖基化产物乳液制备
将SPI与葡萄糖、葡聚糖分别以质量比4∶1溶于磷酸盐缓冲溶液(pH值7.5、0.2 mol/L),室温(20℃)下搅拌2 h至完全溶解,配制成蛋白质量浓度为5 g/(100 mL)的样品溶液。将样品置于80℃恒温水浴锅预热后,用空化射流机分别辅助处理0、20、40、60、80、100、120 min,过程中始终保持处理温度为80℃。各处理后样品在80℃水浴条件下继续加热,控制样品糖基化反应总时长均为6 h。反应结束后,将样品迅速冷却至室温,离心后的上清液于蒸馏水中透析24 h(4℃),冷冻干燥后将样品粉末溶于磷酸盐缓冲溶液中(0.01 mol/L,pH值7.0),为抑制微生物生长,可向溶液中添加0.000 1 g/mL的NaN3并在室温下搅拌2 h后于4℃静置12 h使蛋白水合充分。次日10 000g离心20 min后取上清液,测定上清液蛋白浓度并稀释一定倍数,添加一定量大豆油,使得乳状液中蛋白质量浓度为5 mg/mL,油质量分数为10%。再用高速乳化机(20 000 r/min)乳化1 min。空白样品为未经射流空化处理SPI-葡萄糖、SPI-葡聚糖共价复合物乳液。
1.4 乳液ζ-电位和平均粒径测定
采用 Malvern Zetasizer Nano ZS型电位及粒度分布仪测定乳液的ζ-电位。利用Malvern Mastersizer 2000 型激光粒度仪测定乳液液滴的直径[11]。乳液液滴的平均粒径采用体积平均直径d43来表示。
1.5 乳液微观结构观察
采用激光共聚焦显微镜(CLSM)对新制乳液的微观结构进行观察。避光条件下取1 mL乳液,加入40 μL 荧光染料(0.000 1 g/mL尼罗红和0.001 g/mL尼罗蓝),混合均匀后,吸取20 μL待测乳液样品滴于载玻片上,确保样品中没有气泡,盖上盖玻片。观察时倒置于显微镜上,光的激发波长分别为488 nm和633 nm,采用 LAS AF Lite软件对乳液液滴图像进行处理。
1.6 蛋白吸附率测定
蛋白吸附率的测定参照文献[12]的方法稍作改动。将新制备的乳液在10 000g下离心30 min使得乳液分为油、水两相:乳析的油相在顶部,而水相和沉淀置于底部。用注射器小心除去乳析层,水相中未吸附的蛋白浓度采用Lowry法测定。界面蛋白吸附率计算公式为
(1)
式中Ci——初始液相蛋白质量浓度,kg/m3
Ceq——未吸附蛋白质量浓度,kg/m3
1.7 乳析指数测定
乳析指数的测定参照文献[13]的方法稍作改动。将新鲜制备的乳液注入10 mL样品瓶中(高100 mm,内径15 mm),用玻璃盖密封并置于25℃下进行储藏,测定乳液在14 d内的乳状液总高度及分层后的下层清液高度。乳析指数计算公式为
(2)
式中Hs——分层后的下层清液高度
Ht——乳状液总高度
1.8 乳液抗氧化性测定
1.8.1还原力测定
还原力的测定参照文献[14]的方法稍作改动。取5 mg/mL样品溶液0.5 mL,加入2.5 mL磷酸盐缓冲液(浓度0.2 mol/L,pH值6.6)和2.5 mL质量浓度0.01 g/mL的铁氰化钾溶液,混合均匀后置于50℃恒温水浴反应20 min,经迅速冷却后加入2.5 mL质量浓度0.1 g/mL的三氯乙酸溶液,将混合物在25℃、3 000 r/min条件下离心10 min。取2.5 mL上层清液,加入2.5 mL蒸馏水和0.5 mL质量浓度0.001 g/mL的氯化铁溶液,混合均匀后静置10 min,然后测定其在700 nm处吸光度。
1.8.2DPPH自由基清除能力测定
DPPH自由基清除能力测定参照文献[15-16]的方法稍作改动。新鲜配制4 mL 0.12 mmol/L DPPH-乙醇溶液并保持避光保存,取2 mL的上述溶液加入1 mL一定浓度的样品溶液,充分混合均匀,在室温下置于黑暗中反应30 min,如果有沉淀物,将混合物在750g下离心5 min。然后测定上清液在517 nm处的吸光度。对照用去离子水代替样品溶液,空白则用无水乙醇代替DPPH-乙醇溶液。DPPH自由基清除率计算公式为
(3)
式中Ac——未加样品的DPPH溶液吸光度
As——加样品的DPPH溶液吸光度
A0——样品溶液吸光度
1.9 数据统计及分析
所有的实验重复3次,结果用平均值±标准差表示,采用SPSS 19.0软件对实验数据进行ANOVA显著性分析,P<0.05为显著性差异,采用Origin 9.1软件制图对实验数据进行分析。
2 结果与分析
2.1 粒径分布
SPI-葡萄糖共价复合物乳液的粒径分布与平均粒径如图1、2(图中不同字母表示差异显著,下同)所示。
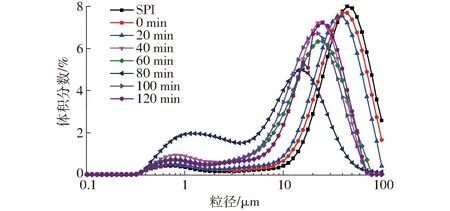
图1 不同空化射流时间下SPI-葡萄糖共价复合物乳液的粒径分布Fig.1 Emulsion particle size distribution of SPI-glucose conjugates under different cavitation jet treatment times

图2 不同空化射流时间下SPI-葡萄糖共价复合物乳液的平均粒径Fig.2 Emulsion average particle size of SPI-glucose conjugates under different cavitation jet treatment times
食品乳液属于多分散体系,乳液的理化特性与其液滴特性紧密相关,液滴的大小、界面特性、液滴间的相互作用都影响了乳液的性质,其液滴粒径对乳液稳定性有重要作用。一般来说,液滴粒径越小,其分布越均一,乳液的稳定性越好。由图1、2可知,与未处理SPI和普通糖基化产物相比,空化射流辅助可以使接枝物乳液的平均粒径降低,空化射流处理80 min时,乳液平均粒径最小,接枝物乳液粒径呈双峰分布特征,空化射流处理后的SPI-葡萄糖共价复合物的乳液粒径都在小粒径范围内分布更多。空化射流产生的高速湍流剪切作用、瞬间流道高压力差和分子对冲撞击效应能够使大分子蛋白解离[17],同时由于空化射流辅助糖基化可以使蛋白乳化性提高,使蛋白能够更好地在液滴表面吸附,分散在油-水界面上形成界面膜,从而减少了蛋白聚沉的可能性,所以乳液的粒径明显降低。空化射流处理时间超过100 min后,乳液粒径增大,可能是空化射流过度造成了乳液中蛋白聚沉。文献[7]表明蛋白聚沉作用并不是由共价键如分子间的二硫键导致,而是由疏水作用等非共价键导致。所以接枝物的聚沉可能是蛋白分子间形成了疏水作用导致的。
SPI-葡聚糖共价复合物乳液的粒径分布与平均粒径如图3、4所示。
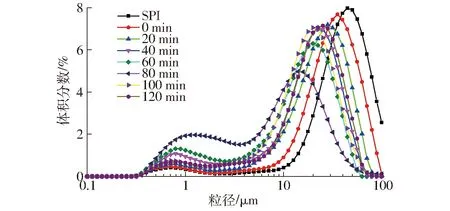
图3 不同空化射流时间下SPI-葡聚糖共价复合物乳液的粒径分布Fig.3 Emulsion particle size distribution of SPI-dextran conjugates under different cavitation jet treatment times
由图3、4可知,接枝物乳液粒径呈双峰分布特征,且与SPI-葡萄糖共价复合物乳液相比,SPI-葡聚糖共价复合物的乳液粒径在小粒径范围内分布更多。SPI-葡聚糖共价复合物的乳液平均粒径在空化射流处理60 min后开始明显降低,且比SPI-葡萄糖共价复合物的平均粒径更小,这是由于SPI-葡聚糖共价复合物的空间位阻效应能够有助于对乳液中液滴的聚集沉降起到更好的抑制作用,从而促进了乳液中小液滴的形成,所以相较于SPI-葡萄糖共价复合物可以更好地提高O/W(水包油)乳液的稳定性,从而更好地维持较小的乳液液滴[18-21]。文献[22-23]证实了共价结合亲水性多糖使亲水区域变得更大,油滴的曲率增大,从而减小颗粒尺寸。文献[24]发现单独加热大豆分离蛋白24 h,由于SPI的聚集,颗粒尺寸会急剧增大。与葡聚糖接枝后,加热体系乳化性降低不明显,证明葡聚糖与SPI共价结合可以有效抑制蛋白聚集。空化射流处理时间超过100 min后,接枝物乳液粒径会明显增大,可能是空化射流过度使乳液中蛋白聚集造成的。
2.2 ζ-电位
SPI-葡萄糖共价复合物乳液的ζ-电位如图5所示。
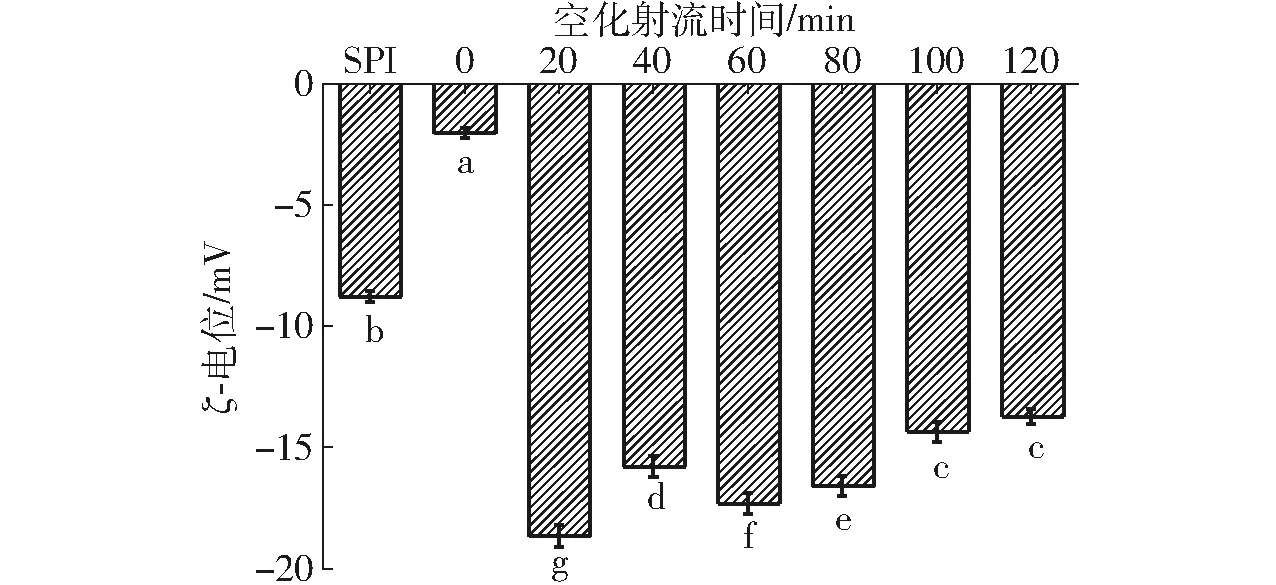
图5 不同空化射流时间下SPI-葡萄糖共价复合物乳液的ξ-电位Fig.5 Emulsion ζ-potential value of SPI-glucose conjugates under different cavitation jet treatment times
ζ-电位是表征胶体分散体系稳定性的重要指标。分子或分散粒子越小,ζ-电位(正或负)绝对值越高,颗粒间排斥力越大,体系越稳定;反之,ζ-电位的绝对值越低,体系中颗粒由于排斥力较小越倾向于凝结或聚集,使得粒径增大[25]。由图5可知,一般糖基化反应得到的SPI-葡萄糖共价复合物的ζ-电位与未处理SPI相比显著降低,但粒径分析表明糖基化反应后的乳液体系比未处理SPI更加稳定,所以电荷不是接枝物乳液体系稳定性的决定性因素。接枝物ζ-电位的降低可能是由于SPI与葡萄糖发生了共价结合,导致糖链吸附在油滴表面从而屏蔽了蛋白质表面的电荷。短时间空化射流辅助处理使SPI-葡萄糖共价复合物乳液的ζ-电位明显升高,空化射流处理20 min时,ζ-电位为-18.53 mV。这是由于空化射流会使蛋白高级结构被破坏,蛋白电荷暴露。随着空化射流辅助时间的增长,SPI-葡萄糖共价复合物乳液的ζ-电位呈减小趋势,这可能是因为空化射流促进了SPI与葡萄糖共价结合,使蛋白表面电荷又被新共价结合的糖链所屏蔽,同时过度空化会导致蛋白发生聚集,部分电荷又被包埋在蛋白分子内部,从而使ζ-电位有所下降。
SPI-葡聚糖共价复合物的ζ-电位如图6所示。

图6 不同空化射流时间下SPI-葡聚糖共价复合物乳液的ζ-电位Fig.6 Emulsion ζ-potential value of SPI-dextran conjugates under different cavitation jet treatment times
由图6可知,一般的糖基化反应会使接枝物粒径显著降低,这可能是由少量中性葡聚糖吸附到油滴界面屏蔽蛋白电荷造成的。空化射流处理后,SPI-葡聚糖共价复合物乳液的ζ-电位明显升高,并且大于SPI-葡萄糖共价复合物的ζ-电位,最大值为-20.53 mV。这可能是因为空化射流使蛋白电荷暴露后,共价结合葡聚糖的空间位阻效应可以防止乳液液滴的聚集和聚结,从而导致ζ-电位增大,与文献[22]研究燕麦蛋白与葡聚糖接枝反应的结果一致。综上所述,SPI-葡聚糖共价复合物制备的乳液具有更好的储藏稳定性。
2.3 乳液微观结构观察
SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液的液滴微观结构如图7、8所示。
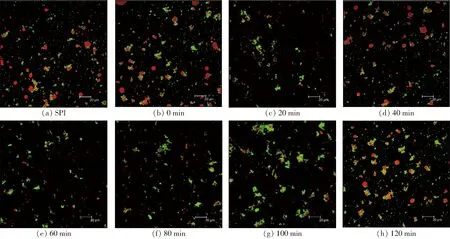
图7 不同空化射流时间下SPI-葡萄糖共价复合物乳液的CLSM图像Fig.7 CLSM images of emulsions of SPI-glucose conjugates under different cavitation jet treatment times
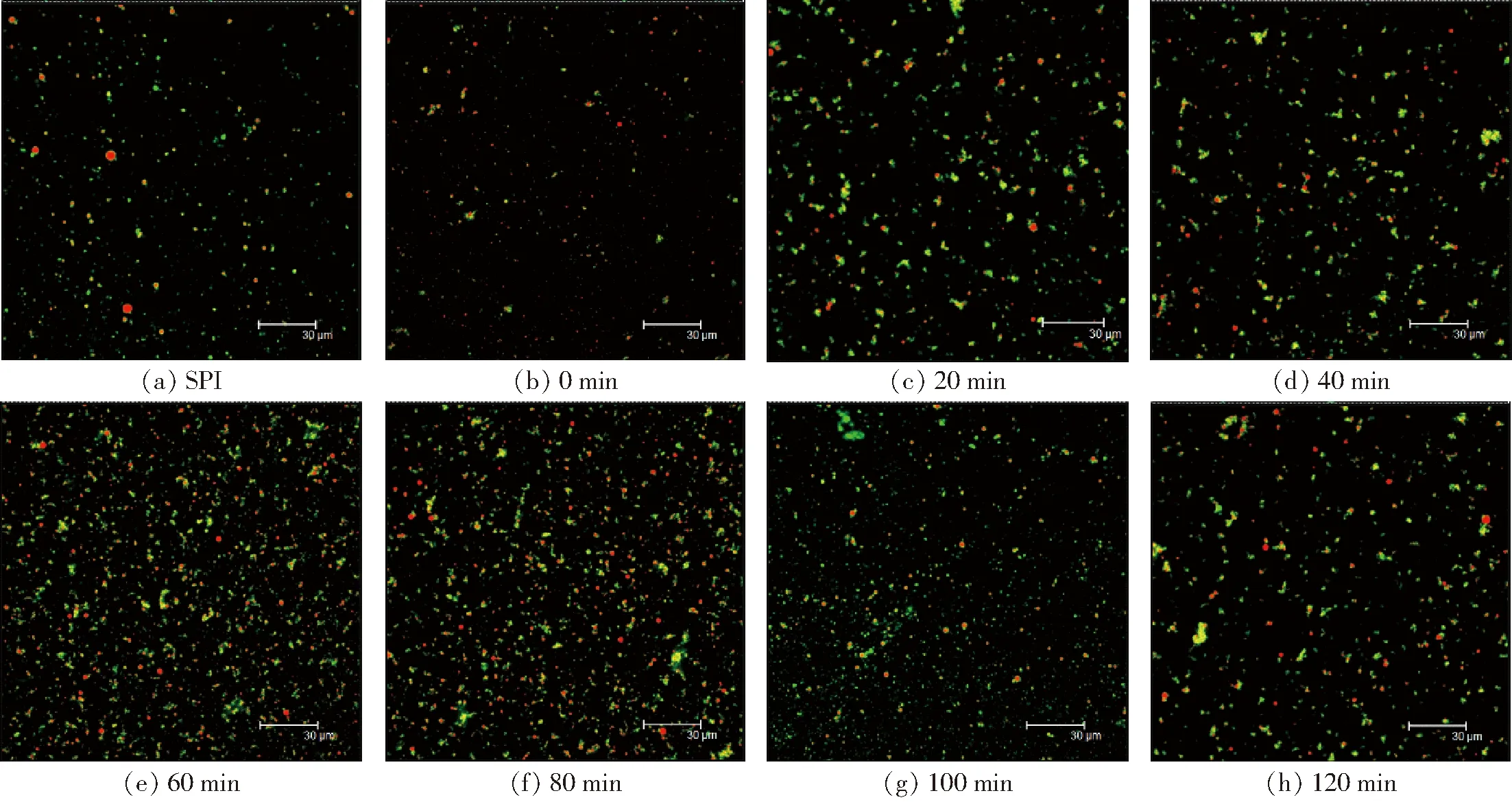
图8 不同空化射流时间下SPI-葡聚糖共价复合物乳液的CLSM图像Fig.8 CLSM images of emulsions of SPI-dextran conjugates under different cavitation jet treatment times
由图7、8可知,未处理SPI制备的乳液微观结构有一些比较大的液滴存在,这可能是SPI乳化性较低造成的。空化射流处理后乳液的微观结构液滴比较均匀,液滴也比较小,这可能是由于空化射流产生的高速湍流剪切以及高压力差使大分子蛋白去折叠,水合作用增强,内部疏水基团暴露,提高了其亲水性和亲油性,且两者保持较好的平衡,蛋白乳化性增加,从而使得乳液的液滴逐渐均匀。随着空化射流时间增加,液滴粒径呈先逐渐减小后增大的趋势。空化射流处理超过10 min形成的乳液微观结构出现聚集情况,液滴开始变得不均匀,出现小液滴簇。
SPI-葡萄糖共价复合物葡萄糖形成的乳液液滴粒径较大,而SPI-葡聚糖共价复合物的乳液液滴分散更加均匀,乳液粒径也更小。这可能是由于葡聚糖比葡萄糖的糖链更长,在与蛋白质结合后更容易调控糖基化产物的界面特性,降低乳液界面张力,使得乳液粒径更小,分散更加均匀,表明SPI-葡聚糖共价复合物制备的乳液具有更好的稳定性。综上所述,空化射流可以一定程度改善糖基化产物的乳化性,得到粒径更小、稳定性较好的乳状液,且SPI与葡聚糖糖基化处理对乳液微观结构的改善效果更佳。
2.4 蛋白吸附率
SPI-葡萄糖共价复合物的蛋白吸附率如图9所示。
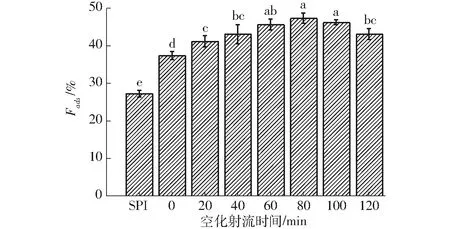
图9 不同空化射流时间下SPI-葡萄糖共价复合物乳液的蛋白吸附率Fig.9 Protein adsorption fraction of emulsion of SPI-glucose conjugates under different cavitation jet treatment times
由图9可知,随着空化射流处理时间增加,SPI-葡萄糖共价复合物乳液的蛋白吸附率整体呈升高趋势,在处理80 min达到最大值,之后继续增加空化射流时间,蛋白吸附率小幅下降。蛋白质的界面蛋白吸附量通常与其乳化性和乳液粒径有关,蛋白质的界面吸附量通常与其乳化性呈正相关趋势,并且通常蛋白吸附量越高会使乳液的平均粒径越小[26]。空化射流能够使蛋白质分子去折叠,从而暴露出部分疏水基团和具有表面活性的多肽,其中多肽会向非水相的界面移动,吸附到油滴的表面,从而使得蛋白吸附量增加[27-29]。
SPI-葡聚糖共价复合物乳液的蛋白吸附率如图10所示。

图10 不同空化射流时间下SPI-葡聚糖共价复合物乳液的蛋白吸附率Fig.10 Protein adsorption fraction of emulsion of SPI-dextran conjugates under different cavitation jet treatment times
由图10可知,随着空化射流处理时间增加,SPI-葡聚糖共价复合物的蛋白吸附率呈先升高后降低趋势,在处理80 min时达到最高。且与SPI-葡萄糖共价复合物相比,提高更为明显,这可能是由于葡聚糖比葡萄糖的分子量更大,能通过影响溶液的黏度形成更加稳定的空间网状结构,并且适当提高糖分子链的长度能够减少界面张力,有助于蛋白分子在油水界面形成界面膜结构,提高乳液的蛋白吸附率。以上结果表明空化射流辅助对SPI-葡聚糖共价复合物在液滴界面上的吸附和堆积有更明显的促进作用。
2.5 乳析指数
SPI-葡萄糖共价复合物乳液在储藏过程中乳析指数的变化曲线如图11所示。
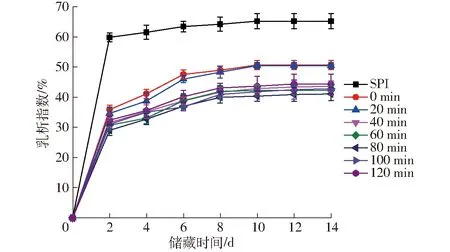
图11 不同空化射流时间下SPI-葡萄糖共价复合物乳液的乳析指数Fig.11 CI of emulsion of SPI-glucose conjugates under different cavitation jet treatment times
乳状液属于热不稳定体系,会依据动力学稳定性原理以一定速度分离成互不相容的油、水两相,使乳状液出现絮凝、聚集、粒径偏移等现象[30]。乳状液的粒度分布是影响乳状液稳定性的关键因素,通常情况下,乳状液粒子越小,乳析速度越慢,乳析率越低,乳状液也就越稳定。由图11可知,新制备的乳状液未见明显的分层现象,放置一段时间后样品的底部逐渐出现水析层,脂肪逐渐上浮,在储藏的前8 d乳状液的乳析指数随储藏时间增长而显著增加,随后增加缓慢直至保持稳定。SPI-葡萄糖共价复合物乳液的层析指数明显低于未处理SPI制备的乳液,随着空化射流辅助处理时间的增加,乳清层高度有不同程度降低,乳析指数呈先降低后升高的趋势。处理80 min形成的乳液在储藏过程中分层最缓慢,表现出最好的乳化稳定性,与乳液平均粒径的结果一致。这可能是由于空化射流使蛋白质去折叠,溶解性增加,从而使更多亲水、疏水基团吸附在油-水界面,起到稳定乳液的作用,抑制了乳液的分层[31-32]。
SPI-葡聚糖共价复合物乳液乳析指数如图12所示。
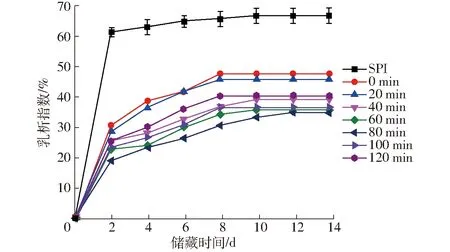
图12 不同空化射流时间下SPI-葡聚糖共价复合物乳液的乳析指数Fig.12 CI of emulsion of SPI-dextran conjugates under different cavitation jet treatment times
由图12可知,SPI-葡聚糖共价复合物乳液与SPI-葡萄糖共价复合物相比,乳清层更低,表现出更低的乳析指数,这与乳液粒径分布和乳化性结果一致。除了空化射流使蛋白质去折叠,使更多亲水、疏水基团吸附在油-水界面,SPI-葡聚糖共价复合物制备的乳状液表面吸附了大量通过共价结合的葡聚糖,葡聚糖的空间位阻效应促进抑制乳液液滴间发生聚集,从而有利于形成较小液滴粒径的乳液[33],所以SPI-葡聚糖共价复合物的乳液表现出更好的贮存稳定性。
2.6 抗氧化性
2.6.1还原力
SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液的还原力的变化曲线如图13所示。
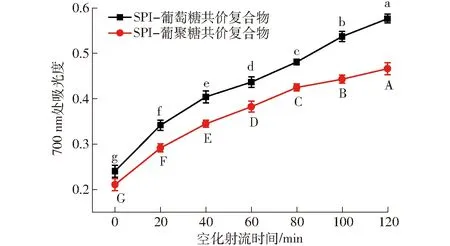
图13 不同空化射流时间对SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液还原能力的影响Fig.13 Effect of different cavitation jet treatment times on reducing power of emulsion of SPI-glucose and SPI-dextran conjugates
在还原能力测试过程中,样品中的还原剂能够将Fe3+还原成Fe2+,可以通过测定700 nm处吸光度来测定Fe2+,吸光度越大,表明样品的还原能力越强[15]。SPI在700 nm处的吸光度为0.126。由图13可知,随着空化射流时间的延长,两组接枝物的还原力都逐渐升高。研究表明,美拉德反应初级阶段的Amadori热解产物、中间产物还原酮、高级阶段产物类黑精都具有一定的还原能力。其中,中间产物还原酮是起到还原能力的主要物质。其可以通过破坏自身自由基链和提供氢原子的方式达到抗氧化性的目的[34],此外它还可以与一些过氧化物的前体物反应阻止过氧化物的生成来达到抗氧化的目的,由此可见,抗氧化特性是美拉德反应接枝物的一大特性。空化射流时间促进大豆蛋白的结构伸展,促进了SPI与糖的反应。形成中间产物的量增多,因此产物的还原力不断增加[35-36]。SPI-葡萄糖共价复合物乳液的还原力大于SPI-葡聚糖共价复合物乳液,这是因为SPI与葡聚糖接枝度更小,相同条件下生成的美拉德反应产物较少。
2.6.2DPPH自由基清除能力测定
SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液DPPH自由基清除能力如图14所示。

图14 不同空化射流时间对SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液自由基清除率的影响Fig.14 Effect of different cavitation jet treatment times on DPPH radical-scavenging activity of emulsion of SPI-glucose and SPI-dextran conjugates
DPPH自由基是一种高稳定性的自由基。DPPH自由基清除能力被广泛用于评价保健品对不稳定H原子向自由基转移的抗氧化能力。DPPH-醇溶液最大吸收波长为517 nm,颜色为紫色。环境中的抗氧化剂可作为氢供体与DPPH自由基反应,使其在517 nm处变为黄色,吸光度变小。517 nm处的吸光度变化可以用于评价物质的自由基清除率[37-38]。由图14可知,随着空化射流辅助时间增加,SPI-葡萄糖共价复合物、SPI-葡聚糖共价复合物乳液的DPPH自由基清除能力都在不断增加。美拉德反应产物可以提够氢原子与DPPH自由基结合,形成稳定DPPH-H分子以清除DPPH自由基。文献[39]的研究表明,美拉德反应的中间产物和最终产物类黑精都可以作为氢供体,但高级阶段产生的主要包括类黑精的褐色化合物是清除DPPH自由基的主要物质。在空化射流辅助处理的条件下,SPI与葡萄糖、葡聚糖的反应速率明显加快。接枝反应更快向美拉德反应高级阶段进行,美拉德反应高级阶段产物类黑精的形成不断增多,使接枝物的DPPH自由基清除能力不断增加。在相同空化射流处理时间下,SPI-葡萄糖共价复合物乳液的DPPH清除能力更强,这是由于相同时间内SPI葡萄糖的接枝度较大,美拉德反应体系进入高级阶段的程度更大,类黑精的形成量更多,使SPI-葡萄糖共价复合物的DPPH自由基清除能力较强。
3 结束语
经过一定时间空化射流处理的糖基化产物乳液的粒径明显降低、ζ-电位增大、微观结构中的液滴逐渐均匀、蛋白吸附率显著升高、乳析指数降低,这可能是由于空化射流使蛋白质去折叠,溶解性增加,从而使更多亲水、疏水基团吸附在油-水界面,减小了蛋白聚集的可能性,从而起到了稳定乳液的作用,抑制乳液的分层;而空化射流处理时间过长会导致蛋白聚沉,使得糖基化产物乳液粒径开始升高、ζ-电位绝对值减小、微观结构中液滴开始发生聚集,蛋白吸附率降低,乳析指数呈逐渐上升趋势,导致乳液的储藏特性逐渐下降。但乳液抗氧化能力(还原力和DPPH自由基清除能力)始终呈上升趋势,且其抗氧化能力与空化射流辅助处理时间呈正相关。因此,糖基化产物乳液在空化射流处理80 min时的乳液特性最佳,储藏特性较好;且相比SPI-葡萄糖共价复合物,SPI-葡聚糖共价复合物乳液更稳定,粒径分布更均一,表现出更佳的乳液储藏特性。这为糖基化后的蛋白乳液的改性及空化射流处理在食品方面的应用提供了参考。

