龙眼WOX家族基因鉴定及在体胚发生早期的表达分析
马湘玮,张舒婷,陈 燕,赖钟雄,林玉玲
(福建农林大学 园艺植物生物工程研究所,福州 350002)
WUSCHEL相关的同源异型盒(WUSCHEL-related homeobox, WOX)家族是一类植物特有的转录因子家族,属于同源异型盒(homeobox,HB)超家族中的一个亚家族[1]。在HB转录因子家族中,包含一个典型的DNA 结合螺旋-环-螺旋-转角-螺旋基序的60~66个氨基酸残基的同源结构域(homeodomain,HD)[1-2]。在WOX转录因子家族中此结构域非常的保守,证明此结构域在HD功能完整性方面起着重要的作用[3]。根据进化关系,将WOX转录因子家族成员分为3个分支,WUS支(WUS clade)、中间支(intermediate clade)和古老支(ancient clade)[4]。古老支演化较早,发现于藻类和被子植物中;中间支出现在蕨类植物起源之后,且不存在于藻类和苔藓植物中;而WUS分支则仅在被子植物中发现,表明它是最先进的分支。
随着高通量测序的发展(next generation sequencing,NGS),WOX基因家族在植物中也被广泛鉴定[5-9],如毛果杨(PopulustrichocarpaTorr.)[10]、小立碗藓(Physcomitrellapatens.)[5]和欧洲云杉[Piceaabies(L.) Karst.][6]等。WOX家族成员在调节植物生长发育的许多方面起着重要作用,如调控植物胚的形成、干细胞维持、调控体胚发生、侧器官发育以及器官再生[11]。拟南芥(Arabidopsisthaliana)AtWOX1可能通过调节多胺的合成来调节侧向器官的发育[12]。AtWOX3在叶和花器官原基的边缘表达,促进细胞分裂与器官的横向发展[13-14]。在胚胎发育过程中,过表达拟南芥AtWUS基因可促进陆地棉体细胞胚胎发生并诱导器官发生[15-16]。AtWOX8和AtWOX9最初在卵细胞和合子中共表达,然后通过不对称分裂分别限制在合子胚的顶端和胚柄细胞中,并且都参与了拟南芥早期胚胎发育[17]。PaWOX2可能调节云杉中的胚胎细胞分裂和分化[18];WOX基因是葡萄体胚发生的关键调控因子[19]。综合前人研究结果发现,WOX基因家族的功能涉及范围很广,这些功能的发挥与它们可以促进细胞分裂或阻止未成熟细胞的提前分化密不可分[20]。
龙眼(DimocarpuslonganLour.) 是无患子科(Sapindaceae)龙眼属(Dimocarpus)的热带亚热带常绿果树。龙眼在中国广东、福建、广西、云南、四川和海南等地广泛种植,是重要的经济作物之一。此外,龙眼还有丰富的药理用途,富含大量的多酚,对炎症、癌症和心血管疾病有预防作用[21]。龙眼胚胎发育的状态影响龙眼果实产量及品质[22]。龙眼体细胞胚胎发生(体胚发生)系统是研究龙眼胚胎发育较好的替代材料[23],也可以解决自然条件下龙眼胚胎取样难、材料一致性差等问题。基于本实验室建立的龙眼基因组数据库[24]及DlWUS基因的实验基础[25],本研究采用生物信息学方法对WOX家族成员基本理化性质及系统进化等进行分析;基于龙眼体胚发生早期和不同组织部位的转录组数据库,分析WOX家族成员在龙眼体胚发生早期胚性愈伤组织(EC)、不完全胚性紧实结构(incomplete compact pro-embryogenic cultures, ICpEC)与球形胚(globular embryos, GE)3个阶段的表达(FPKM值);采用qRT-PCR技术验证其在龙眼体胚发生早期及不同激素处理下胚性愈伤组织中的表达模式。
1 材料和方法
1.1 材 料
实验材料采用福建农林大学园艺植物生物工程研究所培养的‘红核子’龙眼胚性愈伤组织(EC)、不完全胚性紧实结构(ICpEC)和球形胚(GE)等体胚早期3个阶段的材料,参考赖钟雄培养方法培养[23]。取0.2 g生长状态良好的EC,分别于0、50、100和200 μmol/L脱落酸(ABA)或茉莉酸甲酯(MeJA)的MS液体培养基中进行培养,120 r/min、(25士2)℃摇床上黑暗培养24 h后收样,经液氮冻存后放于-80 ℃冰箱中保存备用。试验设置3次生物学重复。
1.2 方 法
1.2.1 龙眼WOX家族成员的鉴定和系统进化分析在线网站(https://phytozome.jgi.doe. gov/pz/portal.html)下载拟南芥WOX(AtWOX)家族成员蛋白序列与CDS序列,以AtWOX蛋白序列为探针序列(E<0.001),并结合‘红核子’龙眼基因组数据库[24]进行筛选,初步获得14条候选的龙眼WOX(DlWOX)家族蛋白序列。使用HMMER(https://www.ebi.ac.uk/Tools/hmmer/search/phmmer)及SMART(http://smart.embl-eidelberg.de/)在线网站进行WOX家族结构域鉴定,最终在龙眼基因组中确定13条含完整结构域的WOX蛋白序列。使用拟南芥基因组网站TAIR进行Blast比对,参考AtWOX家族成员的命名方法,对DlWOX家族成员进行命名。在线软件Ex-pasyprotparam(https://web.expasy.org/protparam/)分析DlWOX蛋白的基本理化性质;MEGA6.1软件基因邻近法构建龙眼、拟南芥WOX家族成员系统发育进化树,自展法系数(Bootstrap)设置为1000次进行重复检验,利用在线工具iTOL (https://itol.embl.de/upload.cgi) 对进化树进行美化。
1.2.2 龙眼WOX家族蛋白保守基序与基因结构分析采用MEME在线软件(http://meme-suite.org/tools/meme)分析DlWOX蛋白序列的保守基序(motif),使用Tbtools软件进行可视化作图。利用龙眼基因组的gff3文件,使用TBtools软件对DlWOX家族基因结构进行分析。
1.2.3 龙眼WOX基因启动子顺式作用元件分析从龙眼基因组数据库中提取DlWOX基因起始密码子(ATG)上游2 000 bp序列作为DlWOX的启动子序列,采用PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html)在线软件分析龙眼WOX家族基因启动子的顺式作用元件,使用Excel软件对分析所得到的顺式作用元件结果进行绘图。
1.2.4 龙眼体胚发生早期及不同组织部位中WOX基因的表达分析从龙眼体胚发生早期转录组数据库(SRA050205)中,提取WOX家族成员在龙眼体胚发生早期3个阶段(EC、ICpEC、GE)及9个不同组织部位(种子、根、茎、叶、花、花蕾、果肉、幼果、果皮)中的FPKM值,通过取对数(log2)转换,并利用TBtools软件绘制热图进行分析。
1.2.5 龙眼体胚发生早期及不同激素处理下WOX基因的表达分析使用Trizol up试剂盒(全式金,北京)提取龙眼体胚发生早期3个阶段(EC、ICpEC、GE)的总RNA,使用SMARTTMRACE cDNA Amplification Kit TransScript RNA First-Strand cDNA Synthesis SuperMix(翊圣,上海)的说明书进行cDNA合成。以cDNA 10倍稀释液为模板进行扩增,于罗氏LightCycler 480仪器中进行qRT-PCR检测(表1)。以Beta-actin(ACTB)及Ubiquitin(UBQ)为龙眼不同激素处理及早期体胚发生过程qRT-PCR的内参基因,使用2-ΔΔCT方法计算DlWOX的相对表达量,将数据导入SPSS软件分析差异显著性,利用GraphpadPrism7制作图表。

表1 qRT-PCR引物及相关信息
2 结果与分析
2.1 龙眼WOX家族成员鉴定及蛋白质理化性质分析
通过比对分析在龙眼中共鉴定出13个WOX家族成员,参考拟南芥WOX家族成员命名方法,分别将龙眼WOX家族成员命名为DlWUS、DlWOX1、DlWOX1.1、DlWOX1.2、DlWOX1.3、DlWOX14.1、DlWOX14.2、DlWOX2、DlWOX5B、DlWOX6、DlWOX7、DlWOX9A与DlWOX14.2(表2)。对龙眼WOX家族13个成员蛋白质理化性质进行分析发现,WOX家族分子量在10 390.99~202 745.36 Da之间,氨基酸数目在87~1 809 aa之间,不同成员之间的氨基酸数目差异较大;等电点在5.55~9.37之间,其中DlWOX6、DlWOX5B、DlWUS、DlWOX1.2、DlWOX2与DlWOX1.3为碱性蛋白,其余7个成员都为酸性蛋白;不稳定系数在55.25~89.07之间,且只有DlWOX14.2为稳定蛋白,其余12个成员均为不稳定蛋白。亚细胞定位预测结果显示除DlWOX6定位在细胞骨架上外,其余成员均定位在细胞核上。
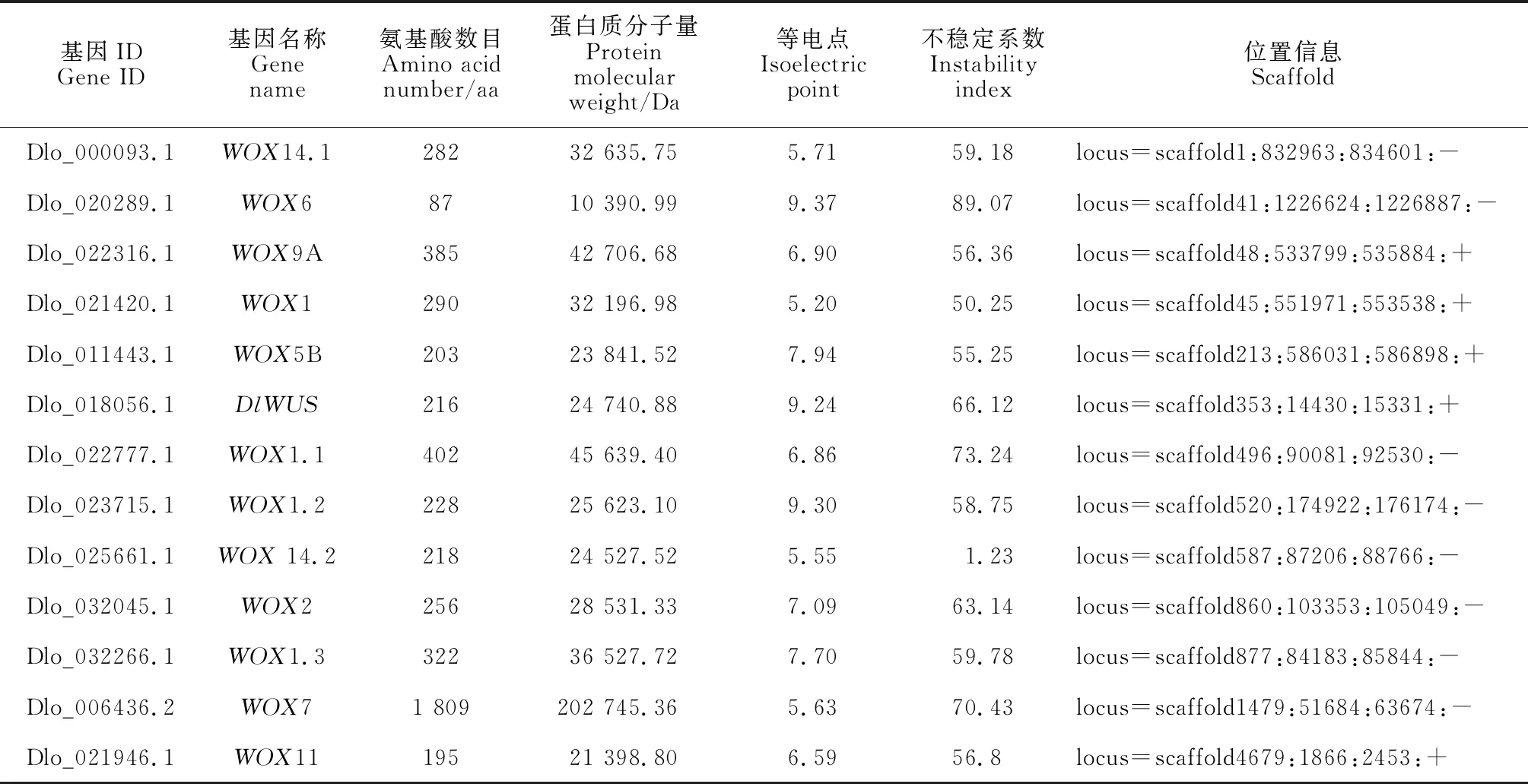
表2 龙眼WOX家族成员基本理化性质分析
2.2 龙眼WOX家族成员系统进化分析
为进一步研究龙眼WOX家族成员间的进化关系,利用MEGA6.10软件构建拟南芥14个WOX家族基因(AtWOX1~AtWOX13、AtWUS)和龙眼13个WOX成员系统进化树(图1)。参考拟南芥的分类方法并结合同源比对,将龙眼WOX家族13条成员初步分成3个支系。远古支、中间支和WUS支。远古支包含了DlWOX1.2和DlWOX5B是树上最小的分支,是WOX家族基因在拟南芥和龙眼中最小的类群。中间支是树上最大的分支,包含了DlWOX7、DlWOX2、DlWOX11、DlWOX1、DlWOX1.1、DlWOX1.3。WUS支包含了DlWOX9A、DlWOX14.2、DlWOX6、DlWOX14.1、DlWUS。从进化树的结果可以看出,所筛选的龙眼WOX家族基因并没有出现单独分支的情况且大多与拟南芥具有较高相似性。
2.3 龙眼WOX家族成员基因结构与蛋白基序(motif)分析
为进一步了解龙眼WOX家族成员的基因结构,对WOX家族成员的DNA序列与相对应基因组的cDNA序列进行比较(图2,A),确定了13条基因的内含子、外显子数量以及位置。结果表明,龙眼WOX家族基因成员外显子数目在1-19之间,其中DlWOX7含有的外显子数目最多有19个;DlWOX6与DlWOX11只有1个外显子,DlWOX1、DlWOX14.2和DlWUS有3个外显子,2个内含子;DlWOX1.1、DlWOX1.3和DlWOX9A有4个外显子,3个内含子。分析发现龙眼WOX家族基因成员的基因长度存在比较大的跨度,DlWOX7基因最长,基因长度为12 000 bp左右;DlWOX6与DlWOX11最短。
对WOX家族成员蛋白序列进行蛋白质保守基序分析,结果(图2,B)发现,除DlWOX14.1、DlWOX6和DlWOX7外,其他成员都含有基序motif1;除DlWOX14.1外其他成员都包含motif2。推测这2个保守基序共同组成HD保守结构域。Motif9只存在于DlWOX1.2和DlWOX7中;motif4只存在于DlWOX14.1、DlWOX6和DlWOX7中,推测DlWOX家族成员在进化的过程中出现了特有的保守结构域,功能产生了分化。DlWOX11和DlWOX14.2除了包含两个基础的保守基序motif1和motif2,并没有其他基序,推测DlWOX14.1、DlWOX6和DlWOX7同其他龙眼WOX基因家族成员的功能冗余有关。
2.4 龙眼WOX家族成员启动子顺式作用元件分析
为深入了解龙眼WOX家族成员不同成员启动子的功能之间差异,使用PlantCARE在线软件对龙眼WOX家族起始密码子上游2 000 bp的启动子序列进行顺式作用元件分析(表3)。龙眼WOX家族启动子区域均含有光(Light)响应元件与生长素(Auxin)响应元件,推测WOX家族在光响应与生长素响应过程中起着重要的作用。大部分成员含有茉莉酸甲酯(MeJA)响应元件、干旱(Drought)响应元件、脱落酸(ABA)响应元件及厌氧诱导(Anoxic)响应元件。此外,DlWUS、DlWOX1.3、DlWOX2含有水杨酸(SA)响应元件;DlWOX2、DlWOX1.1、DlWOX5B、DlWUS、DlWOX14.1含有赤霉素(GA3)响应元件。以上结果表明龙眼WOX家族成员可能通过响应不同激素,参与龙眼不同生长发育过程。
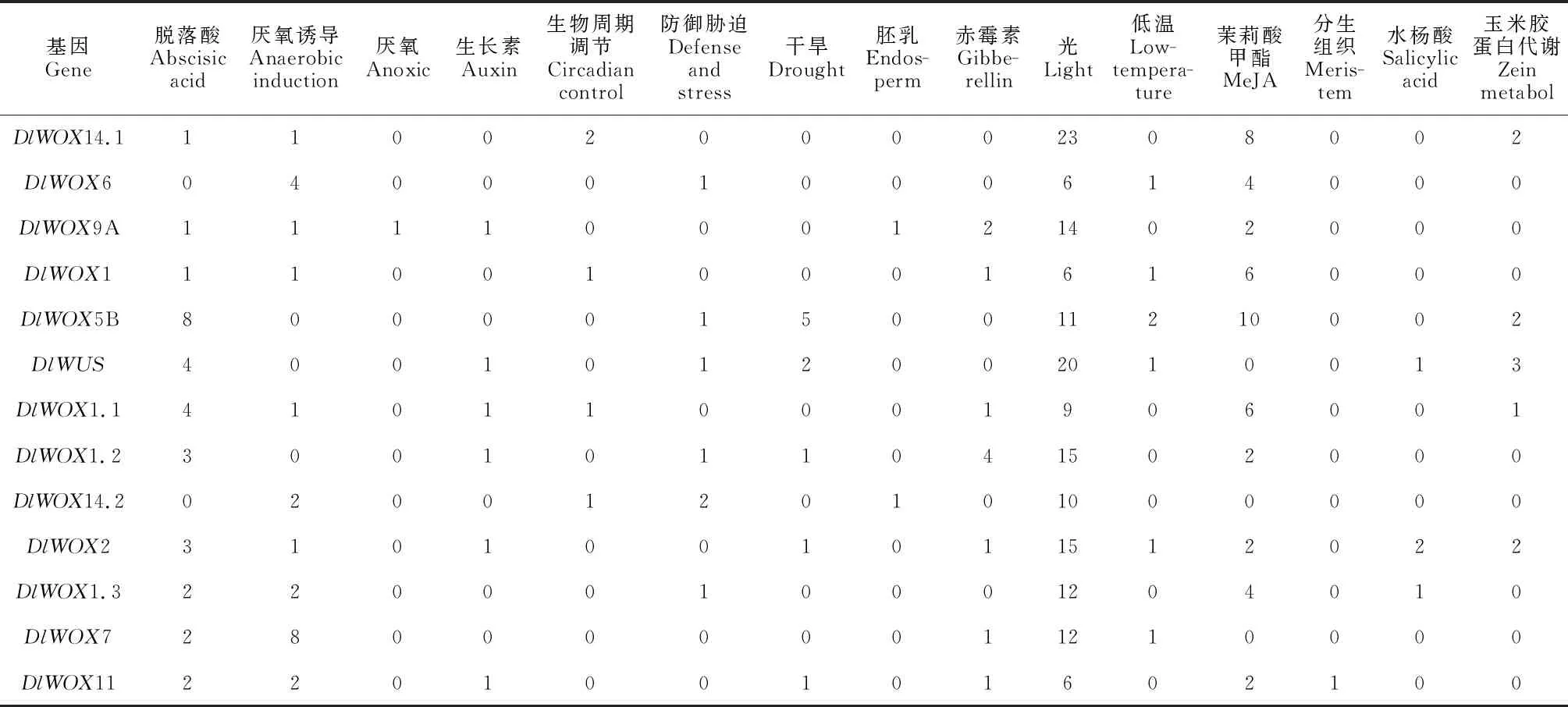
表3 龙眼WOX家族基因成员启动子顺式作用元件
2.5 WOX家族成员在龙眼体胚发生早期的表达分析
为了解WOX家族基因在龙眼体胚早期的表达情况,从转录组数据库中提取该家族基因的FPKM值,分析其在龙眼体胚发生早期3个阶段(EC、ICpEC、GE)的表达模式(图3)。结果发现,DlWOX6、DlWOX5B、DlWOX2、DlWOX11从EC到GE阶段逐渐上调;DlWOX9A在龙眼体胚发生早期3个阶段都有较高表达;DlWOX14.1、DlWOX9A、DlWOX1.2、DlWOX14.2、DlWOX7、DlWUS在EC到GE阶段逐渐下调。以上结果表明,不同DlWOX基因在龙眼体胚发生早期不同阶段发挥作用。
为进一步验证DlWOX家族成员的表达模式,基于FPKM值筛选出在龙眼体胚发生早期表达趋势差异较大的DlWOX11、DlWOX14.1、DlWOX14.2、DlWOX2、DlWOX9A、DlWOX6和DlWOX7等7个基因,采用qRT-PCR技术检测其在EC、ICpEC、GE阶段的相对表达(图4)。结果发现,DlWOX6、DlWOX7、DlWOX11和DlWOX14.2在龙眼体胚发生早期的qRT-PCR结果与FPKM表达趋势相似。FPKM显示DlWOX14.1在EC阶段表达量最高,GE阶段表达量最低,而qRT-PCR显示该基因在GE阶段的表达量相较于EC阶段和ICpEC阶段显著上升,这一结果与FPKM值完全相反;qRT-PCR显示DlWOX9A与DlWOX2在EC至ICpEC阶段的表达没有显著差异,与FPKM值表达趋势不同。以上结果说明DlWOX基因具有一定的时空表达特异性。
2.6 龙眼WOX家族成员不同器官的特异表达分析
在不同器官中的表达分析发现(图5),除DlWOX14.1、DlWOX14.2、DlWOX7、DlWOX6、DlWUS外,其余成员在不同器官中表达量低甚至不表达。DlWOX14.2在花、花蕾、茎和幼果中高表达;DlWOX14.1在花蕾和种子中高表达;DlWUS在根和茎中高表达;DlWOX7在所有的器官中都有着较高的表达量,在果肉中的表达量最高。推测DlWOX7在不同器官中特异表达。
2.7 GA3和MeJA处理下WOX家族成员在龙眼胚性愈伤组织中的表达分析
结合启动子顺式作用元件结果,采用qRT-PCR检测不同激素处理下DlWOX基因的表达模式。GA3处理中(图6,A),除DlWOX6以外其余成员对不同浓度GA3均有响应;DlWOX6、DlWOX11、DlWOX14.2、DlWOX7在200 μmol/L GA3时表达量最高,而DlWOX9A和DlWOX2在50 μmol/L GA3时表达量最高;DlWOX11表达量随着GA3浓度的增加而增加;DlWOX6在100 μmol/L GA3时表达量受到了抑制。
MeJA处理中(图6,B),除DlWOX6以外其余WOX家族成员对不同浓度MeJA均有响应,呈现先促进后抑制的表达趋势,且在浓度为100 μmol/L时表达量最高;DlWOX6在浓度为50 μmol/L时表达量受到抑制。推测龙眼WOX家族激素MeJA处理的最适浓度为100 μmol/L。
3 讨 论
3.1 龙眼WOX家族成员具有进化保守性及功能多样性
WOX家族是一类在植物中特异存在的转录因子家族且广泛作用于植物关键的发育过程[17]。目前,WOX家族已在多个物种中被鉴定,在龙眼中WOX家族还没有被报道。本研究利用龙眼全基因组数据库首次在龙眼中鉴定到了13个具有完整HD结构域的DlWOX家族成员,少于拟南芥(15个)[4]、簸箕柳(15个)[26],多于苹果(12个)[27]。总体来讲,龙眼WOX家族成员的数目与多数物种相近,推测在生物进化的过程中其并没有发生大规模的扩增事件,这与拟南芥的研究结果一致[28]。DlWOX家族成员的外显子数目为1~19个,多于番茄SlWOX成员的2~4个[7]和黄瓜CsWOX成员的2~5个[29]。
通过构建系统发育进化树分析,将龙眼WOX家族分为远古支、中间支和WUS支,位于同一分支的成员在功能上可能也具有相似性,这很有可能是由于龙眼WOX家族基因在发生进化的过程中没有出现明显的功能分化而导致的结果,因此使龙眼WOX家族基因与拟南芥的WOX同源性较高,值得注意的是WOX家族基因在拟南芥中最大的分支是WUS支而在龙眼中最大的分支是中间支,但是每一条基因的具体调控位置及功能还需后期进行功能验证。在拟南芥中,AtWOX1及其同源体的主要功能是控制外侧器官增殖与分化[30],而在矮牵牛中PtWOX1也同样具有调控器官的横向发育的功能[31]。蛋白基序分析发现几乎所有的龙眼WOX家族成员都含有motif1和motif2,这两个保守基序共同构成同源结构域HD,某些成员含有特异性的基序,可能造成龙眼WOX家族的功能分化。蛋白质理化性质分析发现,大部分龙眼WOX家族成员编码的蛋白都为不稳定蛋白,均定位在细胞核。通过分析龙眼WOX家族在不同器官中的特异表达,发现龙眼WOX家族成员在花、花蕾、叶、果皮、果肉、根、种子、茎中都有表达且在叶中的表达量较高,值得注意的是DlWOX7在龙眼不同器官中高表达且在果肉中的表达量最高。研究发现,DoWOX7可能通过在铁皮石斛合蕊柱中高表达来调控铁皮石斛花发育[32];在拟南芥中,WOX7在根中高表达以介导糖类对侧根形成的抑制作用[33];而在黄瓜中CsWOX7并无明显的特异表达模式[29]。由此推测,WOX7的表达模式在物种间存在差异,可能由于其在不同物种中具有不同的功能。
3.2 龙眼WOX家族成员可能调控龙眼早期体胚发生过程
植物体胚发生是一个复杂的过程,基因差异表达决定了不同细胞的命运分化。WOX家族成员在促进体胚发生、维持干细胞以及细胞命运转变等方面发挥着重要的作用[34]。PaWOX2影响云杉体胚早期表达[35],AtWOX2在胚胎顶端区域调控胚的形成[17];除此之外,AtWOX9作为拟南芥胚胎发育的调节因子调节胚胎发生的早期,其突变体还会导致体细胞胚胎发育受损、胚胎基部发育不全、下胚轴和子叶的缺陷、球形胚或更早期的发育受阻和细胞分裂频率降低[36],PaWOX9在茎尖和根尖分生组织调节体胚早期发生并且促进细胞的增殖。在本研究中,为了进一步探究DlWOX家族在龙眼体胚发生过程中的作用,对龙眼WOX家族在龙眼体胚发生早期过程表达趋势差异较大的7个基因进行qRT-PCR 分析,发现大部分成员(DlWOX14.2、DlWOX11、DlWOX6、DlWOX7、DlWOX14.1)都在GE阶段高表达;DlWOX2在ICpEC阶段表达量最高;DlWOX9A在龙眼体胚发生早期三个阶段没有显著差异性。据前人的报道,WOX家族成员已被证明在协调参与胚胎发生早期阶段的基因转录,芽、根和分生组织功能以及植物器官发生中发挥重要作用,且WOX2、WOX8、WOX9是体胚发生早期的重要调控因子[17];在挪威云杉中PaWOX2和PaWOX8/9在体胚发生早期GE阶段的表达量最高[37];海岛棉中GbWOX9在GE阶段的表达量是EC阶段和心形胚(heart embryo,HE)阶段的2倍多[38]。本研究发现DlWOX9A转录组测序结果与qRT-PCR结果的表达量存在差异并且趋势也不完全相同,还需后期的试验进一步验证。VvWOX5参与了葡萄的鱼雷型(torpedo stage,SE1)胚早期,在EC和早期的SE1中,其表达水平显著高于子叶期(cotyledonary stage,SE2)和体胚发芽期(somatic embryos in germination,SEG)[19]。张东敏等[25]分离克隆了龙眼WOX家族的WUS成员,发现DlWUS在整个龙眼体胚发生过程均有表达,在GE阶段发挥作用,并影响体细胞胚胎发育后期的形态建成。DlWOX14.2、DlWOX11、DlWOX6、DlWOX7、DlWOX14.1在EC、ICpEC与GE三个阶段高表达,在GE阶段的表达量最高,这一研究结果与前人的一致。推测WOX家族在龙眼的整个体胚发生早期起着重要的作用,尤其是在GE阶段。
3.3 龙眼WOX家族成员可能通过响应赤霉素和茉莉酸甲酯从而调控龙眼早期体胚发生过程
GA在植物生长发育的许多方面发挥重要作用,例如种子发育和萌发、体细胞胚萌发和再生、茎伸长、无核果实的发育和花朵发育[39-41]。在体细胞胚胎发生的后期、合子胚胎发生的早期阶段、胚胎开始发育和分化,这些形态发生事件也受GA调节并且缺乏GA也会导致种子败育[42]。本研究中,6个龙眼WOX家族成员经GA处理后除DlWOX6外均呈上调表达,而DlWOX11和DlWOX2都含有GA响应元件,进一步说明了龙眼WOX家族可以响应GA的处理;值得注意的是DlWOX6、DlWOX14.2、DlWOX7、DlWOX9A虽然不含有GA响应元件,但qRT-PCR结果显示其也能在一定程度下响应GA处理并大部分成员呈现上调的表达趋势,说明其他龙眼WOX家族成员可能也在一定程度上响应GA的调控。前人研究发现DlWUS含有赤霉素应答元件(P-box)且施加低浓度的GA可以促进DlWUS的表达,从而调控龙眼体胚发生过程[25]。结合qRT-PCR结果,推测龙眼WOX家族可能通过响应GA来调控龙眼体胚发生。
研究表明MeJA的应用以浓度依赖性方式抑制愈伤组织的诱导和生长、胚性悬浮液的增殖、分化以及体细胞胚的萌发和转化[43-44]。在紫苜蓿的体细胞胚胎中,MeJA以不同的方式影响1-氨基环丙烷羧酸(ACC)积累;在愈伤组织中检测到ACC的增加,而在球形胚中发现ACC水平降低[45];适宜浓度的MeJA能使杂交鹅掌楸的体胚发生率和成熟率升高并且降低畸形率[46];在橡胶树中MeJA可以诱导体胚过程中的花青素积累[47]。通过分析qRT-PCR结果发现,龙眼WOX家族成员都在一定程度上响应MeJA调控,除DlWOX6外其余成员均呈上调表达。DlWOX6、DlWOX11、DlWOX9A、DlWOX2都含有MeJA响应元件,DlWOX14.2和DlWOX7不包含该响应元件,在MeJA的处理下也能呈现上调的表达趋势,猜测龙眼WOX家族可能有复杂的激素调控关系。
本研究通过qRT-PCR检测龙眼WOX家族在GA和MeJA处理下的表达模式,大部分DlWOX家族成员在GA和MeJA处理下表达上调。值得注意的是DlWOX9A在GA和MEJA处理下表达量显著上调,推测该成员可能与一些激素互作,共同参与龙眼体胚发生,但是具体的过程还需要更进一步的研究。

