葡萄‘霞多丽’果实中黄烷-3-醇合成酶活性及其相关基因表达
沙晓蓉,张 萍,王云霞,卜虎柏,马 莹,靳 磊
(宁夏大学 农学院,银川 750000)
酿酒葡萄是宁夏回族自治区的优势特色产业,宁夏贺兰山东麓作为中国葡萄酒“地理标志产品产地”之一,因其独特的气候、土壤条件,被业内公认为是世界酿酒葡萄栽培的“黄金”地带[1]。‘霞多丽’(Chardonnay)是贺兰山东麓主栽酿酒葡萄品种之一,其果实品质受到温度、光照、水分、海拔高度和土壤养分等环境因素的影响[2]。果实成熟度、糖、酸、香气及多酚是评价酿酒葡萄果实品质的主要指标[3],葡萄酒“七分原料,三分酿”,葡萄品质是酿造优质葡萄酒的根基。黄烷-3-醇作为果实中含量最丰富的多酚类物质之一,是决定葡萄酒品质的一个重要因子,对葡萄酒涩、苦味的优劣和强弱,以及对葡萄酒的诸多感官品质[4],如色泽、风味、澄清度、收敛性、褐变及贮藏寿命和稳定性都具有决定性作用[5-6]。同时,黄烷-3-醇能够被人体快速吸收,有一定的药理学作用和保健功能,如抗氧化性和清除自由基的活性[7-8],抑制动脉硬化和保护心血管[9-10],皮肤保健美容等作用,是葡萄果实和葡萄酒中非常重要的功能性成分[11-13]。因此,研究酿酒葡萄中酚类物质对葡萄酒的酿造具有指导意义。
目前,国内外学者对酿酒葡萄中酚类物质的研究比较广泛,但是对与葡萄酒苦涩感相关的黄烷-3-醇类单体的定性定量研究较少。葡萄的成熟条件不同,葡萄中酚类物质的含量及类别也不相同,葡萄的适时采收将直接影响葡萄的质量,进而影响葡萄酒的品质,通过酚类物质的研究则可以对葡萄成熟度做出更加准确的判断。前人[14-15]采用高效液相色谱法对葡萄果实中的黄烷-3-醇单体含量进行了测定,结果发现葡萄果实含有儿茶素[(-)-catechin, CAT]、表儿茶素[(-)-epicatechin, EC]和表儿茶素没食子酸酯[(-)-epicatechin gallate, ECG]3种单体。邓波[16]以‘赤霞珠’和‘蛇龙珠’葡萄品质为试材,研究不同品种葡萄部位中黄烷-3-醇类化合物单体CAT、EC、ECG含量的差异,结果表明不同品种葡萄部位中黄烷-3-醇类化合物单体的含量有明显差异,‘赤霞珠’葡萄果皮和果梗中的CAT含量高于‘蛇龙珠’。李小龙[17]研究表明,在葡萄果实发育过程中,‘赤霞珠’种子内酚类物质总量总体呈下降趋势,在幼果期其含量下降较为缓慢,果实成熟后期下降速率减缓并趋于稳定。黄烷-3-醇类物质是类黄酮代谢途径的产物[18-19],其生物合成是一个复杂的过程,由多个基因表达及相关酶综合调控。秦晨亮[20]研究了赤霞珠果实不同发育阶段果皮中酚类物质与其相关酶活性之间的关系,发现赤霞珠葡萄果皮PAL活性在生长发育过程中呈双峰型变化趋势,分别在花后35和80 d达到高峰。CHI基因表达水平随着果实的发育而逐渐下降[21]。但前人对于葡萄果实中黄烷-3-醇类单体的研究主要集中在干红葡萄上,而对白葡萄的研究报道较少。特别是白葡萄中黄烷-3-醇生物合成和积累与其合成相关酶及相关基因表达的关系鲜见报道。因此,研究白葡萄品种果实中黄烷-3-醇单体及含量的变化规律,探讨其生物合成途径及相关酶活性变化、相关结构基因的表达,对于‘霞多丽’等白葡萄品种资源开发及利用具有重要意义。
本研究应用HPLC技术,通过对白葡萄品种‘霞多丽’果实中酚类物质的定性定量分析来探讨其在浆果发育过程中的变化规律和合成相关酶活性变化,同时利用qRT-PCR技术对果实发育过程中黄烷-3-醇生物合成相关结构基因进行定量分析,探讨黄烷-3-醇含量变化与其生物合成相关酶及相关基因的关系,对阐明酿酒葡萄次生代谢产物生物合成过程具有重要意义,同时也为优质酿酒葡萄品种的培育提供理论依据。
1 材料和方法
1.1 试验材料
宁夏贺兰山东麓地区白葡萄品种‘霞多丽’果实采自银川市美御酒业有限公司葡萄种植基地。葡萄树常规水肥管理,冬天埋土防寒,避免冻伤,用宽行密株的栽培方式,株行距为0.5 m×3.0 m,单壁篱架栽培,每隔10~15 cm留1个结果枝,每个结果枝留1穗果。选取长势一致的‘霞多丽’葡萄优良植株60株,花后20 d(2020年6月13日)开始采样,每10 d采样1次,共采样8次。每次随机选取3株,于植株东、西两侧分别采集果穗各1穗,共6穗。果穗采集后,去除机械伤害、病虫害及发育异常果粒,装入冰盒,迅速带回实验室用液氮速冻后置于-80 ℃冰箱中保存备用。
1.2 仪器与设备
Aglient 1260型高效液相色谱仪(美国安捷伦公司);Light Cycler 4801I型荧光定量PCR仪(Roche,Swiss);Christ Alpha 1-4 LSC plus冷冻干燥机(德国Christ公司);FRQ-1006单槽超声波清洗机(杭州法兰特超声波科技有限公司);KH19A离心机(湖南凯达科学仪器有限公司)。
1.3 葡萄果实中黄烷-3-醇单体含量测定
1.3.1 葡萄果实中黄烷-3-醇的提取将葡萄样品用液氮研磨,冷冻干燥,干燥后的粉末于-40 ℃冰箱中保存待用。称取葡萄果实干粉1.0 g置于15 mL离心管中,加入10 mL 70%甲醇(HPLC),摇匀,遮光超声45 min(80 Hz)后离心15 min(4 ℃),取上清液经0.25 mm滤膜过滤后上样待检。
1.3.2 黄烷-3-醇单体HPLC分析条件色谱柱采用Zorbax Eclipse SB-C18 (250 mm×4.6 mm,5 μm粒度色谱柱);检测波长为280 nm,柱温40 ℃,进样量10 μL,流速0.5 mL/min。梯度洗脱:流动相A为0.4%甲酸水溶液,流动相B为乙腈(HPLC)。洗脱程序:0~10 min,B 1%~10%;10~20 min,B 10%~20%;20~32 min,B 20%~35%;32~35 min,B 35%~100%;35~37 min,B 10%。
1.3.3 黄烷-3-醇标准曲线的绘制将20 mg没食子儿茶素(GC)、表儿茶素没食子酸酯(ECG)、儿茶素(CAT)、表儿茶素(EC)标品,加入2 mL 70%甲醇配成母液,将母液依次稀释为100、50、25、10、5 mg/L的5个不同浓度梯度的溶液,把准确配置的不同浓度的标准品混合液在上述色谱条件下分别进样10 μL,以峰面积为纵坐标,质量浓度为横坐标,建立标准曲线,数据和结果见表1,所得液相图谱见图1。从表2可知,4种黄烷-3-醇单体的溶液浓度与峰面积相关系数均在0.994 3以上,说明相关性良好,可以满足定量的需要。
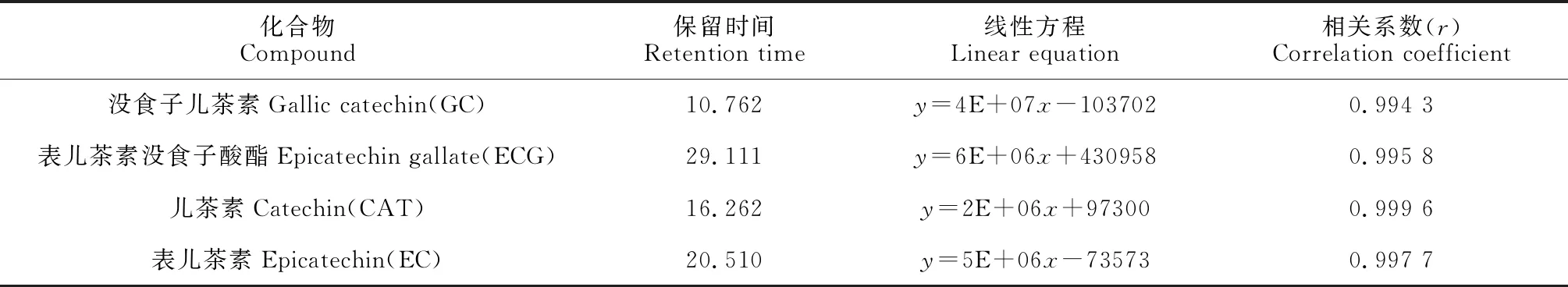
表1 4种黄烷-3-醇的线性方程及相关系数
1.4 黄烷-3-醇生物合成相关酶活性的测定
苯丙氨酸解氨酶(PAL)活性测定参照何慕涵等[22]的方法,以U·g-1表示;查尔酮异构酶(CHI)活性测定参照高娅北等[23]的方法,结果以U·g-1表示;黄烷酮3-羟化酶(F3H)、二氢类黄酮还原酶(DFR)活性测定参考刘美玲等[24]的方法,结果以μg·g-1·h-1表示;类黄酮3′-羟化酶(F3′H)活性测定参考何凤平等[25]的方法,结果以U·g-1表示;花色素苷合成酶(ANS)活性测定参考杜丽娟[26]的方法,结果以U·g-1表示。
1.5 黄烷-3-醇生物合成相关结构基因表达分析
1.5.1 RNA提取葡萄果实总RNA的提取采用多糖多酚植物专用RNA提取试剂盒Quick RNAisolation Kit进行,具体步骤参见说明书。
1.5.2 cDNA的合成按照Reverse Transcription System Kit试剂盒说明,建立总体积为20 μL的反转录反应体系。首先在DEPC处理过的PCR管中加入总RNA 2 μL,再加入50 μmol/L Oligo(dT15)1.5 μL,变性10 min于70 ℃水浴中,立即冰浴2 min,离心,将液体收集于管底。依次加入4 μL 15xRT缓冲液、1 μL RNA酶抑制剂(Rnasin,20 μ/μL)、2 μL dNTPs(200 μmol/L)、1 μLAMV反转录酶、8.5 μL DEPC处理水于冰浴中。混匀后离心,将液体收集于管底,42 ℃温浴1 h,99 ℃加热5 min,灭活反转录酶,立即冰浴5 min,-20 ℃保存。
1.5.3 PCR引物设计根据Gene Bank中苯丙氨酸解氨酶(PAL)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、二氢类黄酮还原酶(DFR)、花青素合成酶(ANS)、类黄酮3′-羟化酶(F3′H)基因的全长序列,利用Primer 5.0设计PCR扩增引物(引物序列见表2),经北京擎科生物科技有限公司合成。选择Actin基因作为内参,对试验结果进行标准化处理。

表2 实时荧光定量 PCR 引物序列
1.6 数据分析
每个测定指标3次重复,结果以“平均值±标准误”表示,数据处理采用Excel 2010,利用SPSS19.0软件进行方差分析(ANOVA),Duncan多重比较方法进行差异显著性检验(P<0.05),目的基因相对表达量采用2-ΔΔCt法计算;用Pearson相关性分析法揭示葡萄浆果发育过程中黄烷-3-醇积累代谢与基因表达量的耦合关系;用Excel 2010软件进行作图。
2 结果与分析
2.1 ‘霞多丽’果实发育过程中黄烷-3-醇含量的变化
由表3可知,霞多丽葡萄果实在整个发育时期,黄烷-3-醇类化合物GC、ECG含量大部分时间远高于CAT、EC含量。其中,GC含量随着果实发育整体呈先升高后下降趋势,在花后40 d(7月3)日出现峰值(40.02 mg/g),并与其余时期存在显著差异,花后90 d(8月22日)比峰值时显著减少了91.85%;ECG的含量在果实发育初期未检测到,在花后50 d(7月13)时出现最高值(47.69 mg/g)并与其他时期差异显著,随后含量持续下降,且至花后90 d(8月22日)出现最低值,最低值比最高值显著降低了53.87%;CAT含量总体呈降-升-降的变化趋势,也在花后50 d(7月13日)时出现最高峰(18.68 mg/g),并与其他时期相比差异显著;EC含量的变化总体呈先升后降趋势,同样在花后50 d(7月13日)达最大值(42.73 mg/g),比花后40 d(7月3日)增加了2.19倍,其最低值出现在花后20 d(6月13日),仅为2.69 mg/g。
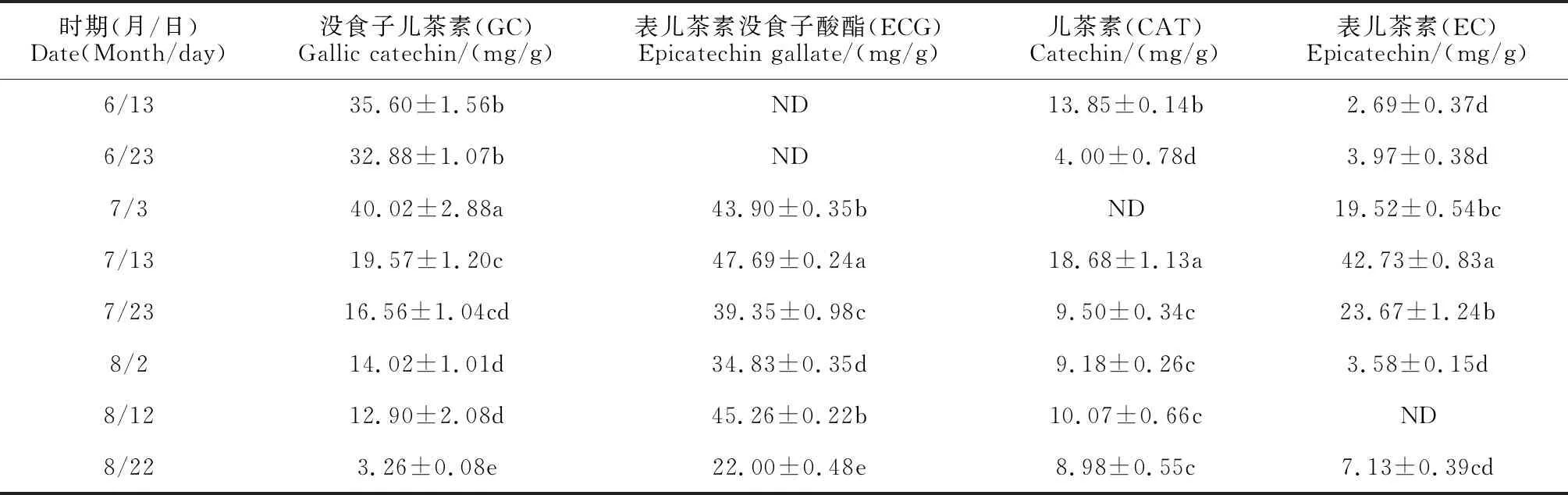
表3 ‘霞多丽’果实发育过程中黄烷-3-醇类化合物的含量变化
2.2 ‘霞多丽’果实发育过程中黄烷-3-醇生物合成相关酶活性的变化
黄烷-3-醇生物合成相关酶PAL、F3H、F3′H、CHI、DFR和ANS活性测定结果(图2)表明,PAL和ANS活性变化趋势较为一致,均呈先升高后降低的变化趋势,且在花后30 d(6月23)出现最大值,并与其他时期存在显著差异;F3H、F3′H、CHI活性都在花后20 d(6月13)出现最大值,而后各酶活性迅速降低,说明花后20 d是‘霞多丽’酶促反应发生的关键时期;DFR活性先升高后降低,在花后50 d(7月13)再次升高,后随果实成熟逐渐降低。另外,各种相关酶活性在8/2~8/22期间整体维持在偏低水平,且无显著差异。
2.3 ‘霞多丽’果实发育过程中黄烷-3-醇生物合成相关基因的表达特征
‘霞多丽’葡萄果实中黄烷-3-醇生物合成相关基因的表达分析结果(图3)显示,在葡萄果实发育过程中,PAL、ANS基因的表达情况相似,均是在果实生长初期(6/13~6/23)上调,且表现为显著上升趋势,至花后30 d(6月23日)达到最高值,随后表达水平大幅下降,总体呈下调趋势并维持在较低水平;F3H、CHI基因表达均呈先下调后上调的趋势,随着果实成熟表达逐渐加强,CHI基因相对表达量在花后90 d(8月22日)达到最大值,而F3H基因的相对表达量在果实生长初期(6月13)具有最大值,并远高于其余时期;F3′H基因的表达水平在果实生长初期快速下调,而后随果实成熟逐渐上调,但仍始终显著低于生长初期的最大值(6月13日);DFR基因的表达水平随着果实生育期显著先上调,而后大幅度显著下调,随果实成熟再次上调,但仍始终维持在较低水平。
2.4 ‘霞多丽’果实发育过程中黄烷-3-醇含量与生物合成相关酶活性和相关基因表达量的相关性
由表4可见,‘霞多丽’葡萄果实中黄烷-3-醇单体GC含量与CHI、DFR基因相对表达量为负相关,与F3H、F3′H基因表达为正相关; ECG含量与ANS、PAL基因表达为正相关,相关系数较小分别为0.252、0.338,与F3H、CHI、DFR、ANS、F3′H基因表达为负相关;CAT含量与F3H、F3′H基因表达为正相关。但是,以上相关关系均未达到显著水平。

表4 黄烷-3-醇含量与合成相关酶活性及相关基因表达量的相关系数
同时,GC含量与生物合成相关酶活性均呈正相关关系,其中F3H、F3′H和ANS活性与GC含量为显著正相关,说明F3H、F3′H和ANS活性的提高可能对GC含量的积累有显著促进作用;EC含量与合成相关酶均为负相关关系,ECG含量与合成相关酶均为正相关关系,而CAT含量与DFR、ANS和PAL酶活性呈负相关关系,与其他合成相关酶活性均呈正相关关系,但EC、ECG、CAT含量与生物合成相关酶活性的相关性均表达到显著水平。
另外,黄烷-3-醇生物合成相关酶活性与相关基因表达量间,除DFR活性与CHI、F3H、F3′H基因表达量,PAL活性与F3′H基因表达量为负相关外,其他合成相关酶活性与基因表达量间均为正相关,其中CHI基因表达量与各合成相关酶活性间相关性较弱,其他基因表达量与黄烷-3-醇生物合成相关酶活性相关性较强,除个别酶外,二者相关性达到显著或是极显著正相关关系。
3 讨 论
黄烷-3-醇是葡萄果实品质评价的一个重要指标,在决定葡萄酒的涩感、色泽及氧化等方面发挥重要作用[27-30]。本研究通过分析葡萄浆果发育过程中黄烷-3-醇单体含量的积累及相关酶基因的表达特征,为‘霞多丽’葡萄功能成分的综合开发利用提供依据。赵权[31]研究结果表明,黄烷-3-醇类化合物含量在葡萄果实整个发育过程中呈下降趋势。‘夏黑’葡萄果实中黄烷醇含量在花后21 ~42 d迅速增加至峰值,之后随果实成熟逐渐下降,幼果期含量显著高于成熟期[32]。本试验结果表明,在‘霞多丽’葡萄果实发育的不同阶段,其黄烷-3-醇类物质在花后50 d之前积累最多,可能是因为这一时期的呼吸作用和新陈代谢强烈,之后检测出的GC、ECG、CAT、EC含量均随果实成熟下降,这与Fujita等[33]和Cadot等[34]的研究结果一致。‘赤霞珠’葡萄果实在生长成熟过程中,儿茶素处于先积累,后下降至平稳状态,表儿茶素没食子酸酯具有不稳定性,总体呈下降状态[6]。本研究中ECG在‘霞多丽’葡萄果实发育初期未检测到,可能是因为这一时期ECG含量比较低;CAT含量随着葡萄的成熟总体呈减少趋势,这与王美丽[35]的研究结果相似;CAT等具有较强的抗氧化、抗衰老、抑菌等功能[36],若考虑葡萄果实的功能作用,在完全成熟前采收是较好的时期。
酚类物质是葡萄中重要的次生代谢物,其生物的合成和积累受到相关基因的调控, PAL、F3H、F3′H、CHI、DFR和ANS是黄烷-3-醇合成的相关酶,大量研究表明其基因参与了葡萄黄烷-3-醇的合成调控。彭东[37]、王爱华[38]等研究表明烟叶PAL活性随烟叶成熟而增强,成熟后随烟叶衰老而降低,本研究表明,‘霞多丽’果实发育过程中黄烷-3-醇生物合成相关酶PAL活性呈先升高后降低的变化趋势,这与前人的研究结果相似;其余合成酶F3H、F3′H、CHI、DFR和ANS活性均随着葡萄成熟而降低,可能是由于随生育期的延长体内生理代谢活动减弱所引起的。本研究同时发现,随着‘霞多丽’葡萄果实的成熟,酚类物质生物合成相关基因的表达也发生变化,这些基因的表达差异导致黄烷-3-醇积累模式的变化。其中,ANS基因表达量先上调后下调,后随果实成熟逐渐上调,但仍低于花后20 d,这与马雅娜[39]研究结果相似。
已有研究表明,石榴在果实发育期间ANS基因的表达与花色苷含量呈显著正相关[40],PAL基因的表达与烟叶中的类黄酮含量呈显著正相关[23]。在本研究‘霞多丽’葡萄果实中,F3H、F3′H和ANS活性与GC含量达显著正相关水平,表明F3H、F3′H和ANS活性对GC含量的积累影响较大。ANS、PAL基因的表达量与其ECG、GC含量呈正相关,即黄烷-3-醇含量与结构基因表达量呈正相关关系,说明该基因可能是影响黄烷-3-醇含量的主要结构因子,对ECG、GC含量合成的调控作用较强,基因表达量越高,越容易促进黄烷-3-醇类物质的生物合成。另外,F3H基因表达量与F3′H活性,PAL基因表达量与DFR、ANS活性之间也存在极显著正相关关系。因此可根据F3H、F3′H和ANS活性和ANS、PAL基因的表达量高低来判断‘霞多丽’葡萄果实中黄烷-3-醇的合成积累水平。
综上所述,在‘霞多丽’葡萄果实发育过程中,黄烷-3-醇单体含量随果实成熟逐渐下降,黄烷-3-醇类物质的积累与葡萄果实中其生物合成相关酶活性及相关基因表达有关。F3H、F3′H和ANS活性与‘霞多丽’葡萄果实中GC含量为显著正相关;F3H、F3′H基因可能促进GC、CAT的合成,ANS、PAL基因促进ECG、GC的合成,CHI、DFR基因抑制GC的合成。总之,黄烷-3-醇生物合成的相关酶活性和相关基因表达影响了葡萄果实中黄烷-3-醇类化合物含量的积累,从而进一步影响葡萄酒的感官品质。

