高强度聚焦超声联合脂质纳米氟碳液滴消融兔肝的实验研究
孙廷宇 王 琦 叶合敏 曾 超 李婧男 李发琪
高强度聚焦超声(high intensity focused ultrasound,HIFU)是一种靶向、无创的肿瘤消融方法,但对于体积较大、血供丰富的肿瘤,其治疗时间相对较长、有效率较低[1]。研究[2]表明,氟碳液滴可以通过HIFU 的热效应在体内相变为微泡,改变组织的声学特性增强声散射,以及增强能量在靶区的聚集,从而提高HIFU 的治疗有效率。HIFU 联合氟碳液滴增效机制的应用已有文献[3]报道,但其体内空化活动变化及术后组织再生的病理过程鲜有报道,同时空化效应过度可能会造成不必要的损伤[4]。基于此,本实验对比分析单纯HIFU 及其联合脂质纳米氟碳液滴(lipid-perfluorocarbon nanodroplets,L-PFP)消融兔肝的空化活动和病理变化,旨在为氟碳液滴用于HIFU 临床治疗肝肿瘤提供理论依据。
材料与方法
一、实验动物
新西兰大白兔24只(由重庆医科大学动物实验中心提供),雌雄不限,体质量2.5~3.2 kg;本实验经重庆医科大学动物伦理委员会批准(批准号:SCXK 2012-0001)。
二、主要实验仪器与试剂
1.仪器:透射电子显微镜(JEM-1400PLUS,日本电子株式会社);马尔文激光粒径仪(Zeta Sizer 3000HS,英国马尔文仪器有限公司);旋转蒸发仪(RE-52AA,亚荣生化仪器厂);超声处理器(VCX150,美国Sonic 公司);海扶刀®聚焦超声肿瘤治疗系统(JC 200,重庆海扶医疗科技股份有限公司);被动空化检测(PCD)系统配备的平面压电换能器(panametrics V309-SU,中心频率5 MHz,美国泛美公司),超高速数据采集卡(PXIe-5122,美国国家仪器公司),LabVIEW开发平台(v2015,美国国家仪器公司)。
2.试剂:棕榈酰磷脂酰胆碱(DPPC)、磷脂PEG 马来酰亚胺(DSPE)、胆固醇均购自美国Avanti 公司;磷酸盐缓冲液(PBS)购自美国HyClone 公司;全氟戊烷、氯仿均购自中国阿拉丁公司;戊巴比妥购自北京化学试剂公司;全氟戊烷(PFP)购自美国Stream Chemical公司。
三、实验方法
1.L-PFP 的制备:将6 mg DPPC、2 mg DSPE、2 mg胆固醇及5 ml 氯仿加入圆底烧瓶均匀混合,然后使用旋转蒸发仪加热蒸发,直至底部生成均匀的脂质薄膜;加入5 ml PBS(pH 值7.4)收集脂质体。冰浴下将200 μl PFP 加入脂质体中,使用超声处理器(声功率130 W,处理时间120 s,超声频率20 kHz,占空比45%)对混合溶液进行乳化,制得L-PFP,低温离心后置于4℃冰箱中保存备用。
2.HIFU消融:实验前所有动物禁食24 h,随机分为对照组(单纯HIFU 组)和联合组(L-PFP 联合HIFU),每组各12只。联合组经耳缘静脉注射3%戊巴比妥溶液用于麻醉兔(1 ml/kg),注射L-PFP(0.8 ml/kg),1 min后应用超声确定其肝脏位置,并使用聚焦超声肿瘤治疗系统以能量900 J的连续波进行HIFU辐照。对照组麻醉后仅以相同参数进行HIFU 辐照。观察两组强回声区范围,使用HIFU 自带的GreyAnalyse 软件勾画感兴趣区并计算灰度变化值。
3.空化检测:应用HIFU 自带的超声成像系统对比分析辐照前后兔肝组织的回声变化;应用PCD 系统检测空化特征信号,并根据空化信号的宽带噪声(root mean square,RMS)曲线规律计算累积瞬态空化剂量[5]。
4.实验室及病理检查:两组兔均于辐照前1 d和辐照后即刻、1 d、3 d、7 d 行心脏采血检测谷丙转氨酶(ALT)和天冬氨酸转氨酶(AST)。分别于HIFU辐照后即刻、1 d、3 d、7 d将消融的兔肝取出体外,观察大体标本。取消融区、交界区及周围区(距消融区边缘3 mm以外)组织,以4%甲醛固定、石蜡包埋、切片,HE 染色后进行病理观察。
四、统计学处理
应用SPSS 22.0 统计软件,计量资料以x±s表示,组间两两比较行LSD-t检验。P<0.05 为差异有统计学意义。
结果
一、L-PFP物化表征
L-PFP 溶液呈乳白色,静置过夜后分层,上层为透明液体,下层为乳白色沉淀。马尔文激光粒径仪测得L-PFP 粒径为(278.33±26.06)nm,透射电子显微镜显示脂质体成功包载PFP(图1);制备的L-PFP 24 h 内粒径无明显变化,稳定性良好。

图1 L-PFP透射电镜图
二、HIFU消融情况
使用聚焦超声肿瘤治疗系统以900 J能量辐照后,对照组与联合组均出现强回声,辐照区域边界清晰,联合组强回声区范围大于对照组。对照组和联合组灰度变化值分别为45.60±4.07和88.00±7.21,差异有统计学意义(P<0.05)。见图2。

图2 对照组与联合组辐照前后超声图像
三、空化检测结果
HIFU辐照过程中两组RMS均总体增强,且随时间波动,联合组RMS 高于对照组(P<0.05)。联合组累积瞬态空化剂量为0.69±0.07,显著高于对照组0.11±0.01,差异有统计学意义(P<0.05)。见图3。

图3 两组HIFU辐照过程中RMS变化情况
四、大体标本变化情况
联合组与对照组病灶辐照后即刻呈现椭圆形,中心区域可见组织坏死,与正常肝组织分界清晰,交界处可见充血带,联合组消融灶显著大于对照组。辐照后1 d 两组中心区域均呈凝固性坏死,对照组充血带消失,联合组充血带减小;辐照后3 d 对照组表现为中心组织坏死,周围出现白色炎症反应带,联合组表现为中心组织坏死,充血带消失,未见炎症反应带出现;辐照后7 d 对照组可见消融灶消失,联合组可见中心组织坏死,周围伴一层白色炎症反应带。见图4。

图4 对照组与联合组辐照后各时间点消融灶大体图
五、实验室检查结果
联合组与对照组辐照后即刻、1 d、3 d、7 d ALT 和AST均呈先增高后降低的趋势,联合组辐照后1 d、3 d、7 d ALT 和AST 均高于对照组,差异均有统计学意义(均P<0.05)。见表1。

表1 HIFU辐照前后兔肝功能指标变化情况(x±s) U/L
六、病理检查结果
联合组辐照后即刻消融区域与正常组织边界清晰,消融区域内肝组织明显破坏,肝细胞完全消失,被大量红染的蛋白物质代替,可见细胞碎裂;辐照后1 d消融区域边界周围伴有大量炎性细胞浸润,消融区域与正常组织边界清晰;辐照后3 d 消融区域边界出现条带状纤维化,消融区域与正常组织边界清晰;辐照后7 d 消融区域边缘可见较多正常肝细胞,并伴有条带状纤维化及少量炎性细胞浸润。对照组辐照后即刻消融区域边界较模糊,可见淤血和局部肿胀,其内肝细胞破坏不彻底;辐照后1 d 可见炎性细胞浸润,边界较清晰;辐照后3 d 消融区域边缘可见较多正常肝细胞,同时伴有条带状纤维化及少量炎性细胞浸润;辐照后7 d消融灶消失,恢复为正常肝组织。见图5。
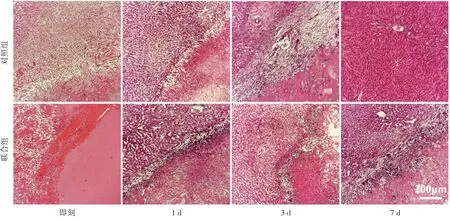
图5 对照组与联合组HIFU辐照后各时间点肝组织病理图(HE染色,×100)
讨论
HIFU是一种安全、有效、无创的肝肿瘤消融疗法,其辐照过程中产生的超声高回声和RMS 变化与其引起的空化效应密切相关[6-7]。肝组织血供丰富,消融时产生的能量易被血流阻挡或随传播深度增加发生声衰减,以及因靶区密度不均匀而不易沉积等[8],严重影响了HIFU 的消融效果。因此,降低声阻抗,改善组织声环境,使超声能量有效沉积于靶区,是目前HIFU 研究的热点。
氟碳液滴常温下为液态,当温度升高或超声辐照时在体内相变为微泡,可以改变组织的声学特性,增强能量沉积,从而增强HIFU 的消融效果[9]。He 等[10]采用载全氟己烷的富勒烯纳米球增效HIFU 治疗离体牛肝时发现,与单纯HIFU 组比较,纳米球组凝固性坏死体积增大了约1.2 倍,差异有统计学意义(P<0.05)。丁晓亚等[11]将离体牛肝分为不同浓度包覆PFP 的介孔氧化硅微球组,使用HIFU 辐照后发现随着微球浓度增高,凝固性坏死体积也随之增加。表明氟碳液滴对HIFU 有增效作用,但并未进一步在动物体内进行验证并探讨其增效机制。
本实验采用薄膜水化法成功制备L-PFP,然后联合HIFU 辐照兔肝。结果表明辐照后对照组和联合组灰度变化值分别为45.60±4.07 和88.00±7.21,累积瞬态空化剂量分别为0.11±0.01 和0.69±0.07,差异均有统计学意义(均P<0.05)。表明L-PFP 联合HIFU 可以引起更强烈的空化泡群,空化效应显著增强。两组辐照后1 d ALT 和AST 均较术前显著增高且随时间降低,联合组辐照后1 d、3 d、7 d ALT 和AST 均明显高于对照组(均P<0.05),对照组辐照前与辐照后7 d 比较差异无统计学意义,说明对照组辐照后7 d 时消融灶损伤修复完全或损伤不明显,表明两组均产生肝组织损伤和修复,L-PFP 提高了HIFU 对肝组织的损伤效果。本研究大体标本及病理检查显示,联合组较对照组造成消融区域的肝细胞损伤和肝淤血现象更严重;随着时间推移,两组均出现充血水肿,并在消融灶周围形成肉芽组织,纤维组织增生,消融灶缩小。无论是解剖坏死范围还是损伤修复时间,联合组均明显大于对照组,证明L-PFP 在动物体内对HIFU 消融肝组织有增效作用。
综上所述,L-PFP 联合HIFU 消融时,空化效应显著增强,对肝脏的消融效果明显提高,消融灶修复时间延长,为探讨氟碳液滴增效HIFU 在临床上的应用提供了实验依据。但本实验仅探讨了氟碳液滴对HIFU消融正常兔肝的空化活动及病理变化,其对热效应及肝肿瘤模型的影响仍需今后进一步研究。

