人参皂苷Rg1水溶性纳米颗粒的制备工艺1)
柴艳敏 陈宁 张紫微 周婉梅 郑威
(哈尔滨商业大学,哈尔滨,150076)
人参是名贵药材,主要含有人参皂苷、人参多糖等活性成分,广泛用于多种疾病的治疗[1]。人参皂苷Rg1属四环三萜类皂苷,具有抗氧化、抗衰老、提高免疫力、保护心血管系统和神经系统等多种药理作用[2-7]。人参皂苷Rg1应用的研究,较多集中于改善认知功能障碍、学习记忆能力、抑制阿尔茨海默病β-淀粉样蛋白(Aβ)沉积方面的研究。由于人参皂苷Rg1具有多靶点、毒性低等优势,可以降低活性氧(ROS)的过多积累,保护神经元,能有效抑制乙酰胆碱水解酶(AchE)活性的能力,进而减少β-淀粉样蛋白的产生,提高阿尔茨海默症(AD)小鼠学习与记忆的能力,发挥抗阿尔茨海默症的作用[8-10]。人参皂苷Rg1是一种包含亲脂性类固醇骨架和亲水性糖环的固醇类化合物,水溶性欠佳、亲水性糖环易发生水解、稳定性差,影响了其治疗效果。但是,关于人参皂苷Rg1水溶性的纳米颗粒制备的研究较少。
羟丙基-β-环糊精(HP-β-CD)属环糊精衍生物,内部筒状空腔结构,具有水溶性好、安全性高等特点,是优选的包合壁材,作为药物辅料在药剂学方面已经有广泛的应用[11]。为此,本研究以人参皂苷Rg1为原料、羟丙基-β-环糊精为载体、人参皂苷Rg1水溶性纳米颗粒粒径为评价指标,通过单因素试验、正交试验优化制备工艺,制备人参皂苷Rg1水溶性纳米颗粒;应用红外光谱、扫描电镜、X射线衍射、热质量分析、体外缓释试验,对人参皂苷Rg1水溶性纳米颗粒进行表征;旨在为人参皂苷Rg1水溶性纳米颗粒制备工艺参数的优选提供技术参考。
1 材料与方法
材料:人参皂苷Rg1标准品、人参皂苷Rg1(质量分数>90%)、羟丙基-β-环糊精(质量分数>98%),由上海源叶生物科技有限公司购入;超纯水、无水乙醇。
仪器与设备:紫外-可见光分光光度计UV-2600(岛津仪器有限公司)、ZetaPALS激光粒度仪(美国布鲁克海文仪器公司)、IRAffinity-1傅里叶变换红外色谱(FTIR,日本岛津公司)、1525高效液相色谱仪(HPLC,WATERS)、NETZ5CH热质量分析仪(德国耐驰)。
人参皂苷Rg1纳米颗粒制备方法:参照文献[12]精密称取一定量羟丙基-β-环糊精,加入一定体积的超纯水,60 ℃溶解后冷却至所需温度;另取一定质量的人参皂苷Rg1,用适量的无水乙醇溶解,超声后用有机滤膜过滤,将人参皂苷Rg1乙醇溶液缓慢滴加到羟丙基-β-环糊精溶液中,恒温下磁力搅拌一定时间,负压旋蒸除去乙醇,冷冻干燥,制得人参皂苷Rg1纳米颗粒,室温保存备用。
单因素试验设计:以人参皂苷Rg1水溶性纳米颗粒的粒径为评价指标,分析m(人参皂苷Rg1)∶V(水)、m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)、反应温度、反应时间、搅拌速度对粒径的影响。
正交试验设计[11]:在单因素试验基础上,以人参皂苷Rg1水溶性纳米颗粒的粒径为评价指标,采用正交试验设计(L9(34))对人参皂苷Rg1水溶性纳米颗粒制备工艺进行优化;各工艺参数设计3个梯度(见表1),每组进行3次平行试验。

表1 人参皂苷Rg1水溶性纳米颗粒制备工艺参数遴选的梯度设计
人参皂苷Rg1水溶性纳米颗粒样品中人参皂苷Rg1质量分数测定:借鉴文献[13]~[15],将标准储备液(1 g·L-1)稀释成不同的质量浓度,采用1525高效液相色谱仪检测,检测波长为203 nm;色谱柱为C18(4.6 mm×250 mm,5 μm)、流动相为V(乙腈)∶V(水)=1∶4、流速为1 mL·min-1、柱温30 ℃、进样量10 μL、保留时间36 min。人参皂苷Rg1回归方程为Y=3×106x-112 555(R2=0.999 7,n=8),式中的Y为峰面积,x为人参皂苷Rg1质量浓度。通过人参皂苷Rg1标准品的标准曲线及保留时间,计算出人参皂苷Rg1在人参皂苷Rg1颗粒中的质量分数。
羟丙基-β-环糊精对人参皂苷Rg1包合效果检测方法:应用红外光谱、X射线衍射分析法进行羟丙基-β-环糊精对人参皂苷Rg1包合效果检测。红外光谱检测的扫描波长范围为400~4 000 cm-1,分别称取200 mg溴化钾样品、2.0 mg人参皂苷Rg1、2.0 mg羟丙基-β-环糊精、2.0 mg人参皂苷Rg1水溶性纳米颗粒,混匀研磨压片进行检测,以溴化钾作空白对照。在检测范围5°~90°、速度5°·min-1,将这3种样品放到具有转动探头的X射线衍射仪上(飞利浦,荷兰),进行分析。
人参皂苷Rg1水溶性纳米颗粒热稳定性分析方法:应用热质量分析方法分析人参皂苷Rg1水溶性纳米颗粒热稳定性。分别称取20~25 mg人参皂苷Rg1、羟丙基-β-环糊精、人参皂苷Rg1水溶性纳米颗粒放在氧化铝坩埚,氮气气氛,加热温度从40~800 ℃,升温速率为10 ℃·min-1;以空坩埚作为基线,对3种样品的热分解规律进行检测。
3种样品的表面形态观察方法:将人参皂苷Rg1、羟丙基-β-环糊精、人参皂苷Rg1水溶性纳米颗粒真空镀金后,通过电子显微镜(MX2600FE,Camscan,UK)扫描,观察3种样品的表面形态特征。
人参皂苷Rg1、人参皂苷Rg1水溶性纳米颗粒体外释放量检测方法:借鉴文献[16],以浓度为0.2 mol·L-1的磷酸盐缓冲盐溶液为溶出介质,将人参皂苷Rg1、人参皂苷Rg1水溶性纳米颗粒样品分别放置在透析袋中,分别在设定的时间取样,通过紫外光光度计对样品溶液中人参皂苷Rg1释放量进行检测分析。
2 结果与分析
2.1 各因素对人参皂苷Rg1水溶性纳米颗粒粒径的影响
m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)对人参皂苷Rg1水溶性纳米颗粒粒径的影响:当其他因素固定(m(人参皂苷Rg1)∶V(水)为1 g∶20 mL、反应温度25 ℃、反应时间45 min、搅拌速度1 200 r·min-1),不同m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)时(1 g∶1 g、2 g∶1 g、3 g∶1 g、4 g∶1 g、5 g∶1 g),人参皂苷Rg1水溶性纳米颗粒粒径分别为(1 019±37)、(622±25)、(496±23)、(401±21)、(406±22)nm;随着羟丙基-β-环糊精用量的增大,人参皂苷Rg1水溶性纳米颗粒粒径呈现先急剧降低,而当羟丙基-β-环糊精用量比超过4 g∶1 g时,趋于平缓。因此,选择m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g。
m(人参皂苷Rg1)∶V(水)对人参皂苷Rg1水溶性纳米颗粒粒径的影响:当其他因素固定(m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g、反应温度25 ℃、反应时间45 min、搅拌速度1 200 r·min-1),不同m(人参皂苷Rg1)∶V(水)时(1 g∶5 mL、1 g∶10 mL、1 g∶20 mL、1 g∶30 mL、1 g∶40 mL),人参皂苷Rg1水溶性纳米颗粒粒径分别为(867±34)、(582±23)、(399±21)、(376±22)、(385±20)nm。随着m(人参皂苷Rg1)∶V(水)的增大,人参皂苷Rg1水溶性纳米颗粒粒径呈现趋势为先急剧降低后趋于平缓;当m(人参皂苷Rg1)∶V(水)高于1 g∶20 mL时,降低幅度不大,过大的m(人参皂苷Rg1)∶V(水)会使后续处理的能耗增加。因此,m(人参皂苷Rg1)∶V(水)确定为1 g∶20 mL。
反应温度对人参皂苷Rg1水溶性纳米颗粒粒径的影响:当其他因素固定(m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g、m(人参皂苷Rg1)∶V(水)为1 g∶20 mL、反应时间45 min、搅拌速度1 200 r·min-1),不同反应温度时(25、40、55、70、85 ℃),人参皂苷Rg1水溶性纳米颗粒粒径分别为(365±20)、(376±23)、(391±21)、(382±22)、(362±21)nm。当反应温度在25~55 ℃时,随着温度升高,人参皂苷Rg1水溶性纳米颗粒粒径呈现逐渐增加的趋势,这主要是因为温度较高使其团聚;当反应温度高于55 ℃时,随着温度的升高,人参皂苷Rg1水溶性纳米颗粒粒径呈现逐渐降低的趋势,这主要是因为高温使乙醇挥发,有利于其形成;但低温条件更有利于制备,因此,反应温度设置为25 ℃。
反应时间对人参皂苷Rg1水溶性纳米颗粒粒径的影响:当其他因素固定(m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g、m(人参皂苷Rg1)∶V(水)为1 g∶20 mL、反应温度25 ℃、搅拌速度1 200 r·min-1),不同反应时间时(15、30、45、60、90 min),人参皂苷Rg1水溶性纳米颗粒粒径分别为(454±21)、(416±20)、(387±22)、(643±25)、(829±31)nm。人参皂苷Rg1水溶性纳米颗粒粒径呈现先逐渐降低、后增加的趋势,这主要是因为随着反应时间延长而使人参皂苷Rg1水溶性纳米颗粒团聚。因此,反应时间选定为45 min。
搅拌速度对人参皂苷Rg1水溶性纳米颗粒粒径的影响:当其他因素固定(m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g、m(人参皂苷Rg1)∶V(水)为1 g∶20 mL、反应温度25 ℃、反应时间45 min),不同搅拌速度时(400、800、1 200、1 600、2 000 r·min-1),人参皂苷Rg1水溶性纳米颗粒粒径分别为(1 724±39)、(826±33)、(397±22)、(406±21)、(421±22)nm。随着搅拌速度的增加,人参皂苷Rg1水溶性纳米颗粒粒径呈现先急剧降低、后缓慢增加的趋势。这主要是因为充分的搅拌有利于纳米颗粒子形成和分散,当搅拌速度过高时,人参皂苷Rg1水溶性纳米颗粒团聚作用增加。因此,最优搅拌速度为1 200 r·min-1。
2.2 人参皂苷Rg1水溶性纳米颗粒制备工艺参数遴选
本研究按照三因素三水平设计正交试验,遴选人参皂苷Rg1水溶性纳米颗粒制备工艺参数。按照试验方案(L9(34)),9组试验结果的人参皂苷Rg1水溶性纳米颗粒粒径分别为(786±24)、(516±27)、(559±29)、(492±22)、(441±23)、(460±26)、(588±31)、(472±32)、(410±28)nm;对试验结果进行极差分析(见表2)、方差分析(见表3)。由表2、表3可见:3个因素对人参皂苷Rg1水溶性纳米颗粒粒径的影响,由大到小依次为m(人参皂苷Rg1)∶V(水)(因素A)、m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)(因素B)、反应时间(因素C);人参皂苷Rg1水溶性纳米颗粒最佳制备工艺为A2B2C2(m(人参皂苷Rg1)∶V(水)为1 g∶20 mL,m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g,反应时间为45 min)。在此条件下,3次平行验证试验获得平均粒径为(405±20)nm、人参皂苷Rg1平均包合率为(87.95±3.41)%。

表2 正交试验结果的各因素不同梯度的均值及极差

表3 正交试验中各因素对试验结果影响的显著性
2.3 人参皂苷Rg1水溶性纳米颗粒性能
由图1可见:人参皂苷Rg1原料为淡黄色块状粉末,而人参皂苷Rg1水溶性纳米粉为均匀乳白色粉末。由扫描电子显微镜扫描结果(见图C)可见,人参皂苷Rg1水溶性纳米粉呈不规则簇状,表面形态为结构松散的短棒状纳米颗粒,颗粒之间缝隙明显,说明其具有较大的比表面积,水溶解性能得到较明显提高。

A为人参皂苷Rg1原料照片;B为人参皂苷Rg1水溶性纳米颗粒照片;C为人参皂苷Rg1水溶性纳米颗粒的扫描电子显微镜扫描图。
人参皂苷Rg1水溶性纳米颗粒的热稳定性:物质热解过程通常分为3个阶段[17],差热质量分析法曲线的峰值表示该温度下样品的最大质量损失。人参皂苷Rg1原料、羟丙基-β-环糊精、人参皂苷Rg1水溶性纳米颗粒热质量分析表明:在200~220 ℃处,人参皂苷Rg1有明显的低相对分子质量组分热解峰,并且在300~390 ℃处还有较宽的高相对分子质量组分热解峰;而羟丙基-β-环糊精,在350 ℃附近只有1个明显的高相对分子质量组分热解峰;人参皂苷Rg1水溶性纳米粉,不仅在230 ℃附近有低相对分子质量组分热解峰,在345 ℃附近还有1个明显的高相对分子质量组分热解峰;说明人参皂苷Rg1和羟丙基-β-环糊精,可以通过实验方法很好地形成人参皂苷Rg1水溶性纳米粉。
羟丙基-β-环糊精对人参皂苷Rg1的包合效果:①经人参皂苷Rg1水溶性纳米粉、原料及羟丙基-β-环糊精红外谱图分析,在3 266 cm-1处人参皂苷Rg1有较强的羟基伸缩振动吸收峰,羟丙基-β-环糊精也有此现象,而人参皂苷Rg1水溶性纳米粉的羟基伸缩振动吸收峰则明显减弱;这表明人参皂苷Rg1和羟丙基-β-环糊精之间,通过氢键缔合反应,形成稳定的人参皂苷Rg1水溶性纳米粉。在2 982、2 853 cm-1处为甲基和亚甲基振动吸收峰;在1 692 cm-1处为羰基(—CO)伸缩振动峰;此外,位于935 cm-1处吸收峰,代表双键上的—CH平面外变形振动。人参皂苷Rg1水溶性纳米粉的谱图和羟丙基-β-环糊精的吸收光谱相似,也说明羟丙基-β-环糊精对人参皂苷Rg1形成了很好的纳米包合作用。②羟丙基-β-环糊精、人参皂苷Rg1原料、人参皂苷Rg1水溶性纳米颗粒的X射线衍射实验结果表明,羟丙基-β-环糊精和人参皂苷Rg1水溶性纳米粉有2个相似的X射线衍射峰,分别在衍射角11°、18°有衍射峰出现。人参皂苷Rg1水溶性纳米粉的峰型,没有羟丙基-β-环糊精的峰型尖锐,其中人参皂苷Rg1的特征峰消失,而人参皂苷Rg1在衍射角17°左右有尖锐的衍射峰。这些都说明,羟丙基-β-环糊精对人参皂苷Rg1进行了很好的包合,形成结构均一的人参皂苷Rg1水溶性纳米粉。
人参皂苷Rg1水溶性纳米颗粒体外溶出性能:依据2020年版《中国药典》测定溶出度。称取一定质量的人参皂苷Rg1水溶性纳米颗粒、人参皂苷Rg1,以pH为6.8的磷酸盐缓冲液为溶媒,配置释放溶液体系,溶液温度控制在(37.0±0.5)℃范围,转速为100 r·min-1,按照预定时间分别吸取这两种样品溶液5.0 mL,并补充等体积新鲜的磷酸盐缓冲液到溶液体系,以便保持溶液总体积不变。用0.45 μm微孔滤膜滤过后,参照高效液相色谱法测定峰面积,计算人参皂苷Rg1溶出度(见表4)。由表4可见:人参皂苷Rg1水溶性纳米颗粒、人参皂苷Rg1在溶解25 min时的溶出率,分别达到了90.88%、58.42%,具有显著差异性;表明人参皂苷Rg1水溶性纳米颗粒的溶出更迅速、水溶性更好、生物活性更佳。
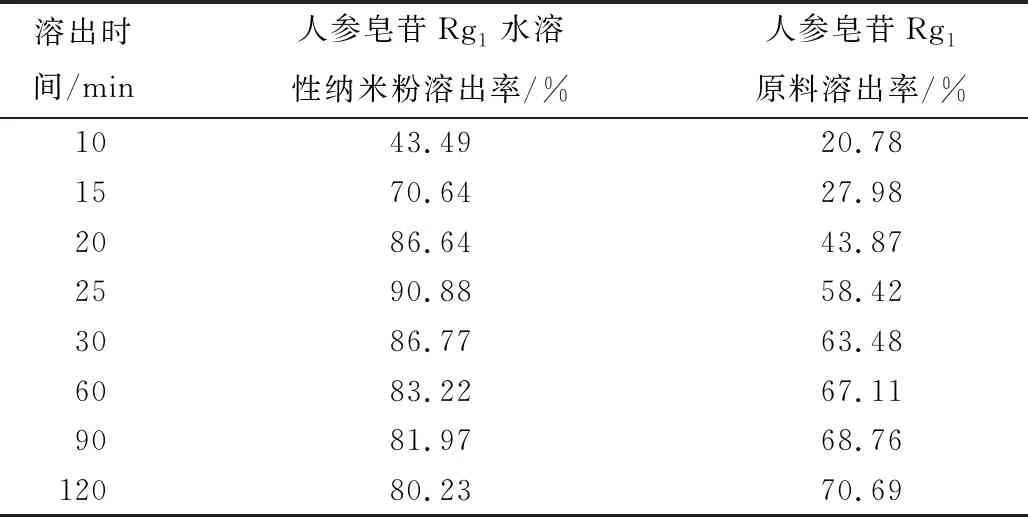
表4 人参皂苷Rg1水溶性纳米粉和人参皂苷Rg1原料体外溶出时效
3 结论
本研究以人参皂苷Rg1为原料、羟丙基-β-环糊精为载体、人参皂苷Rg1水溶性纳米颗粒的粒径为评价指标,通过单因素试验、正交试验对人参皂苷Rg1水溶性纳米颗粒制备工艺进行优化,并获得最优制备工艺(m(人参皂苷Rg1)∶V(水)为1 g∶20 mL、m(羟丙基-β-环糊精)∶m(人参皂苷Rg1)为4 g∶1 g、反应温度为25 ℃、反应时间为45 min)。通过验证试验获得平均粒径为(405±20)nm的人参皂苷Rg1水溶性纳米颗粒,具有良好的水溶性和体外释放能力。本研究为难溶性的人参皂苷开发和利用提供了基础数据和技术支撑,将为一些退行性神经疾病治疗药物的开发提供参考,也为人参皂苷Rg1广泛的应用前景提供支持。

