rAd-p53联合TACE治疗原发性肝癌有效性和安全性的Meta分析
李代龙 庞雅琪 许新华
(三峡大学 第一临床医学院[宜昌市中心人民医院] 肿瘤科 & 三峡大学 肿瘤防治中心, 湖北 宜昌 443003)
2020年底,国际癌症研究中心发布的GLOBOCAN 2020数据显示,原发性肝癌(primary liver cancer,PLC)已是全球癌症发病率第6位、死亡率第3位的恶性肿瘤[1]。作为肝癌高发地区,2020年中国新发肝癌病例约占全球的45%[1]。手术是早期肝癌的主要治疗手段,但由于肝癌早期临床症状不明显,病情进展迅速,患者就诊时往往已处于中晚期,失去了最佳手术时机[2]。肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)是无法手术切除的中晚期肝癌首选治疗方法之一[3]。局部高浓度化疗药物可持续作用于肿瘤细胞,同时阻断肿瘤供血动脉使肿瘤细胞缺血、缺氧坏死。然而随着临床实践的不断深入,TACE暴露出诸多问题,临床疗效差强人意[4]。
P53抑癌基因缺失或突变与肿瘤恶性转化和进展有关[5]。有研究表明,大约50%肝癌患者肿瘤细胞内存在p53基因缺失[6]。重组人p53腺病毒注射液(rAd-p53,Gendicine,今又生)是世界上第一个获准上市的肿瘤基因治疗药物,对改善多种肿瘤预后具有重要作用[7-8]。
多项研究显示,rAd-p53联合TACE可改善PLC患者的临床结局[9-10]。但目前鲜有关于rAd-p53联合TACE治疗PLC有效性和安全性的系统评价。因此,本研究拟采用Meta分析方法系统评价rAd-p53联合TACE治疗PLC的有效性和安全性,以期为临床应用提供循证依据。
1 资料和方法
1.1 数据库检索
这项荟萃分析根据系统评价和荟萃分析的首选报告条目(preferred reporting items for systematic evaluation and meta-analysis,PRISMA)进行。通过检索PubMed、EMBASE、Cochrane Library、CNKI、万方数据库,检索时限为建库至2021年5月5日。中文检索词:“原发性肝癌”、“肝细胞癌”、“肝肿瘤”、“肝动脉化疗栓塞”、“TACE”、“重组人p53腺病毒”、“今又生”。英文检索词包括:“liver cancer”、“hepatocellular carcinoma”、“HCC”、“transcatheter arterial chemoembolization”、“TACE”、“recombinant human adenovirus-p53”、“rAd-p53”、“Gendicine”。同时追溯纳入研究的参考文献,中英文不限。
1.2 纳入和排除标准
1.2.1 纳入标准
①研究类型:临床前瞻性研究;②研究对象:经病理或临床诊断为PLC,已失去手术时机或患者不愿接受手术治疗;③干预措施:两组均接受TACE治疗,实验组在TACE的基础上将rAd-p53经肝动脉导管缓慢注入肿瘤供血动脉内;④结局指标:如客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、生存率及不良反应等。参照WHO实体瘤疗效标准:疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)、进展(progressive disease,PD),其中近期疗效包括ORR和DCR,ORR=(CR+PR)/总病例数×100%,DCR=(CR+PR+SD)/总病例数×100%。Karnofsky评分(KPS评分)标准:根据患者能否正常活动、生活能否自理及病情程度分为10个等级,10分为一个等级,100 分是能像正常人一样活动,0分是患者死亡。得分越高,患者健康状况越好;⑤文献以中文或英文出版;⑥文献是原始研究,能提供原始数据。
1.2.2 排除标准
①综述、病例报道、会议摘要、硕博论文、非临床研究及重复研究;②数据不完整且无法获得原始资料的文献;③病例数<30例的研究;④B超或CT引导下经皮肿瘤内注射rAd-p53。
1.3 数据提取和文献质量评价
两位评审员筛选文献,提取数据,并独立交叉核对,以确保从文献中提取的数据一致。遇分歧时,通过讨论或参考第三位研究者的意见决定。这些文献严格按照纳入及排除标准进行筛选。随机对照试验按Cochrane量表评分[11],前瞻性队列研究按NOS量表评分[12]。
1.4 统计学分析
采用RevMan 5.4版软件进行数据处理。二分类资料用相对危险度(relative risk,RR)及95%可信区间(confidence interval,CI)作为评价指标,连续性变量采用均数差(mean deviation,MD)及95%CI进行效应合并分析,并绘制Meta分析森林图。使用Q检验及I2统计量对异质性进行评估,若同质性较好(P≥0.1,I2≤50%)采用固定效应模型,若异质性较高(P<0.1,I2>50%)采用随机效应模型。敏感性分析检验结果的稳定性,通过漏斗图评价发表偏倚。P<0.05认为差异有统计学意义。
2 结果
2.1 文献检索结果
共检索到124篇文献,通过标题、年份及作者信息排除重复文献36篇,然后经过阅读摘要及全文筛选后,排除不符合标准的文献78篇,最终纳入10篇文献[13-22](见图1)。

图1 文献筛选流程图
2.2 纳入文献基本特征及质量评价结果
纳入符合标准的3篇随机对照试验(randomized controlled trial,RCT),7篇前瞻性队列研究(prospective cohort study, PCS),共10篇文献[13-22]。共计684例患者,其中rAd-p53联合TACE组311例,单纯TACE组373例。纳入的3篇RCT质量等级评价为B级,纳入的7篇PCS的NOS评分均≥6分,具体见表1和表2。所有纳入的研究均提供了ORR和DCR数据,部分研究提供了KPS评分、生存率和不良反应发生率数据,具体见表3。

表1 纳入的随机对照试验质量评价

表2 对纳入的前瞻性队列研究采用NOS量表评分

表3 纳入文献基本特征
2.3 Meta分析结果
2.3.1 ORR
10项研究[13-22]提供了ORR数据,异质性检验结果显示各研究间异质性较小(P=0.98,I2=0%)。采用固定效应模型分析显示,rAd-p53联合TACE组治疗PLC的ORR高于单纯TACE组,差异具有统计学意义(RR=1.48, 95%CI:1.29~1.69,P<0.000 01),见图2。
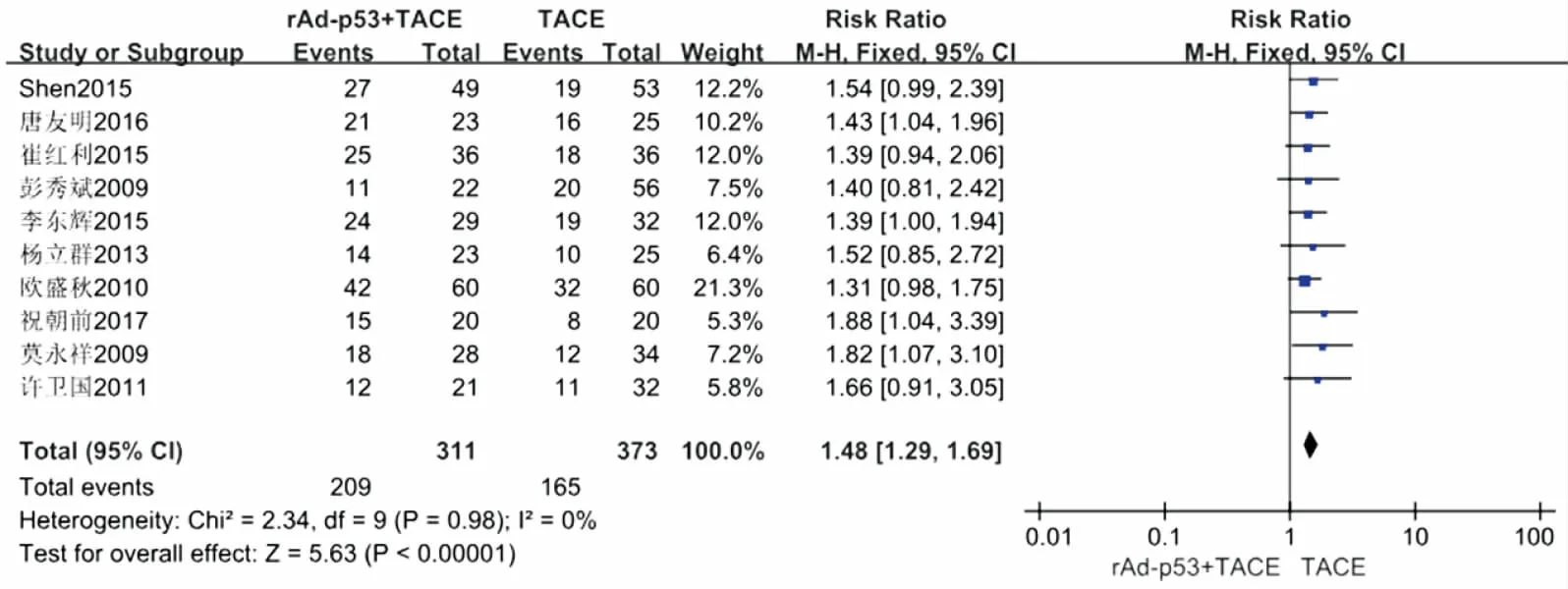
图2 rAd-p53联合TACE与单纯TACE治疗PLC的ORR森林图
2.3.2 DCR
10项研究[13-22]提供了DCR数据,异质性检验结果显示各研究间异质性较小(P=0.71,I2=0%)。固定效应模型分析显示,rAd-p53联合TACE组治疗PLC的DCR高于单纯TACE组,差异具有统计学意义(RR=1.14, 95%CI:1.07~1.22,P=0.000 1),见图3。

图3 rAd-p53联合TACE与单纯TACE治疗PLC的DCR森林图
2.3.3 KPS评分
2项研究[15,18]提供了治疗前后患者KPS评分数据,异质性检验结果显示各研究间异质性较小(P=0.34,I2=0%)。固定效应模型分析显示,rAd-p53联合TACE组较单纯TACE组可明显提高患者的KPS评分,差异具有统计学意义(MD=5.85, 95%CI: 0.37~11.32,P=0.04),见图4。

图4 rAd-p53联合TACE与单纯TACE治疗PLC患者的KPS评分森林图
2.3.4 6个月生存率
4项研究[17-18,20,22]提供了6个月生存率数据,异质性检验结果显示各研究间存在明显的异质性(P<0.000 01,I2=90%)。随机效应模型分析显示,rAd-p53联合TACE组与单纯TACE组治疗PLC的6个月生存率差异无统计学意义(RR=1.21, 95%CI:0.92~1.60,P=0.17),见图5。

图5 rAd-p53联合TACE与单纯TACE治疗PLC的6个月生存率森林图
2.3.5 1年生存率
4项研究[13,17,20,22]提供了1年生存率数据,异质性检验结果显示各研究间异质性较小(P=0.37,I2=4%)。固定效应模型分析显示,rAd-p53联合TACE组与单纯TACE组治疗PLC的1年生存率差异无统计学意义(RR=1.15, 95%CI:0.98~1.35,P=0.08),见图6。

图6 rAd-p53联合TACE与单纯TACE治疗PLC的1年生存率森林图
2.3.6 2年生存率
两项研究[13,22]提供了2年生存率数据,异质性检验结果显示各研究间存在异质性(P=0.12,I2=59%)。随机效应模型分析显示,rAd-p53联合TACE组与单纯TACE组治疗PLC的2年生存率差异无统计学意义(RR=1.70, 95%CI:0.74~3.93,P=0.21),见图7。

图7 rAd-p53联合TACE与单纯TACE治疗PLC的2年生存率森林图
2.3.7 不良反应发生率
与单纯TACE组相比,rAd-p53联合TACE组发热发生率较高(P=0.03),而恶心呕吐、腹痛、乏力、肝功能损害、白细胞减少、血小板减少和胃肠道反应的发生率未见明显增加(均P>0.05),见表4。

表4 rAd-p53联合TACE与单纯TACE治疗原发性肝癌的不良反应发生率比较
2.3.8 敏感性分析和发表偏倚检测
对每项Meta分析进行敏感性分析检测,即每删除一项研究后评估结果的稳定性。结果显示相应的RR、MD值无明显改变,表明研究结果稳定。最后采用漏斗图判断文献发表的偏倚程度,结果显示漏斗图基本对称,提示无明显发表偏倚,见图8。
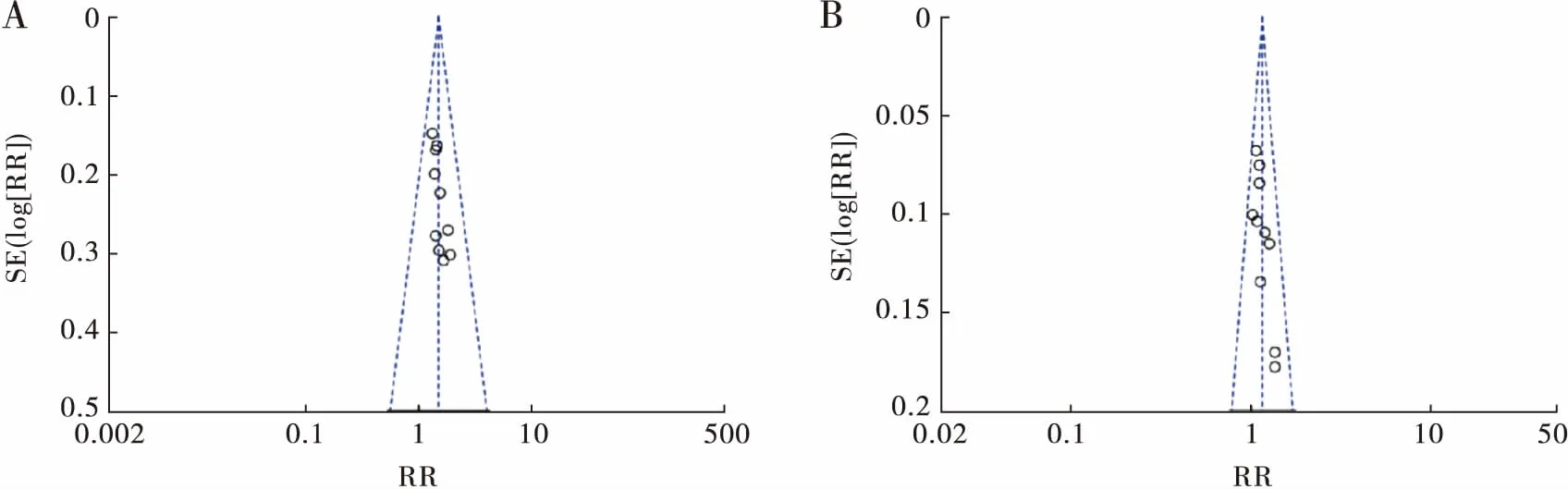
图8 ORR(A)和DCR(B)漏斗图
3 讨论
TACE作为中晚期肝癌患者的一线治疗方案,通过阻断肿瘤血供使肝肿瘤缺血、缺氧坏死,同时局部高浓度的化疗药物可持续杀伤肿瘤细胞,因此近期疗效显著[23]。然而,单纯采用TACE治疗可造成部分肿瘤病灶栓塞不彻底,坏死不完全。TACE术后残留的肿瘤细胞仍具有较强的生长能力,会导致肿瘤复发,从而导致患者需定期重复行TACE治疗[13]。尽管如此,患者的生存率并没有明显提高。因为反复行TACE治疗不可避免损伤正常肝实质,加重肝功能损害,且TACE术后造成的缺氧微环境会导致促血管生成因子上调,诱导肿瘤新生血管生成,从而促进肿瘤复发、扩散和转移,影响远期疗效[24]。
众所周知,p53基因是人体内重要的抑癌基因,在肿瘤细胞的凋亡和坏死过程中起重要作用[25]。当其发生基因突变或丢失,即可转变为突变型,失去对细胞的生长抑制作用,甚至可能具备癌基因的活性,导致肿瘤发生[20]。研究表明,p53基因是肝癌细胞中突变频率最高的基因,突变频率高达50%[6]。因此,向肝肿瘤细胞内人工导入野生型p53基因可能有助于肝癌的治疗。
以5型腺病毒为载体的p53抑癌基因临床治疗药物“重组人p53腺病毒(rAd-p53)注射液”又名“今又生”是世界上第一个获批上市的肿瘤基因治疗药物,目前已被批准用于头颈部鳞状细胞癌的治疗[26]。rAd-p53是一种有前景的肝癌治疗药物,经肝动脉灌注其注射液在国内外临床试验中取得了确切疗效[27-29]。但灌注后p53基因制剂会随血液循环逐渐从靶器官流失,血药浓度逐渐下降,难以保证p53基因制剂在肝癌组织内高效定向表达,从而影响治疗效果[30]。rAd-p53联合TACE可明显减少p53基因制剂从瘤区流失,保证了rAd-p53在瘤区的高浓度,有利于p53基因在肝癌组织内的定向表达。其次,p53基因能协同经肝动脉灌注的化疗药物,增强对肿瘤细胞的杀伤作用[31]。
目前rAd-p53联合TACE治疗PLC的临床研究报道较多,本文纳入10项研究,共计684例患者,Meta分析结果显示,rAd-p53联合TACE可提高ORR、DCR和KPS评分,但两组间6个月、1年和2年生存率差异无统计学意义。rAd-p53联合TACE组出现发热反应的发生率高于单纯TACE组,而恶心呕吐、腹痛、乏力、肝功能损害、白细胞减少、血小板减少和胃肠道反应的发生率未见增加。
本研究也存在一定的局限性。首先,纳入Meta分析的10项研究主要集中在中国人群中。其次,患者的信息有限,而且总样本量较少。再者,rAd-p53注射液的使用剂量和治疗时长以及化疗栓塞的药物不完全一致,有潜在的异质性存在。最后,使用英文和中文检索文献,可能有潜在的发表偏倚,尽管发表偏倚在本研究中并不显著。
综上所述,rAd-p53联合TACE较单纯TACE治疗PLC有一定的临床获益,且安全性尚可,但中远期临床疗效未见明显改善。因纳入的研究数量较少,提供中远期疗效数据的研究有限,无法对rAd-p53注射液的使用剂量、化疗栓塞药物等可能影响治疗疗效的因素进一步分析,因此需要更多高质量的RCT进一步证实其疗效。

