Kv1.3钾离子通道阻断剂抑制NLRP3炎症小体活化的研究
余筱敏
(新乡医学院基础医学院,河南 新乡 453003)
炎症小体是由模式识别受体(PRRs),凋亡样斑点样蛋白ASC和效应蛋白pro-caspase1共同构成的多蛋白寡聚体,是固有免疫的重要组成部分.炎症小体通过切割炎性因子IL-1β和IL-18起到进一步放大炎症信号的作用,并受到宿主的严格调控[1-2].炎症小体已被证实与急性肺损伤、急性肠炎、动脉粥样硬化、非酒精性脂肪肝、多发性硬化症、阿尔兹海默症、帕金森、Ⅱ型糖尿病等多种疾病相关[3-5].
靶向炎症小体成为多种疾病治疗的新思路.由于能够被多种刺激所激活,目前普遍认为钾离子外流是多种刺激因素下游的共同结果.钾离子通道Kv1.3是表达于淋巴细胞、中枢神经细胞的能够调控细胞多种生理功能的电压门控离子通道[6],在炎性LPS刺激下其表达上调,已被证实是多种自身免疫性疾病的靶标.有研究表明Kv1.3通道的小分子抑制剂PAP-1能够改善葡聚糖硫酸钠(DSS)引起的结肠病理损伤,同时伴随着NLRP3炎症小体活化程度减轻的现象,并且阻断Kv1.3通道能够抑制TLR4受体通路激活,Kv1.3通道可能与NLRP3炎症小体的激活有关[7-9].
本研究旨在探讨钾离子通道Kv1.3与NLRP3炎症小体激活之间的关系.通过在人来源的单核细胞系THP-1中构建LPS联合ATP双刺激的NLRP3炎症小体激活体系,探究钾离子通道Kv1.3阻断剂对NLRP3炎症小体活化的抑制现象.提示钾离子通道Kv1.3可能是一个潜在的靶点,靶向钾离子通道Kv1.3抑制NLRP3炎症小体的激活,可以为多种疾病治疗提供一种新思路.
1 材料与方法
1.1 试剂材料
1.1.1 主要试剂 超敏ECL化学发光试剂盒,碧云天生物技术有限公司;ASC抗体,美国Santa Cruz有限公司;caspase 1抗体,IL-1β抗体,美国Abcam有限公司;NLRP3,美国R&D有限公司;山羊抗兔lgG二抗、HRP辣根过氧化物酶标记、山羊抗小鼠lgG二抗、HRP辣根过氧化标记、山羊抗大鼠lgG二抗、HRP辣根过氧化标记、驴抗兔IgG二抗、DyLight 488标记、DyLight 594标记均来自美国Abbkine有限公司.
1.1.2 试验动物与细胞6-8周龄,SPF级雌性SD大鼠购买于湖北省疾病预防与控制中心.THP-1细胞由武汉大学病理学与病理生理学实验室冻存.
1.2 试验方法
1.2.1 THP-1细胞系中构建NLRP3炎症小体激活模型THP-1细胞是人外周血的单核细胞系,佛波酯是广泛用于体外试验激活PKC激活剂,质量浓度为100 ng/mL的PMA处理THP-1细胞1 d,可以诱导其分化为巨噬细胞,在显微镜下观察可以看到细胞由悬浮态变为贴壁,有触角伸出.质量浓度1μg/mL LPS刺激6 h联合浓度5 mmol/LATP刺激0.5 h,在THP-1细胞中构建NLRP3炎症小体激活模型.
1.2.2 酶联免疫吸附试验 将THP-1细胞铺96孔板,分组为:对照组,质量浓度1μg/mL LPS+浓度5 mmol/L ATP为双刺激组,浓度为10μmol/L PAP-1,1μmol/L PAP-1,100 nmol/L PAP-1,100 pmol/L ADWX-1预处理组.质量浓度为100 ng/mL PMA处理THP-1细胞1 d后,不同浓度的PAP-1和100 pmol/L ADWX-1预处理1.0 h,其余组换液处理.1.0 h后除对照组外,其余各组中加入LPS刺激剂(质量浓度为1μg/mL)处理.对照组中加入等量的培养基,37℃,CO2培养箱中培养6.5 h.除对照组外,其余各组加入ATP刺激剂(浓度为5 mmol/L),对照组加入等量的培养基,37℃培养箱中培养0.5 h.收集上清,1 500 r/min,离心5 min,分离悬浮细胞,取上清待检测.酶标仪检测波长为450 nm.
1.2.3 PBMC细胞培养 体质量200~230 g之间的SD雌鼠,经体积分数为10%水合氯醛进行麻醉.沿大鼠腹白线剪开,在位于左腹部脾脏下的腹主静脉处进针,肝素抗凝管收集,将稀释的外周血缓慢沿壁加入分离液中,37℃,1 500 r/min,45 min离心.小心吸取白膜层细胞,离心弃上清,用完全培养基重悬细胞,培养条件为37℃,体积分数为5%的CO2.
1.2.4 免疫印迹试验RIPA裂解液收集六孔板细胞裂解物,对蛋白样品的浓度进行测定.根据分子量大小,选择配制分离胶、浓缩胶,设置浓缩胶电泳条件为80 V,0.5~1.0 h,分离胶电泳条件为120 V,1.0~2.0 h.恒流模式,273 mA,电压在80~120 V之间进行转膜.用质量浓度5%的BSA封闭液室温封闭3.0 h.一抗稀释液4℃封闭过夜,TBST漂洗;二抗稀释液中室温封闭孵育3.0 h,TBST漂洗.避光配制超敏显色化学发光液,全自动化学发光图像分析系统进行曝光.
1.2.5 免疫荧光试验THP-1细胞接种在confocol皿,分组为:对照组,双刺激组,浓度为10μmol/L PAP-1预处理组,弃上清,PBS清洗杂质.多聚甲醛固定,Triton X-100室温通透,PBS漂洗,山羊血清37℃封闭1.0 h,加一抗稀释液,4℃孵育过夜,PBS漂洗;二抗稀释液室温避光孵育1.0 h,PBS漂洗,滴加DAPI避光孵育,PBS漂洗.激光扫描共聚焦显微镜下进行观察,并采集图像进行分析.
1.2.6 荧光实时定量PCRTrizol重悬PBMC细胞,转移至RNA free的Ep管中,提取细胞RNA.分光光度计测RNA浓度和纯度,配制Mix溶液进行逆转录.采用SYBR Green荧光染料实时定量PCR法检测ConA刺激的PBMC中,给药前后IL-1β、ASC、NLRP3变化.
1.3 图像分析及数据处理
用Image J软件来统计免疫荧光图片的平均荧光强度,蛋白免疫印迹图片的平均灰度值.用PhotoshopCS6软件来作图.用Graph Pad Prism7.0软件统计酶联免疫吸附试验,实时荧光定量分析.采用Tukey检验法分析(Oneway ANOVA)进行单因素方差组间比较.用bonferroni检验法进行双因素方差分析(Twoway ANOVA).
2 结果与分析
2.1 Kv1.3阻断剂抑制THP-1细胞上清中IL-1β分泌
Kv1.3阻断剂抑制THP-1细胞上清中IL-1β分泌结果如图1所示.
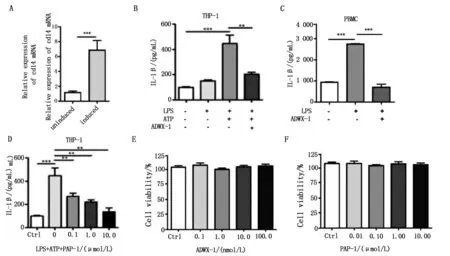
图1 Kv1.3阻断剂抑制THP-1细胞IL-1β分泌Fig.1 Kv1.3 blockers inhibit thesecretion of IL-1βin THP-1 cells
由图1可知,PMA成功诱导单核细胞THP-1分化为巨噬细胞,THP-1细胞表面cd14 mRNA表达上调(图1-A).CCK8试验表明不同浓度的ADWX-1和PAP-1处理对THP-1细胞生存没有影响(图1-E,图1-F).NLRP3炎症小体可以被多种因素激活,包括尿酸钠、二氧化硅、明矾、石棉、ATP和尼日利亚菌素等,LPS联合ATP刺激是公认的细胞水平的激活方法.ELISA结果显示,LPS单刺激组上清中IL-1β的本底水平较低.当质量分数1μg/mLLPS刺激6 h联合浓度为5 mmol/LATP刺激0.5 h时,细胞上清中IL-1β的分泌比对照组、LPS单刺激组明显增多,差异极显著.IL-1β生成是NLRP3炎症小体激活的下游事件,死亡或受损的细胞可以通过释放IL-1β将危险信号传递出去.
实验室前期通过对天然蝎毒肽的分子设计改造,设计筛选得到了高选择性的Kv1.3通道阻断剂ADWX-1[10].电生理学实验显示ADWX-1抑制Kv1.3电流的半数有效抑制浓度为IC50=2 pmol/L.浓度为100 pmol/LADWX-1预处理细胞1 h,然后给予上述同等条件的LPS联合ATP刺激时,细胞上清中IL-1β的分泌减少几乎至本底水平(图1-B).PAP-1是Kv1.3通道的小分子抑制剂.ELISA结果显示,浓度为100 nmol/L,浓度为1μmol/L,浓度为10μmol/L的PAP-1预处理1 h后,再给予上述同等条件的双刺激,不同浓度的PAP-1均可以呈浓度梯度依赖性的抑制THP-1细胞上清中的IL-1β水平(图1-D),浓度越高抑制效果越好,当PAP-1浓度为10μmol/L时能降低至本底水平.Kv1.3通道阻断剂ADWX-1和PAP-1均能够抑制THP-1细胞中由LPS、ATP双刺激引起的IL-1β的分泌.分离大鼠外周血单个核细胞、PBMC中主要包含淋巴细胞、单核细胞、树突状细胞和其他少量细胞.ADWX-1可以抑制大鼠外周血中LPS刺激引起的IL-1β的分泌(图1-C).
2.2 Kv1.3阻断剂抑制THP-1细胞裂解物中IL-1β,caspase-1蛋白表达
Kv1.3阻断剂抑制THP-1细胞裂解物中IL-1β,caspase-1蛋白表达结果如图2所示.
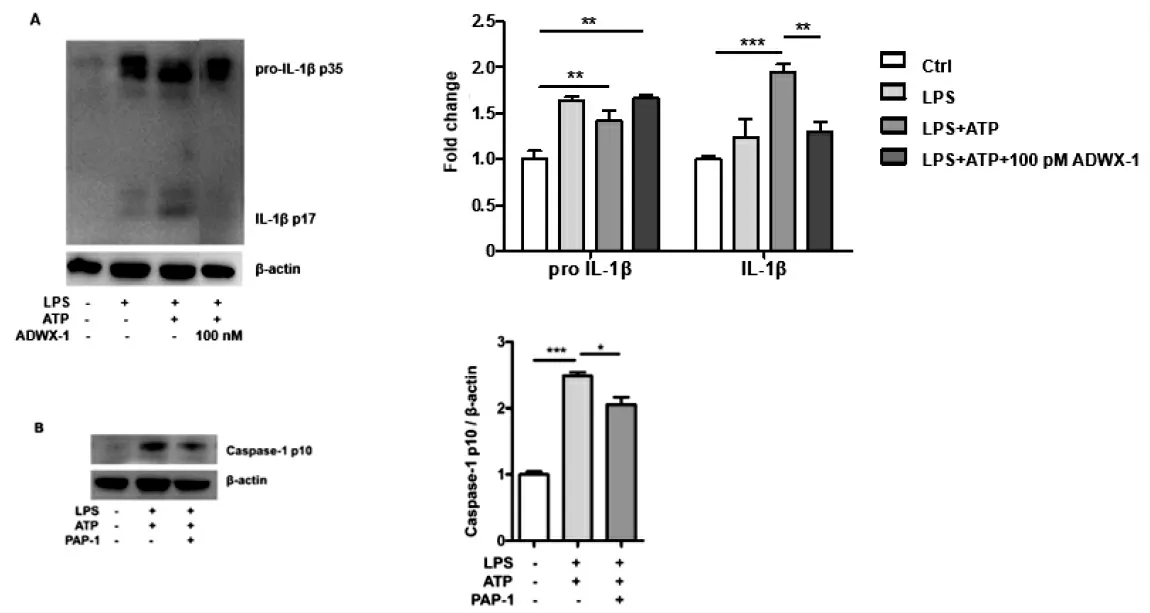
图2 Kv1.3阻断剂抑制THP-1细胞裂解物中IL-1β,caspase-1蛋白表达Fig.2 Kv1.3 blockersinhibits IL-1βand caspase-1 protein expressionin THP-1 cell lysate
由图2可知,活化的Caspase-1切割IL-1β前体生成有活性的IL-1β成熟体,释放到细胞外,募集炎症细胞.对照组中没有IL-1β前体p35和切割片段p17的生成.LPS单刺激会导致IL-1β前体p35的表达,几乎无成熟片段p17的生成.相较于对照组和单刺激组,LPS、ATP双刺激组中有明显的成熟的IL-1β片段p17的表达(图2-A),表明双刺激引起的NLRP3炎症小体激活会引起caspase-1的自剪切激活,切割IL-1β前体p35为成熟片段p17.而浓度为100 pmol/L ADWX-1预处理组IL-1β片段p17表达减少,证实ADWX-1预处理可以抑制炎症小体激活下游IL-1β成熟片段的表达.浓度为10μmol/L PAP-1预处理1 h后,双刺激6.0 h后THP-1细胞裂解物中Caspase-1切割片段p10相较于双刺激组减少(图2-B).以上结果说明,钾离子通道Kv1.3阻断剂能够抑制NLRP3炎症小体激活下游Caspase-1的激活和IL-1β成熟体的生成.
2.3 Kv1.3阻断剂抑制THP-1细胞中ASC斑点形成
Kv1.3阻断剂抑制THP-1细胞中ASC斑点形成结果如图3所示.

图3 Kv1.3阻断剂抑制THP-1细胞中ASC斑点形成Fig.3 Kv1.3 blockersinhibit the formation of ASCspecksin THP-1 cell
由图3可知,ASC是炎症小体复合物中的接头分子,一方面通过PYD区域与NLRP3结合在一起,另一方面通过自身的CARD结构域招募pro-caspase1分子,促进pro-caspse1的自活化和剪切.其主要定位于巨噬细胞和黏膜上皮细胞中,在炎症小体未激活的细胞中,ASC均匀的分布于细胞质和细胞核中.而在炎症小体激活后,ASC会迅速的由单体形式变为二聚体及多聚体形式,在核周聚集,形成一个胞质超分子复合物,被称为ASC斑点[11-12].免疫荧光结果显示,THP-1细胞经LPS和ATP双刺激后,ASC表达显著增强(图3-B),有亮度极强的ASC斑点的形成.在共聚焦显微镜下继续观察,弥散分布的ASC有向核周聚集的趋势,聚集处亮度增强(图3-A),表明双刺激下NLRP3炎症小体被激活,而对照组则没有ASC斑点存在.免疫荧光结果进一步表明LPS、ATP双刺激会显著增加ASC的表达,促进ASC斑点的形成,而浓度为10μmol/L PAP-1给药组ASC荧光亮度减弱(图3-B),ASC斑点数目减少.
2.4 Kv1.3通道阻断剂抑制IL-1β、ASC、NLRP3 mRNA水平
Kv1.3通道阻断剂抑制IL-1β、ASC、NLRP3 mRNA水平结果如图4所示.
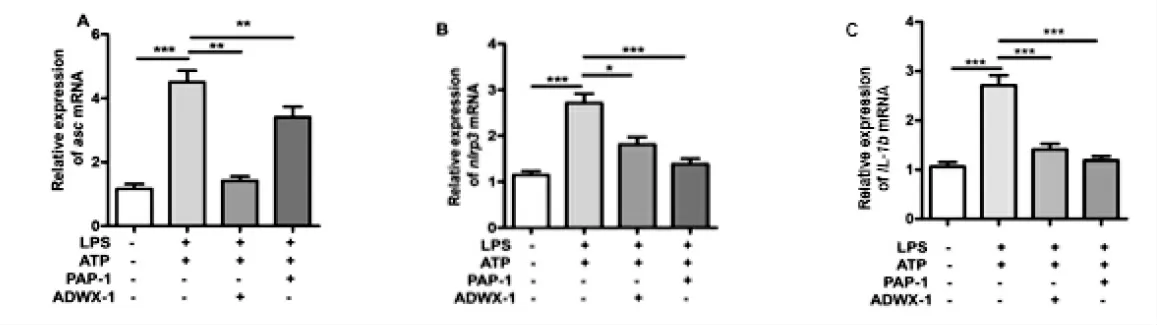
图4 Kv1.3通道阻断剂抑制IL-1β、ASC、NLRP3转录Fig.4 Kv1.3channel blockersinhibit IL-1β,ASC,NLRP3 transcription
由图4可知,炎症小体的激活分为两步,第一步需要NLRP3,IL-1βmRNA的生成,第二步是炎症小体复合物的组装.Kv1.3抑制剂可能通过影响第一信号或者第二信号抑制炎症小体的激活.RT-qPCR结果显示质量浓度1μg/mLLPS联合浓度为5 mmol/LATP双刺激会上调THP-1细胞NLRP3和IL-1β、ASCmRNA水平,而浓度为100pmol/LADWX-1预给药和浓度为10μmol/LPAP-1预处理均会下调NLRP3、IL-1β、ASC的mRNA水平,提示Kv1.3通道阻断剂可能是通过下调NLRP3和IL-1β的转录水平来发挥抑制炎症小体激活的功能.
3 结论与讨论
本研究在THP-1细胞系中成功构建了LPS、ATP双刺激引起的NLRP3炎症小体激活模型,发现Kv1.3通道阻断剂PAP-1和ADWX-1能有效抑制THP-1细胞中由LPS和ATP双刺激引起的NLRP3炎症小体的激活.
ELISA结果表明PAP-1和ADWX-1都能够抑制LPS、ATP双刺激下THP-1细胞上清中IL-1β的分泌.浓度为100 pmol/L ADWX-1能达到浓度为10μmol/LPAP-1的抑制效果.PAP-1是一种常用的化学合成的小分子抑制剂,其对Kv1.3通道的半数有效抑制浓度为2 nmol/L,而根据天然蝎毒肽改造的多肽ADWX-1具有特异性更强,选择性更高等优点.其对Kv1.3通道选择性是Kv1.1通道的300倍,Kv1.2通道的100 000倍,进一步验证了Kv1.3钾离子通道在NLRP3炎症小体激活中的关键作用.双孔钾离子通道TWIK2,ATP敏感的阳离子通道P2X7R,钾离子通道孔隙形成亚基Kir6.1都被发现参与调控NLRP3炎症小体的激活[13-15].目前有观点认为,ATP敏感的非选择性的阳离子通道P2X7R可以直接介导细胞内钾离子的流出,或者间接促进细胞钾离子通道的开放,从而激活炎症小体.因此Kv1.3可能并不是介导钾离子流出的唯一途径,后期可以用电生理实验记录NLRP3炎症小体活化前后Kv1.3单通道的电流变化情况以及总的钾离子通道的电流变化情况,进一步验证该假设.此外也可以通过构建Kv1.3缺陷细胞株来排除其他钾离子通道对NLRP3炎症小体的活化的影响,明确Kv1.3钾离子通道在炎症小体激活中的作用.也可以进一步探究Kv1.3和P2X7R之间的关系,两者是否共同调节细胞内钾离子的浓度进而调控炎症小体的激活.
RT-qPCR结果显示Kv1.3抑制剂处理会下调NLRP3、IL-1β、ASC的转录水平.NLRP3炎症小体的活化分为两个步骤,第一信号是指炎性刺激LPS与细胞表面的TLR4结合,经由NF-κB信号通路上调细胞内NLRP3、IL-1β和IL-18 mRNA水平;第二信号是指细胞内NLRP3炎症小体复合物组装成一个大的低聚物,导致caspase-1的自剪切激活,切割pro-IL-1β和IL-18,释放炎性因子[16].阻断Kv1.3通路可能是通过抑制炎症小体活化的第一信号通路,即LPS与TLR4受体结合,经由MyD88抑制下游NF-κB信号通路调控炎症小体相关因子的转录水平.
Kv1.3抑制剂是否对第二信号有抑制作用仍需进一步探讨.动态监测实验发现,NLRP3炎症复合物的组装是一个动态的过程,首先需要NLRP3发生泛素化和寡聚化,再通过PYD和CARD结构域招募ASC和pro-caspase1,各组分沿着微管运动到正确位点处组装成一个大的复合物是炎症小体激活的必要条件.有研究发现一定范围内的广谱钾离子通道抑制剂4-AP能够在体外抑制ASC斑点的形成[17].微管蛋白二聚体上有钙离子的结合位点,主要通过环境中钙离子的浓度变化来调节微管蛋白的聚合和解聚.Kv1.3通道引起的细胞膜电位的变化可促进持续的钙信号,钾外流引起阻断钾离子通道Kv1.3介导的细胞内钙离子浓度变化调控NLRP3炎症小体复合物的形成仍需进一步探究[18].

