基于线粒体D-loop区和Cyt b基因序列的四川裂腹鱼养殖群体遗传多样性
刘 伟,曾 圣,王 雪,詹会祥,周 路,熊 畔,向 燕
(1. 贵州省农业科学院水产研究所,贵阳 550025;2.毕节市水产技术推广站,贵州 毕节 551700;3. 毕节市鑫有农业综合开发有限责任公司,贵州 毕节 551700)
【研究意义】四川裂腹鱼(Schizothoraxkozlovi)隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)裂腹鱼亚科(Schizothoracinae),主要分布在长江上游金沙江、雅砻江、乌江上游和北盘江[1],为长江上游特有鱼类,亦是高原鱼类区系重要种类,具有较高的科研价值。四川裂腹鱼肉质细嫩,不饱和脂肪酸丰富[2],食用价值较高。近年来,受人为因素的影响,四川裂腹鱼野生群体数量及分布区域急剧减少,捕获的个体偏小型化和低龄化[3-4],被《中国脊椎动物红色名录》列为易危种(Vulnerable,VU)[5]。2011年毕节市水产技术推广站率先突破四川裂腹鱼的人工繁殖及鱼苗培育技术[2],随后向贵州部分适养地区扩散,目前该土著鱼类已列入贵州省生态渔业中冷水鱼养殖新品种,养殖效益高、前景广阔。鱼类群体的适应能力、生存、进化能力与其群体遗传多样性紧密相关[6],近年来,鱼类养殖群体遗传多样性降低引起种质退化而导致的养殖问题层出不穷,如鱼苗成活率降低、鱼体病害增多等,严重影响养殖效益。因此,研究四川裂腹鱼养殖群体的遗传多样性,制定人工选育策略,对其产业健康发展具有重要意义。【前人研究进展】线粒体DNA具有分子量小、结构简单和变异速度快等特点,是群体遗传研究的理想分子标记[7],其中D-loop区为非编码区受自然选择压力小,变异速率较大,Cytb基因编码蛋白质较为保守,目前这两种基因标记在裂腹鱼亚科鱼类野生群体遗传学研究中已有广泛应用。基于D-loop区研究方面,代应贵等[8]研究表明,乌江上游六冲河河段四川裂腹鱼群体的遗传多样性匮乏;陈永祥[3]的分析显示,乌江上游总稽河段等4个四川裂腹鱼地理群体间的遗传分化较高;海萨·艾也力汗等[9]的结果表明,塔里木河群体遗传多样性较为丰富,而车尔臣河群体遗传多样性偏低,并建议将2个群体分开管理。基于Cytb基因研究方面,俞丹等[10]认为,雅鲁藏布江下游墨脱江段及察隅河的墨脱裂腹鱼群体间缺少基因交流,遗传分化度较高;张争世等[11]研究认为,长江上游齐口裂腹鱼群体的遗传多样性处于中等水平;娄晋铭等[12]分析了甘肃省 3 种裂腹鱼类遗传多样性结果显示,3种裂腹鱼类同一种的不同地理群体间遗传分化明显。【本研究切入点】四川裂腹鱼是贵州省生态渔业的新兴土著鱼类养殖品种,开展其养殖群体遗传多样性研究十分必要,但至今未见四川裂腹鱼养殖群体遗传研究的相关报道。【拟解决的关键问题】通过对贵州毕节地区四川裂腹鱼养殖群体D-loop区和Cytb基因的测定和分析,研究其群体遗传多样性,旨在了解该地区四川裂腹鱼养殖群体的种质状况,为其选育和遗传改良工作提供理论依据。
1 材料与方法
1.1 材料
2020年3月,于贵州省大方县光富生态农业发展有限公司流水养殖池随机挑选35尾无畸形的体重约0.1~1.0 kg的四川裂腹鱼活鱼,剪取部分尾鳍置于无水乙醇中用于提取基因组DNA。
1.2 方法
1.2.1 DNA提取 采用北京擎科新业生物科技有限公司提供的“通用型硅胶膜法动物基因组提取试剂盒”进行基因组DNA提取,操作方法参照说明书。用1%琼脂糖凝胶电泳检测DNA提取质量。
1.2.2 PCR扩增 Cytb基因PCR扩增的引物为通用引物L14724、H15915[13],D-loop区引物参照文献[8]。PCR扩增总体系30 μL,包含上、下游引物(10 μmol/L)各1 μL、基因组DNA 1 μL、PCR Master Mix 15 μL、ddH2O 12 μL。PCR扩增程序:98 ℃预变性3 min;98 ℃变性10 s,55 ℃(Cytb基因)/60 ℃(D-loop区)退火15 s,72 ℃延伸15 s,39个循环;最后72 ℃延伸5 min。采用1%琼脂糖凝胶电泳验证PCR效果。
1.2.3 序列测定与分析 委托北京擎科新业生物技术有限公司进行双向测序(测序引物与扩增引物一致)并拼接,序列用Clustalx 1.83软件进行比对,剪去两端测序信号不稳定的碱基。通过DNASP 6.0软件统计四川裂腹鱼养殖群体遗传多样性参数,对群体进行Tajima’s D中性检验,对D-loop区和Cytb基因序列进行核苷酸错配分布(Mismatch distribution)分析。用MEGA 5.0软件计算碱基组成、Kimura-2-parameter模型的遗传距离,分别构建两种序列单倍型邻接(Neighbor Joining,NJ)系统树(1000次抽样bootstrap检验);采用PMAL 4.3 软件中的Codeml程序检测四川裂腹鱼养殖群体Cytb基因受选择压力的情况。
2 结果与分析
2.1 D-loop区和Cyt b序列片段特征与变异
从表1可知,35尾四川裂腹鱼个体最终获得469 bp的D-loop区序列和1076 bp的Cytb基因序列, 2种基因序列碱基A+T平均含量均高于G+C,符合硬骨鱼类线粒体基因的碱基组成;Cytb基因密码子第一位上4种碱基使用频率差异不大,密码子第二位上表现出明显的T(42.0%偏倚)和反G(13.1%)偏倚,密码子第三位C、A使用频率明显高于T、G。
D-loop区和Cytb基因序列分别检测到9个和34个核苷酸多态位点,及7和8种单倍型(表2~3)。D-loop区未发现插入或缺失位点,9个多态位点均为转换位点(A-G转换7个,C-T转换2个); Cytb基因序列的34个多态位点中,转换位点有31个,其中A-G转换18个,C-T转换13个,颠换位点3个,平均转颠换比为10.33,2种序列的多态位点中转换明显大于颠换,说明2种序列的转换和颠换均未达饱和状态。此外,Cytb基因密码子第一、二、三位点上出现的变异位点数分别为3、3、28个,分别占总研究序列的2.6%、0.28%、0.28%,第三位点变异率明显高于第一、二位点(表1)。
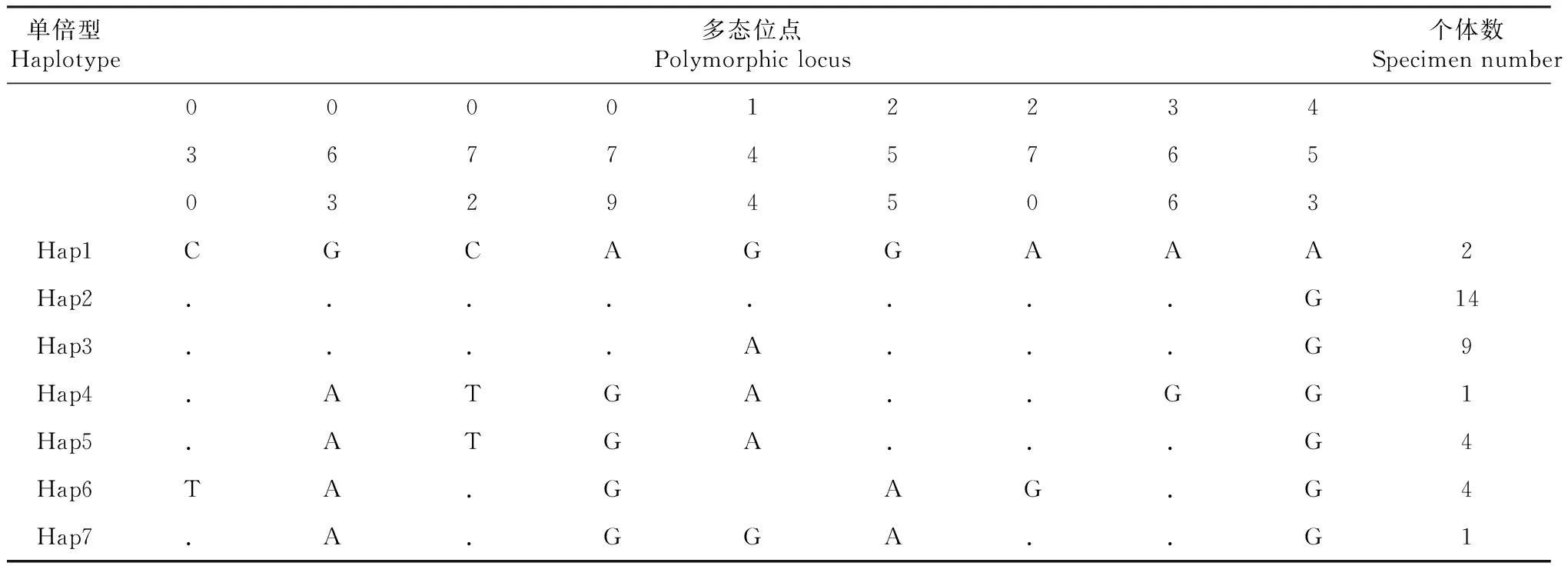
表2 四川裂腹鱼不同单倍型D-loop区序列多态位点分布
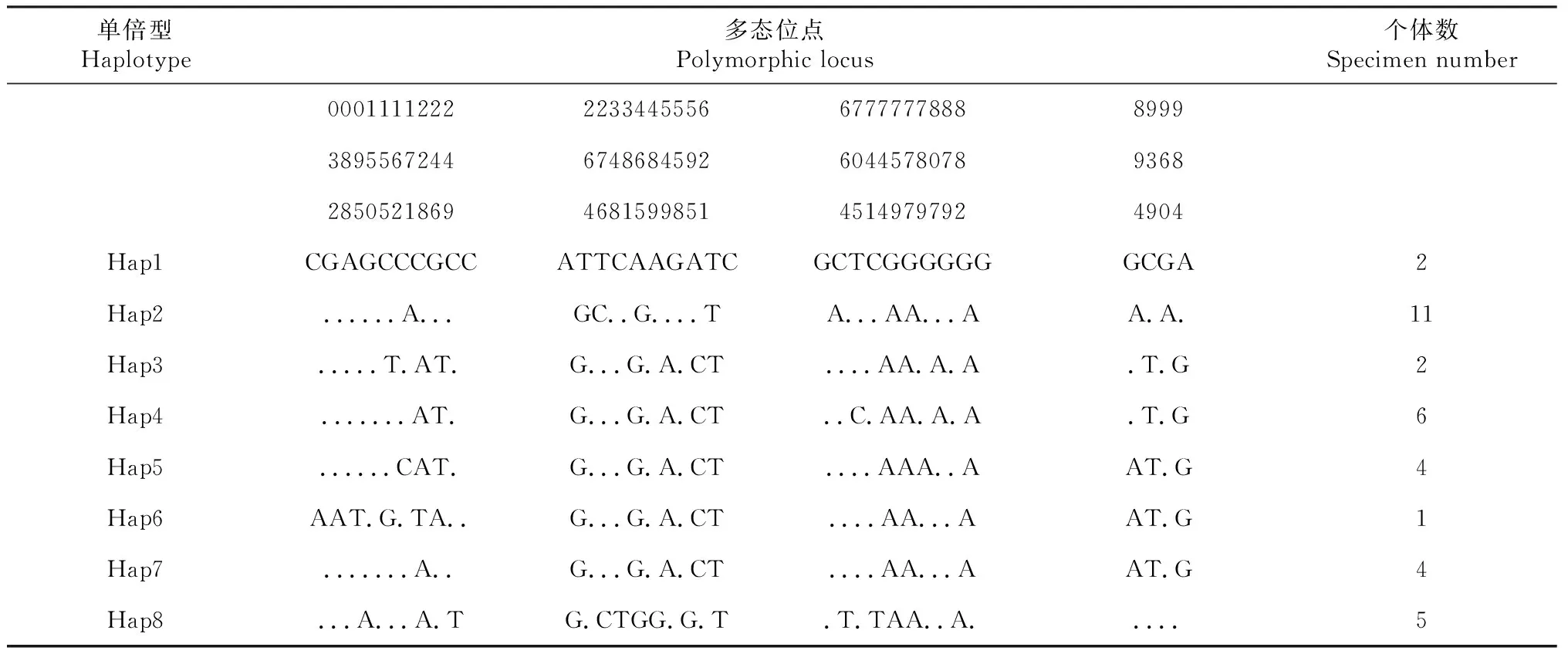
表3 四川裂腹鱼不同单倍型Cyt b基因序列多态位点分布
2.2 群体遗传多样性
DnaSP 6.0分析结果显示,基于D-loop区和Cytb基因序列四川裂腹鱼养殖群体的单倍型多样度(Hd)、核苷酸多样性(π)、平均核苷酸差异数(K)分别为0.765和0.842、0.00 519和0.00 826、2.434和8.881,可见,基于D-loop区序列的各项遗传多样性指标均明显低于Cytb基因序列。
2.3 群体遗传分化
四川裂腹鱼养殖群体D-loop区序列7种单倍型间的遗传距离为0.0021~0.0131,平均遗传距离为0.0083;Cytb基因序列8种单倍型间的遗传距离为0.0019~0.0189,平均遗传距离为0.01。说明基于Cytb基因序列单倍型间的遗传分化程度较D-loop区序列单倍型间的高。
从图1可知,构建的2种序列单倍型NJ系统树存在多歧分支。D-loop区序列单倍型Hap5和Hap4聚为一支,代表5个个体。Hap6 和Hap7聚为一支,代表5个个体;Hap1和 Hap2先聚为一支再和 Hap3聚为一支,代表24个个体,为优势分支。Cytb基因序列单倍型Hap3、 Hap4、Hap5、 Hap6、Hap7聚为一支, Hap1和Hap8聚为一支,Hap2单独为一支,3个分支分别代表15、7和12个个体,无明显的优势分支。
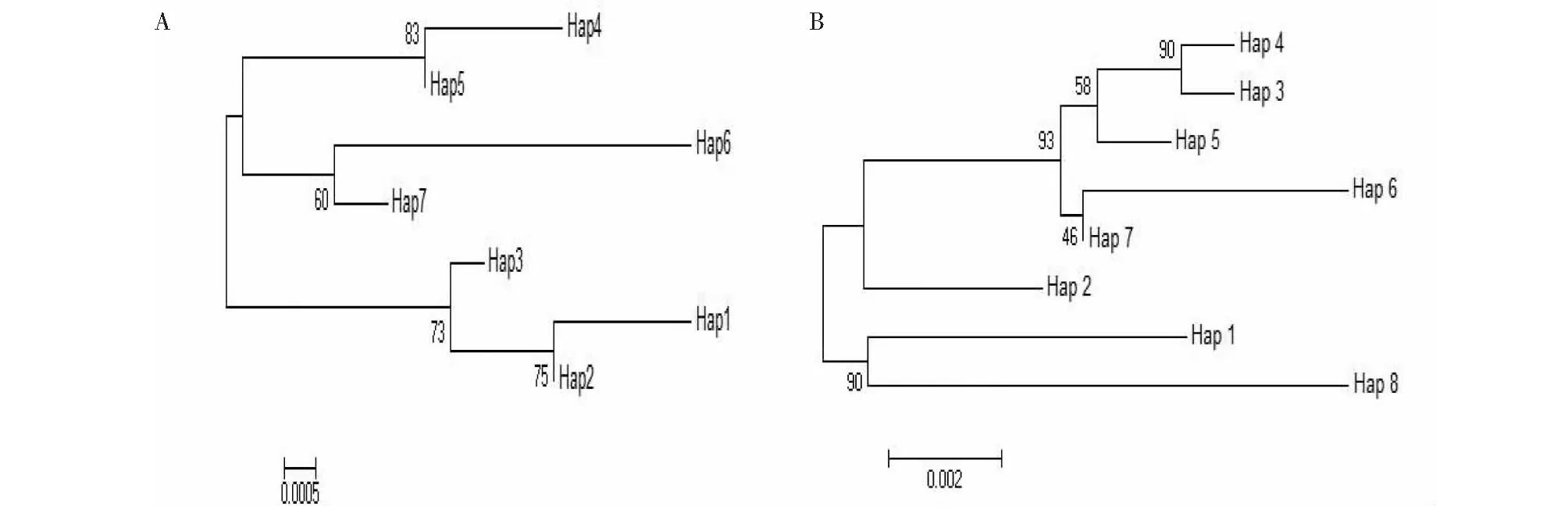
图1 基于D-loop区(A)和Cyt b(B)序列单倍型间遗传距离的四川裂腹鱼养殖群体NJ系统树Fig.1 NJ tree of the farmed S. kozlovi based on genetic distances for haplotypes of D-loop region and Cyt b genes
中性检测分析结果显示,基于D-loop区和Cytb基因序列的四川裂腹鱼养殖群体Tajima’s D正值,分别为0.34 119(P>0.05)和0.26 868(P>0.05);对2种基因序列进行核苷酸错配分布分析,结果均呈多峰分布(图2),表明四川裂腹鱼养殖群体历史上未经历群体扩张事件,群体大小趋于稳定[14]。

图2 四川裂腹鱼养殖群体核苷酸错配分布曲线Fig.2 The nucleotide mismatch distribution curve of the farmed S. kozlovi
2.4 四川裂腹鱼养殖群体选择压力
为了解四川裂腹鱼养殖群体受选择压力的情况,本研究分析了Cytb基因受选择压力影响的情况,结果显示,Cytb基因序列变异中非同义突变(dN)与同义突变(dS)的比值dN/dS 为0.1 724(P>0.05),表明Cytb基因序列中的碱基突变存在非同义突变,突变导致了氨基酸的变异。通常认为dN/dS> 1时,基因受正向选择的影响,而dN/dS < 1时,基因受纯化或负向选择的影响[15],因此,四川裂腹鱼养殖群体的Cytb基因可能受到负向选择。
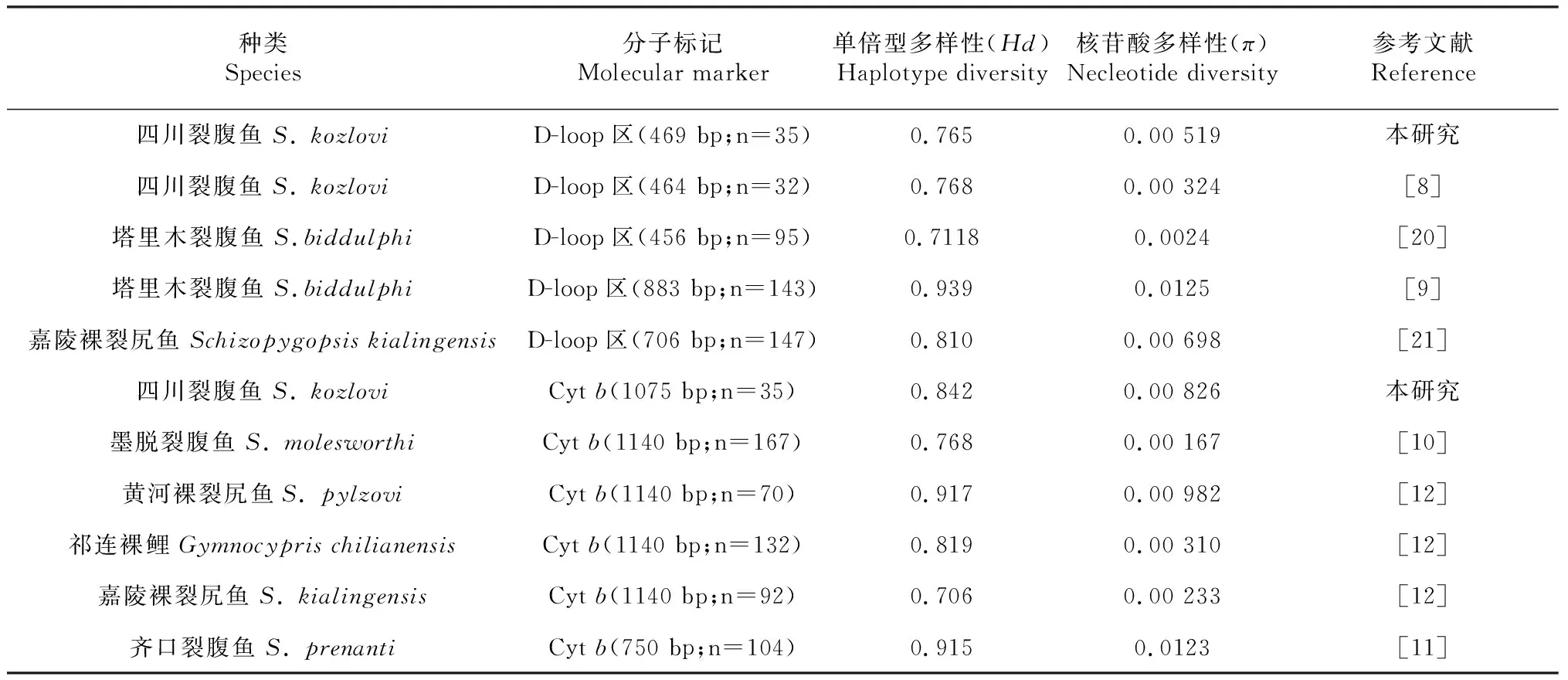
表4 裂腹鱼亚科部分鱼类遗传多样性比较结果
3 讨 论
对毕节地区四川裂腹鱼养殖群体D-loop区和Cytb基因序列片段分析表明,A+T含量均明显高于G+C含量,这与塔里木裂腹鱼[9]、墨脱裂腹鱼[10]、齐口裂腹鱼[11]等的研究结果相似。同时,Cytb基因密码子第二位上表现出明显的T(42.0%)偏倚和反G(13.1%)偏倚、密码子第三位C、A使用频率明显高于T、G等特征与鲇、斑鳠[15]的研究结果相似,这种密码子上的碱基偏倚性被认为是鱼类Cytb基因的一个典型特征[16]。四川裂腹鱼养殖群体D-loop区序列变异率(1.9%)较Cytb基因序列(3.16%)的低,这与鱼类线粒体D-loop区变异速率高于Cytb基因的一般规律不符合。有研究表明,鲤科鱼类D-loop区不同区域变异程度不同,变异一般主要集中在D-loop区的两侧,中间区域相对保守[17],通过与NCBI下载的四川裂腹鱼D-loop全序列(937 bp,登录号为KU868078.1)对比,本研究序列(469 bp)位于全序列的中间区域(230 ~730 nt),因而所获序列变异程度较低;所获Cytb基因序列(1075 bp)基本为全序列(1140 bp),且变异程度较D-loop区更高,因此,Cytb基因更适合作为本研究的分子标记。此外,Cytb基因的变异多位于密码子第3位点上,其变异率(2.6%)显著高于第一、二位(0.28%、0.28%),原因是密码子第三位点受自然选择压力较小导致变异更快[18]。
遗传多样性是物种生存和进化的基础,遗传多样性越丰富,其生存和竞争能力就越强。单倍型多样度(Hd)和核苷酸多样性(π)是衡量物种遗传多样性的2个重要指标,Hd和π值越高,其遗传多样性越丰富[19]。本研究四川裂腹鱼养殖群体D-loop区和Cytb基因序列的Hd、π分别为0.765、0.00 519和 0.842、0.00 826,与裂腹鱼亚科部分种类群体的遗传多样性对比发现,基于D-loop区序列的四川裂腹鱼养殖群体Hd和π较乌江群体四川裂腹鱼[8]和多浪渠首等5个群体塔里木裂腹鱼[20]的高,而较库玛拉克河等7个群体塔里木裂腹鱼[9]和6个野生群体嘉陵裸裂尻鱼(Schizopygopsiskialingensis)[21]低;基于Cytb基因序列的四川裂腹鱼养殖群体Hd和π较黄河裸裂尻鱼(S.pylzovi)和嘉陵裸裂尻鱼[12]、墨脱裂腹鱼[10]的高,而较祁连裸鲤(Gymnocyprischilianensis)[12]和齐口裂腹鱼[11]的低。因此,本研究四川裂腹鱼养殖群体的遗传多样性在裂腹鱼亚科鱼类种类群体中处于中等水平。根据Grant 等[22]提出的Hd和π的4种模式,本研究四川裂腹鱼养殖群体D-loop区和Cytb基因序列的Hd和π的结果均符合第4种模式,即较高Hd(Hd>0.5)和较高π(π≥0.5%),说明该群体可能是由一个大而稳定的群体经历较长的历史演化或是2个较大种群发生第2次接触形成;2种基因序列的核苷酸错配分布显示多峰分布,且Tajima’s D中性检测不显著(P>0.05),说明该群体近期历史上未发生种群扩张事件,群体大小稳定。
NJ系统树存在多歧分布,35个四川裂腹鱼个体散布在系统树的各分支间,且各分支的置信值较高,推测这35个个体可能来源于3个母系。乌江上游干流—六冲河地形地貌复杂,河谷深切,水流湍急,山地形成的急流长峡非常适合裂腹鱼类的生存,加之近年来乌江梯级水电的开发[4],生活在六冲河的鱼类极易产生地理隔离,毕节地区四川裂腹鱼养殖亲鱼捕自六冲河[23],后又陆续从河流中补充了野生个体[4],因此,从六冲河捕获的四川裂腹鱼亲本可能来自不同的母系群体,遗传分化较大,这可能也是其人工繁育后代提供了遗传多样性丰富的原因。综上,毕节地区四川裂腹鱼养殖群体的遗传多样性较为丰富。
从进化角度看,养殖群体的遗传变异往往是其生存环境和人工选择协同作用的结果。在鱼类的人工养殖和繁育过程中,包含着有意或无意的人工选择,基因所受的选择压力往往使部分位点发生遗传变异[24],而在生存环境相对稳定的情况下,基因更多偏向负向选择[25]。毕节地区四川裂腹鱼养殖群体的Cytb基因可能受到负向选择(dN/dS≈0.17<1),暗示人工选择压力对当前四川裂腹鱼养殖群体Cytb基因的影响有限,这与河南鳙养殖群体线粒体COI基因选择压力分析的研究结果相似[26],下一步的研究需要选择更多的基因去检验毕节地区四川裂腹鱼养殖群体的选择压力。虽然毕节地区四川裂腹鱼养殖群体的遗传多样性较高,但长期的负向选择容易导致群体遗传衰退,因此,应加强不同世代四川裂腹鱼养殖群体遗传多样性监测,在补充亲本的同时先了解其遗传背景,注意加强引种数量和范围;另外,为了提高四川裂腹鱼的养殖效益,应采取家系选育等高效的选育手段,选育出生长更快、性状优良、适应性强、宜推广的优良品系。
4 结 论
Cytb更适合作为毕节地区四川裂腹鱼遗传多样分析的分子标记。毕节地区四川裂腹鱼群体近期历史上可能未经历群体扩张事件,而是由一个大而稳定的群体经历较长的历史演化,具有较为丰富的遗传多样性;群体选择压力可能受到负向选择的影响,当前的人工选择对Cytb基因的影响有限。

