慢性乙肝患者肝纤维化严重程度与血清TGF-β 的相关性分析
郭金伟
中国科学院大学深圳医院(光明)感染性疾病科,广东深圳 518106
慢性乙型肝炎是我国较为常见的一种传染性疾病,是由于感染乙肝病毒(hepatitis B virus, HBV)所致[1]。慢性乙肝患者普遍存在肝纤维化,肝纤维化晚期表现为肝区疼痛、脾大、蜘蛛痣等症状,但早期临床症状缺乏特异性,诊断难度较大[2]。肝纤维化是慢性乙肝患者病情进展为肝硬化的一个重要阶段,肝纤维化分期也是评估患者疾病严重程度的参考标准[3]。临床有研究表明:转化生长因子-β(transforming grouth factor-β, TGF-β)在瘢痕形成、器官纤维化发展中发挥着重要作用,高水平的TGF-β 会促进纤维化进程进展[4-5]。基于此,为探究慢性乙肝患者肝纤维化严重程度与血清TGF-β的相关性,本文对中国科学院大学深圳医院(光明)感染性疾病科2019 年5 月—2022 年1 月收治的296例慢性乙肝患者研究,现报道如下。
1 资料与方法
1.1 一般资料
将本院感染性疾病科收治的296 例慢性乙肝患者作为观察组,以及同期本院门诊体检的296 名健康人员作为对比组。观察组:172 例男、124 例女;年龄34~74 岁,平均(53.72±3.09)岁;病程2~5 年,平均(3.46±1.68)年;肝纤维化分期:21 例S0期、131 例S1-2期、144 例S3-4期;疾病严重程度:30 例轻度、157例中度、109 例重度;体质指数(body mass index, BMI)23~33 kg/m2,平 均(28.62±1.44)kg/m2。对 比组:190 例男、106 例女;年龄35~74 岁,平均(53.55±3.01)岁;BMI 24~33 kg/m2,平均(28.58±1.41)kg/m2。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。研究经医院伦理委员会审批。
1.2 纳入与排除标准
纳入标准:①均满足《慢性乙型肝炎防治指南》[6]中对“慢性乙肝”诊断标准;②年龄在18 周岁以上,男、女均可;③影像学资料完整;④均为自愿参与本研究,并已签署知情同意书。
排除标准:①入组前1 月接受过抗病毒等对症治疗者;②妊娠期、哺乳期女性;③既往存在肝区手术史者;④合并艾滋病等疾病者;⑤合并腹水等疾病者;⑥同期参与其他研究者;⑦凝血机制异常者;⑧中途转院、死亡、退出者;⑨合并肝癌等恶性肿瘤者。
1.3 方法
①血清TGF-β 检测:抽取所有受检者5 mL 空腹静脉血,以10 cm 离心半径、2 800 r/min 离心速率、离心处理10 min,将上层清液分离,并置于-70℃环境待检,以ELISA 法检测转化生长因子-β(transforming grouth factor-β, TGF-β)。
②肝纤维化分期病理检测:以B 超引导下活检枪穿刺法进行穿刺,协助患者采取左侧卧位,通过B 超定位穿刺点,对穿刺部位进行常规消毒、铺巾,给予2%的利多卡因麻醉,在B 超引导下活检枪沿着穿刺点进针,取出肝组织长约1.5 cm,迅速置入10%的福尔马林溶液中保存并及时送检,进行常规HE、网织、Masson 染色,由本院两名病理科资深医生独立阅片,给出具体的病理诊断结果,对于存在异议的地方,应再从讨论,确定最终诊断结果。严格遵循《肝纤维化中西医结合诊疗指南(2019 年版)》[7]中对肝纤维化分期的判定标准。
③肝纤维化相关标志物测定:抽取所有受检者5 mL 空腹静脉血,分离血清并置于-37℃水浴箱温浴30 min,以2 800 r/min 离心速率、10 cm 离心半径、离心处理10 min,分离血清,以放射免疫分析(radioimmunoassay, RIA)法检测Ⅳ型胶原(collagen type Ⅳ, C-Ⅳ)、层黏蛋白(laminin, LN)、Ⅲ型前胶原(procollagen Ⅲ, PC-Ⅲ)、透明质酸(Hyaluronic acid, HA)。
1.4 统计方法
采用SPSS 22.0 统计学软件处理数据,计量资料符合正态分布,以(±s)表示,组间差异比较采用t检验,多组间差异比较采用F检验,Prarson 相关性分析肝纤维化指标与血清TGF-β 的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清TGF-β、肝纤维化实验室参数比较
观察组血清TGF-β、C-Ⅳ、LN、PC-Ⅲ、HA 均高于对比组,差异有统计学意义(P<0.05),见表1。
表1 两组患者血清TGF-β、肝纤维化实验室参数比较(±s)

表1 两组患者血清TGF-β、肝纤维化实验室参数比较(±s)
组别观察组(n=296)对比组(n=296)t 值P 值TGF-β(pg/mL)816.25±64.15 316.25±20.04 127.997<0.001 C-Ⅳ(ng/mL)168.26±19.62 20.16±1.44 129.520<0.001 LN(ng/mL)216.52±34.05 37.26±2.41 90.350<0.001 PC-Ⅲ(ng/mL)319.06±29.04 21.52±1.44 176.060<0.001 HA(ng/mL)592.62±34.05 40.26±1.57 278.798<0.001
2.2 轻、中、重度组血清TGF-β、肝纤维化实验室参数对比
重度组均血清TGF-β、C-Ⅳ、LN、PC-Ⅲ、HA 均显著比中度组高,中度组均显著比轻度组高,差异有统计学意义(P<0.05),见表2。
表2 轻、中、重度组血清TGF-β、肝纤维化实验室参数对比(±s)
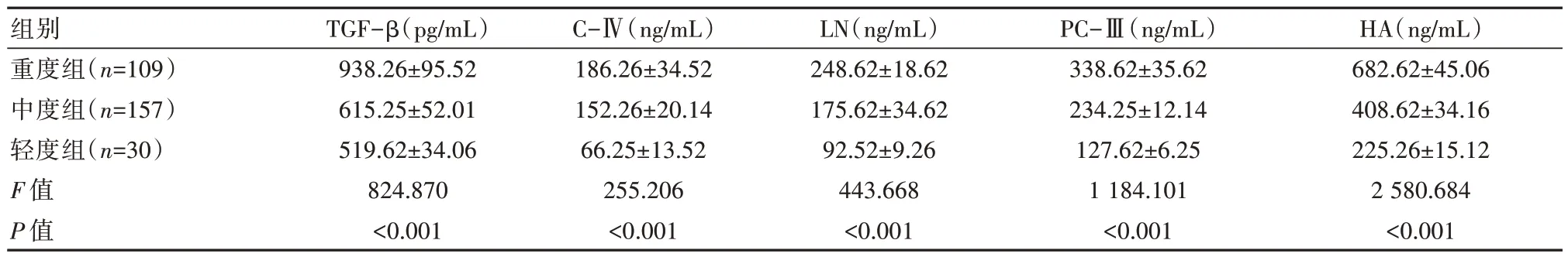
表2 轻、中、重度组血清TGF-β、肝纤维化实验室参数对比(±s)
组别重度组(n=109)中度组(n=157)轻度组(n=30)F 值P 值TGF-β(pg/mL)938.26±95.52 615.25±52.01 519.62±34.06 824.870<0.001 C-Ⅳ(ng/mL)186.26±34.52 152.26±20.14 66.25±13.52 255.206<0.001 LN(ng/mL)248.62±18.62 175.62±34.62 92.52±9.26 443.668<0.001 PC-Ⅲ(ng/mL)338.62±35.62 234.25±12.14 127.62±6.25 1 184.101<0.001 HA(ng/mL)682.62±45.06 408.62±34.16 225.26±15.12 2 580.684<0.001
2.3 不同S 分期组血清TGF-β、肝纤维化实验室参数对比
血清TGF-β、C-Ⅳ、LN、PC-Ⅲ、HAS3-4期组均高于S1-2期,S1-2期均显著比S0期组高,差异有统计学意义(P<0.05),见表3。
表3 不同S 分期组血清TGF-β、肝纤维化实验室参数对比(±s)

表3 不同S 分期组血清TGF-β、肝纤维化实验室参数对比(±s)
组别S0期组(n=21)S1-2期组(n=131)S3-4期组(n=144)F 值P 值TGF-β(pg/mL)451.26±12.62 692.62±15.11 838.62±20.14 5 534.365<0.001 C-Ⅳ(ng/mL)82.62±5.62 128.62±9.62 160.33±6.74 1 112.149<0.001 LN(ng/mL)134.25±13.06 182.62±19.05 258.26±34.01 368.620<0.001 PC-Ⅲ(ng/mL)132.52±20.62 178.62±34.51 255.62±34.52 242.500<0.001 HA(ng/mL)62.15±1.52 352.62±19.62 401.52±20.14 2 864.017<0.001
2.4 肝纤维化实验室参数、血清TGF-β 的相关性
C-Ⅳ、LN、PC-Ⅲ、HA 与TGF-β 均呈正相关(P<0.05),见表4。

表4 肝纤维化实验室参数与血清TGF-β 的相关性
3 讨论
肝纤维化是慢性乙肝患者组织修复产生的一种代偿反应,也是慢性乙肝发展成为肝硬化、肝癌的必经阶段,是由于细胞外基质降解减少、合成增加,导致大量的ECM 沉积,从而引发肝纤维化。据调查显示:将近40%的肝纤维化患者会发展成为肝癌[8]。肝纤维化是一个多细胞、多因素参与的生理过程,与多种细胞因子异常变化有着极为密切的联系[9]。TGF-β 可以将肝星状细胞激活,在肝硬化无创性诊断中具有重要价值,而关于TGF-β 异常变化在促肝纤维化发展中的作用机制成为目前临床关注的热点。
本研究显示,观察组血清TGF-β、C-Ⅳ、LN、PC-Ⅲ、HA 均高于对比组(P<0.05)。提示慢性乙肝患者相对于健康人群,血清TGF-β 水平显著增高。分析如下:HBV 会通过免疫病理性损伤间接或直接的激活、浸润大量的Kupffer 细胞,导致机体释放更多TGF-β,从而增加血液循环系统中TGF-β 浓度,而高水平的TGF-β 又会对贮脂细胞等其他间质细胞形成刺激,刺激以上细胞释放TGF-β,形成一个恶性循环[10-11]。TGF-β 又会对HSG 形成一定的刺激,促使其转化成肌成纤维细胞,加快ECM 合成,上调不同类型胶原浓度以及LN、HA 表达[12-13]。在李虓等[14]研究中,HBV携带者组血清TGF-β(357.07±41.17)μg/L、慢性乙肝组(327.59±25.04)μg/L 均高于健康对照组(24.06±5.29)μg/L,(P<0.05),与本研究重度组组TGF-β(938.26±95.52)pg/mL 高于中度组,而中度组TGF-β(615.25±52.01)pg/mL 高于轻度组(P<0.05)的结果接近,证实了HBV 感染会导致血清TGF-β 浓度增高。
肝穿刺活检是临床诊断慢性乙肝的金标准,但存在创伤性大、价格昂贵、并发症多等不足,并未在临床中推广开来[15]。而C-Ⅳ、LN、PC-Ⅲ、HA现已在《肝纤维化诊断及治疗共识》[16]中被定为评估肝纤维化程度的重要实验室指标。以“胶原”为主的ECM,降解量减少,合成量增多,是肝纤维化发展的本质,降解与合成之间的平衡性被打破,导致肝脏内部大量的细胞外基质沉积,最终形成肝纤维化[17]。C-Ⅳ是基底膜的重要成分,可以反映出基底膜胶原的更新率,血清C-Ⅳ增高,可反映出肝纤维化进程,也是肝纤维化的早期标志之一。肝纤维化发展早期,血清C-Ⅳ浓度就会增高。LN主要来源于肝星状细胞,在细胞分化、粘连、基因表达中具有重要作用。肝纤维化发展过程中,肝窦内皮细胞间隙会沉积大量的LN,降低内皮细胞的通透性,升高门静脉压。PC-Ⅲ与肝纤维化程度存在密切相关性,但PC-Ⅲ缺乏特异性,如果其他器官发生纤维化,血清PC-Ⅲ浓度也会增高,然而持续性的血清PC-Ⅲ浓度增高,提示病情向肝纤维化方向发展。HA 由间质细胞合成,可以更加灵敏的反映出肝脏细胞受损程度,是肝纤维化诊断的敏感性指标。
本研究显示,重度组血清TGF-β、C-Ⅳ、LN、PC-Ⅲ、HA 均高于中度组,中度组均高于轻度组,S3-4期组均高于S1-2期,S1-2期均高于S0期组(P<0.05)。说明肝纤维化程度越重,以上指标血清浓度就越高。分析如下:慢性乙肝患者在感染HBV 之后,会触发机体释放大量的TGF-β,加快肌纤维母细胞转换成纤维细胞、纤维样细胞的速度,促使患者病情从肝纤维化向肝硬化方向发展[18-19]。TGF-β 作为一种促纤维化因子,会促使大量的肌纤维母细胞,合成大量的胶原,加重肝纤维化程度。另外,TGF-β 通过基因水平,抑制基质金属蛋白酶等降解酶的活性,增加内源性抑制剂含量,促使大量的细胞外基质不能被降解,从而发生肝纤维化。在朱萍等[20]研究中,S4组C-Ⅳ(217.8±140.1)ng/L 高于S3(175.0±175.5)ng/L,S3高于S2(99.6±70.5)ng/L,S2高 于S1(49.6±34.2)ng/L(P<0.05),与本研究结果接近。本研究显示,C-Ⅳ、LN、PC-Ⅲ、HA 与TGF-β 均呈正相关(P<0.05)。提示血清TGF-β 浓度会随着肝纤维化程度的加重而增高,临床可通过检测血清TGF-β 浓度,评估肝纤维化程度,从而对患者病情作出准确的诊断,辅助临床医生为患者制定针对性的治疗计划。
综上所述,慢性乙肝患者机体血清TGF-β 浓度较高,且随着肝纤维化程度加重,血清TGF-β 浓度会逐渐增高,临床可将TGF-β 作为评估肝纤维化进程的一个特异性指标。

