基于发病机制分析2 型糖尿病周围神经病变的关键基因及重要通路
陈晓毓,马匠心,张海滨,陈旎瑶,刘清权
1.福建医科大学附属第二医院内分泌科,福建泉州 362000;2.福建医科大学附属第二医院心血管内科,福建泉州 362000
据国际糖尿病联合会估计,2021 年全球成年糖尿病患者数为5.37 亿[1]。我国糖尿病患病率居全球首位[2],患病率为12.4%[3],糖尿病前期患病率达 35.7%[4]。糖尿病可发生多种并发症,糖尿病周围神经病病变(diabetic peripheral neuropathy,DPN)为常见并发症,但DPN 的发病机制复杂。到目前为止,具体机制尚不清楚。随着二代测序技术发展,DPN相关基因调控受到关注。研究表明Toll 样受体4(toll-like receptor 4,TLR4)是2 型糖尿病神经病变(type 2 diabetic peripheral neuropathy,T2DPN)的候选保护基因,与患病率密切相关[5]。但对DPN 缺乏系统性调控机制的研究,通过生物信息学分析探索疾病机制是有效手段。本研究从GEO 数据库下载了包含正常人、DPN 患者外周血的基因芯片,利用生物信息学技术,分析得到两者相关的差异表达基因,筛选出关键核心基因,并对2021 年6—12 月福建医科大学附属第二医院内分泌科住院的T2DPN患者20 例和体检中心健康人18 名的外周血淋巴细胞的表达进行验证,为DPN 发生机制以及治疗提供新的思路。现报道如下。
1 材料与方法
1.1 数据来源
从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)下载GSE95849 数据集,该芯片数据包括6 例2型DPN 患者和6 名正常人。
1.2 DEG 识别和功能富集
用R 语言对表达数据进行标准化处理,再用limma 包分析正常样本和DPN 样本的差异表达基因,差异表达基因(differentially expressed genes,DEGs)的筛选标准是:|logFC|≥2 及P<0.05。
对获得的差异基因,利用DAVID 数据库进行GO 和KEGG 功能富集分析,富集通路定义为P<0.05。
1.3 核心基因筛选
利用STRING 在线数据库(http://www.string-db.org/)预测DEG 对应蛋白的互作关系,构建蛋白质互作网络(设置combined score>0.4)。STRING 分析结果用Cytoscape 3.8.0.软件进行可视化,并使用Cytohubba 对PPI 网络再次分析核心基因的筛选,具体为:通过Cytohubb 确定Betweenness、Degree、Closeness、EPC、MCC 5 种计算法获得top10 的基因,并取这些基因的交集获得关键基因。
1.4 一般资料
选取本院内分泌科住院的T2DPN 患者18 例和体检中心健康人名20 名,分为疾病组和对照组。其中疾病组即DPN 组,男13 例,女5 例;平均年龄(57.9±8.3)岁。对照组即健康组,男16 名,女4 名;平均年龄(47.7±9.8)岁。所有患者均签署了研究知情同意书,且研究通过医院医学伦理委员会的批准。
1.5 纳入与排除标准
纳入标准:知情同意;明确诊断T2DPN;能够积极配合调查与试验。
排除标准:合并其他严重糖尿病并发症者;精神疾病者;恶性肿瘤者;1 型糖尿病者;家族遗传疾病者;基因缺陷病者。
1.6 RNA 提 取与qRT-PCR 验证
收集年龄与性别相匹配的DPN 及健康人外周血标本18 例和20 名。所有参与者均签署了知情同意书后采集血样,再遵循protocal 试剂制造商的协议加入人外周血淋巴细胞分离液后离心,将提取出的PBMC 加入无血清细胞冻存液后存于-80℃冰箱,再提取出人外周血淋巴细胞总RNA,再用TAKARA试剂盒将RNA 逆转录成cDNA 后按照TB Green Premix EX Taq(Tli RNaseH)均匀加样、离心、标记后放入PCR 仪中进行扩增后电泳检测,再以GAPDH 为内参,用2-ΔΔCT 相对定量法分析待测基因的转录水平。所用引物序列,见表1。

表1 qRT-PCR 使用引物序列
1.7 统计方法
采用SPSS 26.0 统计软件进行统计分析,以中位数和四分位距(25%和75%位数)表示,采用秩和检验(双侧)。P<0.05 为差异有统计学意义。
2 结果
2. 1 数据预处理及DEGs 的筛选
预处理结果如下:共包含12 例样本,其中正常外周血样本6 例,2 型糖尿病外周血样本6 例,基于筛选标准 |logFC|≥2 及P<0.05,见图1。
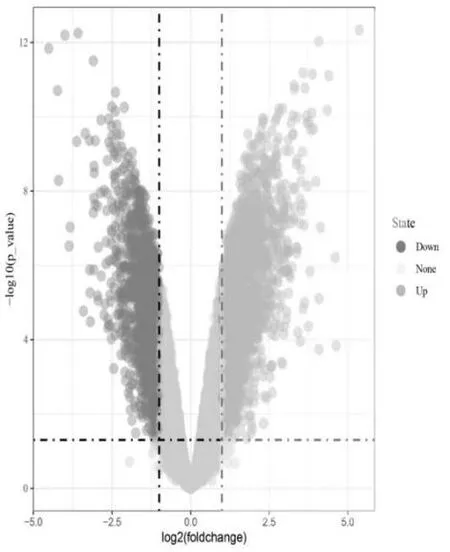
图1 627 个DEGs 基因表达火山图。
2.2 DEGs 的功能富集分析
KEGG 分析结果显示差异表达基因主要和PI3K-Akt 信号通路等过程有关,基因比例与数目均明显高于其他途径。见图2。

图2 KEGG 分析结果显示DEGs 所涉及的信号通路
2.3 DEGs 的PPI 网络构建以及核心基因的确定
基于DEGs 分析结果利用PPI 网络在其中挑选出了TLR4 核心基因,并经qRT-PCR 实验证实TLR4核心基因在周围神经病变后表达升高(P=0.038)。见图3,4。
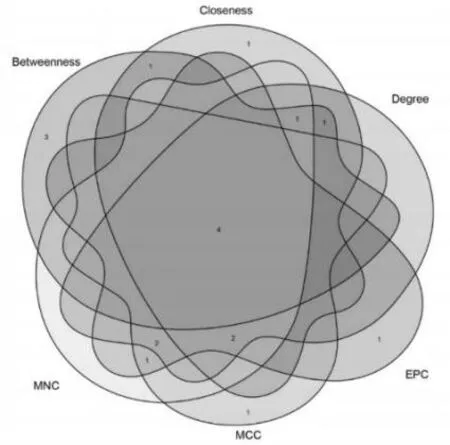
图3 PPI 网络构建图形
韦恩图最终确定了PPI 网络中处于关键位置的4 个核心基因分别是CSF1R、SELL、TLR4、TNF。
2.4 qRT- PCR 验证核心基因(TLR4)
疾病组与正常组各18 和20 个样本,经统计分析发现差异有统计学意义(P=0.038)。结果与前述分析结果相一致。见图5。

图5 TLR4 qRT-pcr 验证结果
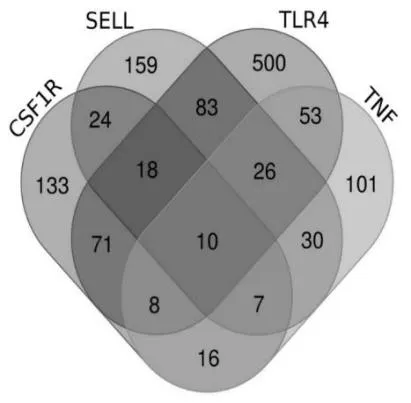
图4 核心基因韦恩图
3 讨论
有研究表明TLR4 是2 型糖尿病和相关神经病变的候选保护基因,与T2DPN 患病率降低密切相关,但都缺乏系统的生物信息学分析。因此,重点运用生物信息学的方法对结果进行分析发现构成核心基因的为TLR 家族成员的TLR4,并进一步通过qRT-PCR 验证核心基因。
本研究发现,与健康组相比,DPN 患者在单核细胞中TLR4 的表达明显升高(P=0.038)。结果表明,TLR4 关键基因对T2DPN 的发病机制有着巨大的意义。TLR4 基因是被广泛研究的TLR 家族的代表,近几年研究表明TLR4 是促进巨噬细胞活化、细胞因子释放和组织损伤的主要受体。这种受体的存在可能表明先天调节的异常调节免疫,它有助于促炎介质的产生和疾病的发展。其具体机制包括:TLR4 触发细胞内信号级联,产生趋化因子,启动和控制关键转录因子,并触发和放大炎症因子反应,介导肠腔内抗原作为脂多糖(lipopolysaccharide,LPS)的识别[6],随后LPS 与TLR4 结合后,诱导TLR4 的下游信号通路可激活其下游髓系分化初级反应蛋白88(MyD88)和核因子-κB(nuclear factor-kappaB,NFκB)[7],并通过MyD88 的募集抑制PI3K-Akt 通路[8],而PI3K/AKT 通路有助于脊髓损伤后的神经功能恢复[9],通过抑制其恢复作用使炎症过程持续下去。也有越来越多的证据表明,TLR4/Myd88/NF-κB 和PI3K-Akt 信号通路之间存在串扰,激活PI3K/AKT信号通路可以抑制TLR4/NF-κB 信号通路[10]。神经毒性可导致神经元损伤和凋亡,并最终引起神经病变,但这种作用可以通过激活PI3K-Akt 信号通路而得到抑制,因此可预测:TLR4 基因与T2DPN 的发病机制密切相关[11]。
近几年来,关于TLR4 基因的研究越来越受到关注,很多研究者进一步研究发现TLR4 基因作为高迁移率组盒-1(high-mobility group box 1,HMGB1)警报蛋白的关键受体形成的HMGB1/TLR4 信号通路轴通过释放的细胞外HMGB1 与TLR4 相互作用,激活炎症通路,刺激体内的炎症反应[12]。此次研究预测HMGB1/TLR4 信号通路与DPN 的发生发展密切相关。
结合前述研究和验证本文可得出结论:HMGB1/TLR4 信号通路与DPN 的发生发展高度相关。但未对此信号通路的完整通路进行研究和验证,可能是尚未发掘新的发病机制,若进一步深入研究可为T2DPN 精准治疗提供新的诊疗方向。

