谷氨酰胺应用于急性重症胰腺炎患者对其机体炎症反应影响的前瞻性研究
黎顺松
高邮市人民医院消化科,江苏高邮 225600
急性胰腺炎为常见疾病,按照病情程度可分为轻症、重症两种,其中急性重症胰腺炎(severe acute pancreatitis, SAP)易引发器官功能障碍,对患者危害性较大,病死率较高[1]。SAP的原因较多,如:梗阻、酒精、血管因素、感染等,患者多伴有恶心呕吐、腹部疼痛等症状。近年来,随着人们生活环境、生活习惯及方式的改变,SAP发病率显著提升,SAP能诱导胰腺释放炎性递质(大量),诱发全身炎症反应综合 征 (systemic inflammatory response syndrome,SIRS),患者基于高分解、高代谢状态下,易造成免疫低下和营养不良,进而诱发多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),威胁患者生命安全[2]。研究显示,因SAP患者体内呈负氮平衡(严重)状态,开展针对性营养支持治疗,有助于提升疗效和改善预后[3]。崔海涛等[4]表示,早期肠内营养,能降低患者感染率。并且有研究表示,SIRS、MODS的重要诱因是免疫功能紊乱,谷氨酰胺是肠道黏膜细胞及免疫细胞的重要来源物质,用于早期营养干预中,有助于患者预后改善[5-6]。基于此,本文随机选取2019年1月—2020年12月高邮市人民医院消化内科收治的70例急性重症胰腺炎患者为研究对象,对谷氨酰胺应用于急性重症胰腺炎患者对其机体炎症反应影响进行前瞻性研究,为临床治疗急性胰腺炎患者提供可借鉴的途径。现报道如下。
1 资料与方法
1.1 一般资料
采取前瞻性研究方式,随机选取本院70例急性重症胰腺炎患者随机分为两组,对照组35例和观察组35例。对照组:男18例,女17例;年龄35~68岁,平均(52.68±2.12)岁;发病时间 9~27 h,平均(17.45±2.58)h。观察组:男20例,女15例;年龄35~70岁,平均(52.97±2.37)岁;发病时间 8~28 h,平均(17.68±2.64)h。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:所有患者诊断均符合中华医学会消化病分会胰腺疾病学组制定的“中国急性胰腺炎诊治指南(草案)”中SAP诊断标准[6];发病48 h入院者;对本研究知情,参与积极,并签署知情书者。
排除标准:原发性心、肾、肝、肺及脑等系统疾病患者;出血、感染、免疫性疾病患者;恶性肿瘤,或放化疗患者;胃肠功能障碍、肠梗阻等患者;重大疾病患者;特殊期女性;对谷氨酰胺等药物过敏患者。
1.3 方法
对照组:早期肠内营养,即:给予对症治疗,包括禁食水、胃肠减压、液体复苏等。入院当天,留置鼻肠管 30~40 cm,位置:Treitz韧带,严格把控输注速度:营养输注泵间歇输注法。经鼻肠管,持续缓慢滴入生理盐水后,改泵入肠内营养混悬液。待患者适用后,改为全量肠内营养,连用7 d。
观察组:早期肠内营养+谷氨酰胺(国药准字H20010191),早期肠内营养支持基础上,经鼻肠管饲入肠内营养剂+谷氨酰胺。初始剂量:0.4 g/kg,鼻饲速度15~20 mL/h,逐渐增至80~100 mL/次,第1天使用量约全量的一半,第2天改为全量,连用7 d。
1.4 观察指标
为探究谷氨酰胺应用于急性重症胰腺炎患者对其机体炎症反应的影响,本研究以急性生理与慢性健康评分Ⅱ(Acute Physiology and Chronic Health Evaluation, APACHEⅡ) 住院时间、炎性因子、肝功能、血清蛋白为观察指标,具体如下。
①APACHEⅡ评分、住院时间。APACHEⅡ评分评价患者病情,包括急性生理学、慢性健康状况等内容,分数0~71分,分数高病情重,分数低病情轻。
②炎性因子:白介素-6(interleukin-6, IL-6)、白介 素-8(interleukin-8, IL-8)、高敏 -C 反 应蛋 白(hypersensitivity-C-reactive protein, hs-CRP)。取空腹静脉血3 mL,离心分离5 min,采用酶联免疫吸附测 定(enzyme linked immunosorbent assay, ELISA)法检测。
③肝功能:血肌酐(serum creatinine, Scr)、尿素氮(blood urea nitrogen, BUN)、谷草转氨酶(aspartate transaminase, AST)。取空腹静脉血 3 mL,离心分离5 min,用ELISA法检测。
④血清蛋白:白蛋白(albumin, ALB)、血清前白蛋 白(prealbumin, PA)、血 红 蛋 白(hemoglobin,HGB)。取空腹静脉3 mL,离心分离10 min,采用全自动电化学发光免疫分析仪以及配套设备检测。
1.5 统计方法
采用SPSS 24.0统计学软件分析数据,计量资料符合正态分布以,(±s)表示,差异比较采用t检验;计数资料以频数和百分率(%)表示,差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者APACHEⅡ评分、住院时间比较
观察组APACHEⅡ评分低于对照组,住院时间短于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者APACHEⅡ评分、住院时间比较(±s)Table 1 Comparison of APACHE Ⅱ score and length of hospital stay between the two groups of patients(±s)

表1 两组患者APACHEⅡ评分、住院时间比较(±s)Table 1 Comparison of APACHE Ⅱ score and length of hospital stay between the two groups of patients(±s)
组别对照组(n=35)观察组(n=35)t值P值APACHEⅡ评分(分)7.12±1.56 4.98±1.25 6.333<0.001住院时间(d)14.98±2.27 8.89±1.14 14.814<0.001
2.2 两组患者炎性因子水平比较
观察组炎性因子水平低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者炎性因子水平比较(±s)Table 2 Comparison of inflammatory factors between the two groups of patients(±s)
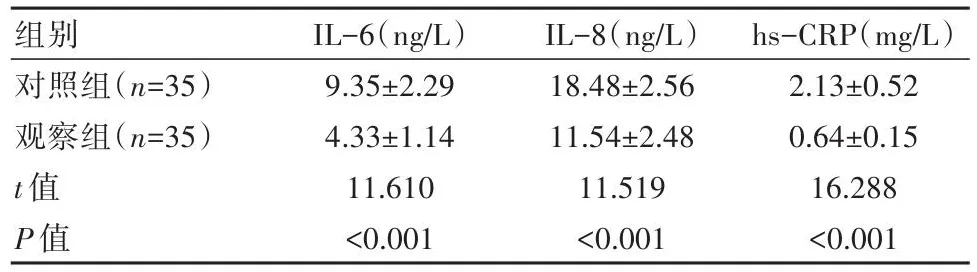
表2 两组患者炎性因子水平比较(±s)Table 2 Comparison of inflammatory factors between the two groups of patients(±s)
组别对照组(n=35)观察组(n=35)t值P值IL-6(ng/L)9.35±2.29 4.33±1.14 11.610<0.001 IL-8(ng/L)18.48±2.56 11.54±2.48 11.519<0.001 hs-CRP(mg/L)2.13±0.52 0.64±0.15 16.288<0.001
2.3 两组患者肝功能指标比较
观察组肝功能指标水平低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者肝功能指标比较(±s)Table 3 Comparison of liver function indexes between the two groups of patients(±s)
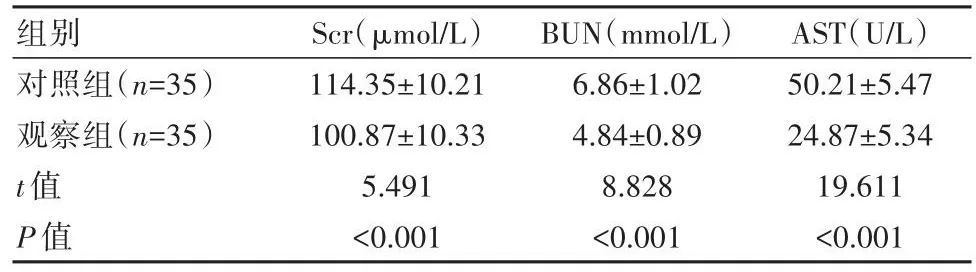
表3 两组患者肝功能指标比较(±s)Table 3 Comparison of liver function indexes between the two groups of patients(±s)
组别对照组(n=35)观察组(n=35)t值P值Scr(μmol/L)114.35±10.21 100.87±10.33 5.491<0.001 BUN(mmol/L)6.86±1.02 4.84±0.89 8.828<0.001 AST(U/L)50.21±5.47 24.87±5.34 19.611<0.001
2.4 两组患者血清蛋白指标水平比较
观察组血清蛋白水平高于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者血清蛋白指标水平比较(±s)Table 4 Comparison of serum protein levels indexs between the two groups of patients(±s)
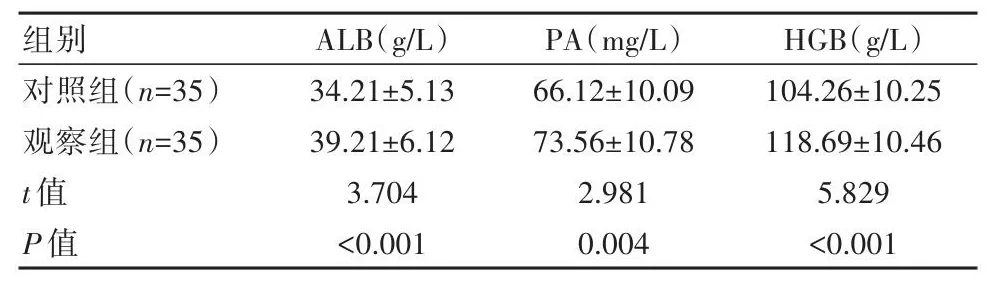
表4 两组患者血清蛋白指标水平比较(±s)Table 4 Comparison of serum protein levels indexs between the two groups of patients(±s)
组别对照组(n=35)观察组(n=35)t值P值34.21±5.13 39.21±6.12 3.704<0.001 66.12±10.09 73.56±10.78 2.981 0.004 104.26±10.25 118.69±10.46 5.829<0.001 ALB(g/L)PA(mg/L)HGB(g/L)
3 讨论
SAP具有起病急、病情重等特点,病情可在短期内迅速发展,存在较高的病死率。目前,临床尚未明确SAP的致病机制,但考虑与自身消化胰腺胰酶、肠道细菌转移等有关。SAP患者病情较重,治疗难度较高,严重影响患者的生活质量,需予以高度重视。SAP起病急骤,为炎症、微循环障碍,进展迅速,病情凶险,预后差,病死率高。手术并非SAP首选方案,因为手术治疗可加重机体炎性反应,增加术后并发症发生率,影响患者身心健康,增加家庭负担。研究显示,在SAP临床治疗中,营养支持治疗十分重要[7]。常见的营养支持治疗有肠内营养、肠外营养,其中肠外营养效果明确,但长期应用可造成肠黏膜萎缩,破坏肠道屏障功能,加重胰腺及组织器官损伤,易诱发MODS[8]。而肠内营养直接将营养供给肠黏膜,保证其结构与功能完整性,有效避免器官损伤和代谢紊乱的发生[9]。而且肠内营养促进肠道免疫球蛋白产生,改善机体营养状态。研究表明,SAP患者多主张早期肠内营养[10]。
于SAP患者而言,其机体最易受累的胰外器官是肠道,而且肠道还是MODS的启动者和主要器官[11]。一旦肠黏膜水肿、缺血、坏死,破坏肠道屏障,则易诱发并加重SIRS、MODS。谷氨酰胺是一种重要的营养物质,经氧化作用后,释放能量,能为核酸等提供氮源,有助于肠道修复[12]。谷氨酰胺治疗SAP的机制:①谷氨酰胺参与ATP过程,有助于黏膜细胞再生,确保细胞完整性;②促进HGF生成,提升谷氨酰胺酶(萎缩肠黏膜)活性,促进机体组织结构功能改善;③减少炎症因子释放,减轻组织损伤程度[13-14]。研究表示,谷氨酰胺通过多途径,能提高肠道屏障功能和免疫功能,促进患者预后质量改善[15]。本研究显示,观察组血清蛋白水平高于对照组(P<0.05),提示:谷氨酰胺有改善患者营养指标的效果。SAP的发病机制与炎症因子对胰腺损伤作用有关,而局部炎症诱发机体应激,可引发系统性炎症反应,进而损伤胰腺外脏器。研究报道,在SAP发病过程中,炎症因子起关键作用[16]。并且促炎因子及抑炎因子对胰腺局部产生的损伤,也与SAP的发病机制有关,也与局部炎症和系统炎症反应带来的机体应激反应有关。因此,在SAP病情预测和治疗判断中,常用炎性细胞因子变化作为有效指标,主要有 IL-6、IL-8、hs-CRP 等,均为炎性因子。SAP发生后,患者IL-6、IL-8、hs-CRP水平显著升高。IL-6水平在SAP早期显著升高,是诱导全身炎症反应和免疫损伤的主要炎症因子之一。IL-8为趋化因子介导IL-6的炎症损伤,可对肝脏产生直接损伤作用。hs-CRP是炎症反应特异性标志物,可促进巨噬细胞表达[17]。本研究中,对照组的IL-6(9.35±2.29)ng/L、IL-8(18.48±2.56)ng/L、hs-CRP(2.13±0.52)mg/L,均高于观察组的(4.33±1.14)ng/L、(11.54±2.48)ng/L、(0.64±0.15)mg/L(P<0.05),本研究结果与孙瑜婧[18]研究大致相同,在其研究中,分别给予患者全肠外营养干预、谷氨酰胺联合早期肠内营养干预,结果显示,常规组IL-6(6.77±1.29)pg/L、CRP(2.24±0.44)mg/L,高 于 联 合 组(5.20±1.10)pg/L、(1.42±0.39)mg/L(P<0.05)。研究结果说明,谷氨酰胺用于SAP患者中,有明确的改善效果,有助于早期肠内营养疗效的提高,并且也显著改善了患者病情和肝功能,缩短患者住院时间。
综上所述,谷氨酰胺治疗急性重症胰腺炎患者效果好,能有效改善患者病情,缩短患者住院时间,明显改善患者炎性因子水平、肝功能和血清蛋白水平,临床治疗效果突出,临床使用价值较高。

