PEG 包裹纳米金粒子作为新型CT 造影剂的初步探索
张雅颖,侯雨希,刘日,尹伟,彭雯佳,弓静
1.海军军医大学第一附属医院(长海医院)放射科(上海,200433)
2.同济大学附属上海市第四人民医院放射科(上海,200434)
0 引言
计算机断层扫描(CT)是临床最常用的诊断成像技术之一。由于软组织间缺乏足够的对比度[1],为区分软组织密度间的细微变化,往往依赖CT 增强造影来增加软组织间的对比度。临床使用的造影剂主要是碘基小分子,具有以下缺点:对肾毒性相对较高;成像时间短和成像无特异性[2]。这些缺点限制了CT 作为分子影像学手段的广泛应用。近年来随着纳米技术的发展,纳米尺寸的CT 造影剂开发得到了极大的推动。金纳米粒子比碘造影剂具有更好的X 线衰减值,更长的血液循环时间,并且金纳米粒子具有良好的化学稳定性和生物相容性,可以被各种功能分子修饰[1,3-4]。通过聚乙二醇(PEG)进行修饰,可以提高AuNP 的稳定性[5-6]。本研究目的在于将不同浓度的PEGlatedAuNPs 进行体外CT 扫描,与目前临床通用的非离子型碘造影剂—碘普罗胺(Iopromide)进行衰减系数和成像能力比较;然后通过皮下注入和静脉注射两种方式进行动物体内CT 的扫描,进行PEGlatedAuNPs作为新型CT 造影剂的初步影像学实验。
1 材料与方法
1.1 材料
1.1.1 实验药品与试剂:溴化十六烷铵(CTAB,国药集团上海化学试剂有限公司),氯金酸(HAuCl4)、硼氢化钠(NaBH4)、硝酸银(AgNO3)、抗坏血酸(美国Sigma-Aldrich 公司),聚乙二醇(PEG,西安瑞禧生物科技有限公司),优维显370(碘普罗胺,Iopromide,拜耳医药保健有限公司),异氟烷(Isoflurane,购自河北九派制药有限公司)。
1.1.2 实验动物:SD 大鼠7 只,雄性,体重250~300 g,第二军医大学动物实验中心。
1.1.3 实验仪器:256 层螺旋CT 机(Brilliance iCT;Philips heathcare;clevelandohio;USA),动物气麻机(MSS-3,上海任谊生物科技有限公司),自制样本扫描架。
1.2 方法
1.2.1 PEG 包裹纳米金粒子(PEGlatedAuNPs)的制备
采用晶种生长法制备金纳米粒子溶液,首先进行金种子液的制备,将5 mL 0.2 moL/L CTAB溶液加入到5 mL 5*10~4 moL/L HAuCl4溶液中,于28℃水浴中搅拌摇匀,然后缓慢加入冰冷的0.6 mL 0.01 moL/L NaBH4溶液作为还原液得到金种子液,待用。25 mL 0.2 moL/L CTAB 溶液加入750 μL 4 *10~3 moL/L AgNO3溶液与25 mL 1*10~3 moL/L HAuCl4溶液的混合液中,于28℃水浴中搅拌摇匀,然后缓慢加入350 μL 8*10~2 moL/L 抗坏血酸,得到生长液。最后将60 μL 的种子液加入到50 mL 的生长液中混合,震荡摇匀经生长2 h,即得到了纳米金颗粒(纳米金棒)原液。原液经过离心2 次(1×104r/min,10 min)纯化弃上清液后去除表面活性剂,收集浓缩的纳米金棒,重悬在去离子水中,继续震荡2 h,得纯化的纳米金粒。为避免纳米金粒子在体内聚集,接下来加入PEG(polyethylene glycol)衍生物进行表面修饰包裹。
1.2.2 纳米表征测定
使用紫外可见分光光度计检测的金纳米粒子溶液的光吸收谱。用透射电镜(TEM)观察纳米金粒子形态。TEM 图像在200 kV,放大倍数为80 000 倍。
1.2.3 体外CT 扫描及CT 值测定
离心纯化的AuNPs 粒子悬液和CT 造影剂碘普罗胺用去离子水稀释配置成梯度浓度,依次为0.1、0.2、0.4、0.6、0.8、1.0、2.0 mg/mL,共7个浓度。纯阴性对照组采用去离子水。将装有纯水、AuNPs 粒子悬液和碘普罗胺梯度液的离心管按浓度梯度摆放于管架上,浸入装有去离子水的玻璃皿中,摆放于CT 扫描台上,行CT 扫描,扫描参数为:管电压=80 kV,管电流=300 mAs,扫描视野=180 mm×180 mm,矩阵=512×512,层厚=0.8 mm,层间距=0.4 mm。三名有经验的放射科医师取相同层面勾画相同面积的ROI,测量每管样品的CT 值,取三者测量结果的平均数代表样品CT 值。
1.2.4 体内CT 成像
1 只健康成年SD 大鼠气麻机异戊烷麻醉后固定,行皮下注射扫描,将配置好的梯度浓度的纳米金粒子、碘普罗胺稀释液按顺序分别注射于左右腹部距中线2 cm 处皮下,注射剂量为10 μL。皮下注射后30 s、1 min、3 min、10 min、1 h、6 h、24 h、4 d、5 d 进行CT 扫描。CT 扫描参数:80 kV,300 mAs,转速0.5 s,准直宽度32×0.625 mm,PEGlatedAuNPs 体内成像6 只健康成年SD 大鼠随机分为AuNPs 实验组、Iopromide 对照组。实验组、对照组均以5 mg/kg 的剂量,经尾静脉缓慢注射AuNPs 对比剂和Iopromide。注射后15 s、30 s、5 min、30 min、1 h、2 h、4 h、24 h、36 h、48 h 进行CT 扫描,扫描参数同上,对比分析注射前后不同延迟时间段扫描结果,评估对比PEGlatedAuNPs、Iopromide 对各组织的增强能力及体内循环时间。
2 结果
2.1 PEGlatedAuNPs 的表征
合成的纳米金粒子实际上为棒状结构,也称为纳米金棒(gold nanorods,GNRS),其粒径均匀,分散性好,长径约为50~60 nm,短径约为20~30 nm(见图1),纳米金棒的光吸收曲线上其紫外吸收峰有2 个峰值,位置分别在520 nm 和690 nm 左右(见图2)。

图1 纳米金粒子的TEM 形貌特征Fig.1 Transmission electron microscope morphology of gold
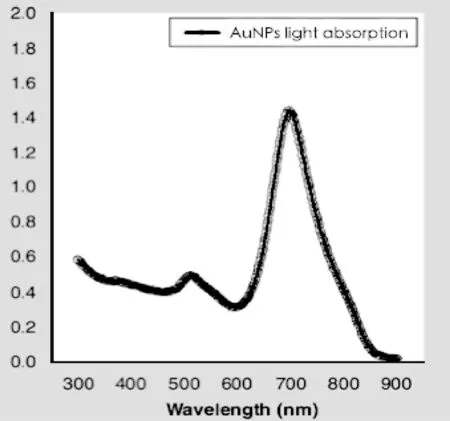
图2 纳米金粒子的光吸收曲线Fig.2 Optical absorption curves of gold nanorods
2.2 体外CT 成像及CT 值测量
三名有经验的放射科医师独立测量梯度浓度的PEGlatedAuNPs 粒子悬液和Iopromide 溶液的CT值。同时绘制CT 值随溶液浓度变化曲线,如图3(a) 所示,PEGlatedAuNPs 粒子悬液和Iopromide溶液的CT 值随着浓度的升高而升高,并呈线性相关。当浓度≤0.2 mg/mL 时PEGlatedAuNPs 粒子悬液的CT 值略低于相同浓度的Iopromide 溶液;当浓度>0.2 mg/mL 时,PEGlatedAuNPs 粒子悬液的CT 值高于相同浓度的Iopromide 溶液,且随着浓度的增加两者CT 值差异越来越大。不同梯度浓度的CT 灰度图如图3(b) 所示。

图3 CT 值随浓度变化规律Fig.3 Variation law of CT value with concentration
2.3 体内CT 成像
2.3.1 当梯度浓度为0.2~2.0 mg/mL 的PEGlated-AuNPs 粒子悬液和Iopromide 溶液注入SD 大鼠腹部皮下后,CT 可见皮下注射点周围形成高密度小点或片状高密度影,且局部CT 值随浓度升高而增加。形态上,PEGlatedAuNPs 呈球形或梭形,形态较为固定(图4)。Iopromide 呈散在的条形,分布范围较AuNPs 广。造影剂的吸收与消散情况,图4 (a)、(b)、(c) 箭头所指为皮下注射2 mg/mL 的Iopromide 造影剂的0 s、30 s、3 min 图像,0 s 时呈稍高密度条状影,30 s 呈散射条形等密度影,3 min 皮下造影剂团完全消散,同时观察到SD 大鼠的肾盂逐渐变亮,而小鼠对侧皮下同浓度的PEGlatedAuNPs 则一直为明亮的球形高密度影,在随后加扫的4 d[图4(e)]及5 d[图4(f)]图像,PEGlatedAuNPs 一直可见,但5 d 左右类圆形致密影周围可见条状向周围引流的高密度影。另外,研究中发现浓度达到0.4 mg/mL 的PEGlatedAuNPs就可以被肉眼分辩出来图4(d)。
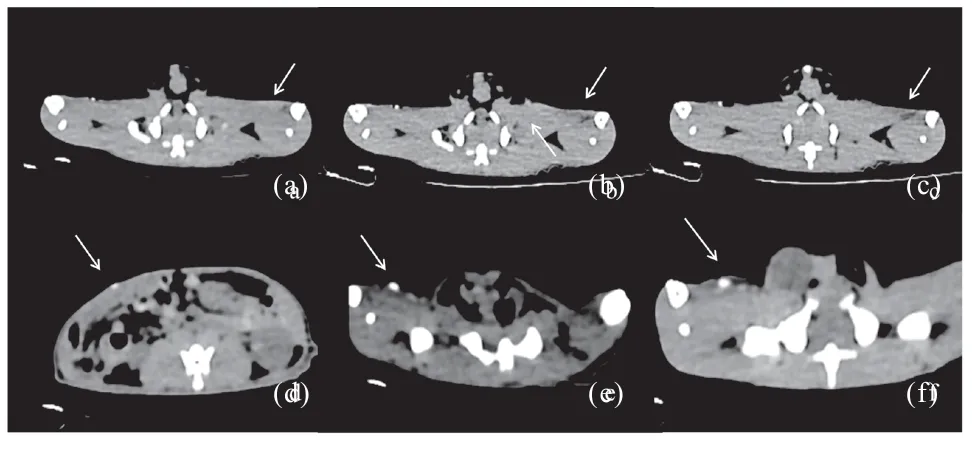
图4 梯度浓度PEGlatedAuNPs、Iopromide 皮下注射CT 图Fig.4 CT images of configured gradient concentration of PEGlated AuNPs and Iopromide after injection
2.3.2 鼠尾静脉注射将0.5 mg/mL 的PEGlatedAuNPs和Iopromide 造影剂以相同剂量(5 mg/kg)经鼠尾静脉缓慢注射到SD 大鼠体内,并行多时间点CT 扫描检测其肝肾膀胱的CT 值变化。Iopromide组的SD 鼠各器官的未见明显强化。而肾脏和膀胱30 s 就开始逐渐变亮,说明Iopromide 经肾脏迅速代谢(图5)。而PEGlatedAuNPs 组,鼠尾静脉造影剂注射后24 h 肝脏仍无明显强化,在36 h 时达到强化最高点,CT 值约82.3±3.7 Hu,之后至48 h,CT 值缓慢逐渐恢复为正常,说明PEGlatedAuNPs 有很好的体内相容性及明显高于其他造影剂体内循环时间(图5~图6)。而肾脏强化不明显说明PEGlatedAuNPs 主要代谢途径不是肾脏代谢。
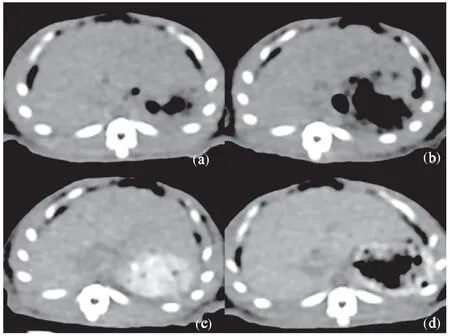
图5 PEGlatedAuNPs(0.5mg/mL)的体内成像Fig.5 PEGlated AuNPs(0.5mg/mL) in vivo
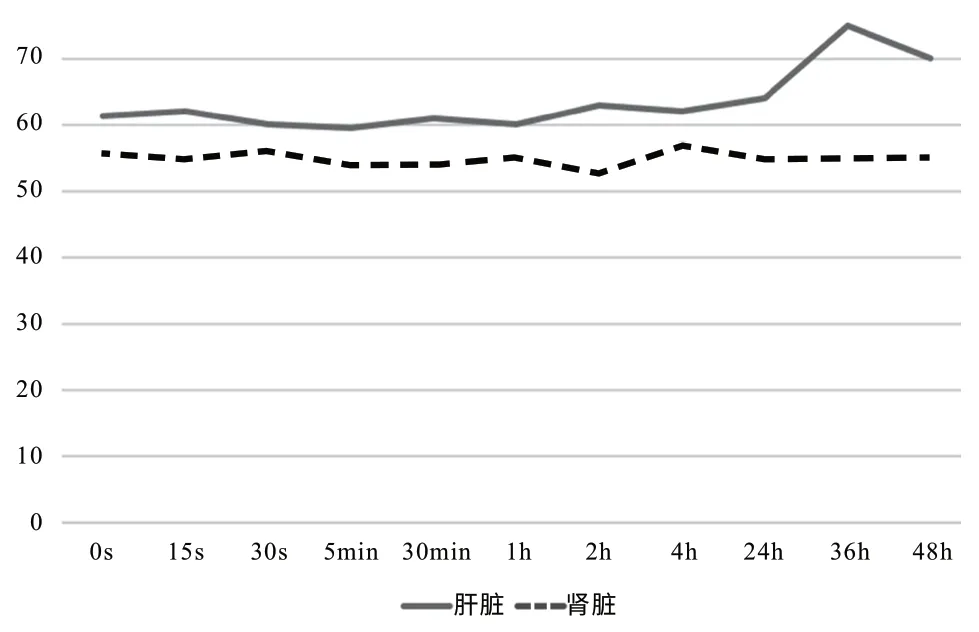
图6 PEGlatedAuNPs 经鼠尾静脉注射后各脏器CT 值随时间的变化Fig.6 The change of CT values of PEGlated AuNPs injected into tail vein in different organs with time
3 讨论
CT 成像具有良好的空间分辨率及快速的扫描速度,尽管CT 的对比分辨率远远高于传统的X线摄影,但由于大多数软组织具有相似的CT 值(0~50 Hu),仍然难以区分软组织密度的细微变化[1]。,往往依赖CT 造影来增加软组织间的对比度。尽管碘造影剂经历了多个发展阶段也克服了很多的临床困难[7-9],例如,非离子型与细胞膜,肽和其他生物结构相互作用的趋势较低,因此它们的毒性小于离子型[9]。二聚体比单体显示出更低的渗透压,这降低了注射部位的疼痛和热感,并降低了造影剂诱导的肾毒性(CMN)的发生率[4]。但是市售的造影剂如:碘普罗胺、碘海醇等,仍具有以下缺点:肾毒性相对较高;成像时间短和成像无特异性[10],另外小分子物质不易进行表面修饰,所有这些缺点限制了它们在CT分子影像中的应用。近年来随着纳米技术的发展,纳米尺寸的高原子序数CT 造影剂开发得到了极大的推动,其中比较有代表性的为:氧化钽纳米粒子[11-12]、硫化铋纳米粒子[13]和金纳米粒[1,3,4]。金纳米粒子比碘造影剂具有更好地X 线衰减值,更长的血液循环时间,并且金纳米粒子具有良好的化学稳定性和生物相容性。
3.1 PEG 与AuNPs 的生物相容性
金纳米粒子具有良好的生物相容性和毒性(半数致死量为3.2 g/kg)[3,14-15]。由于裸露的金纳米粒容易聚集、沉淀,会造成在生物组织部位严重的非特异性吸附,从而影响实验结果评价,因此表面要经过适当的修饰使其具有良好的分散性,增加稳定性。而目前应用较为广泛的为 PEG(聚乙二醇),PEG 已经通过 FDA 批准用于临床,又因巯基与金纳米粒(AuNPs)Au-S 之间具有很强的共价结合作用[5],故采用巯基化的 PEG(SH-PEG) 可以增加金纳米粒的稳定性[5-6],SH-PEG 进行表面修饰后金纳米粒具有较好的水溶性,生物相容性好,所以这种新型 CT 造影剂由高密度金纳米粒组成内核,外修饰 SH-PEG 后可以增加纳米粒的稳定性及生物相容性,可以大大延长循环时间。本研究中皮下注射及静脉注射PEGlatedAuNPs 造影剂的4 只健康SD 大鼠均未见死亡,且生存状态良好,与先前研究表明的良好生物相容性结果一致。
3.2 PEGlated AuNPs 的体外成像
CT 扫描成像基于不同组织间 X 线衰减率差别,而 X 线衰减率则是由组织的原子序数、组织密度和电子密度三者共同决定的。迄今为止,临床上使用的X 射线造影剂主要由小分子碘化合物组成,为实现良好造影需要的大剂量造影剂注射体内,这些分子可能会导致一些患者的严重副作用(例如过敏、心血管疾病和肾毒性)。众所周知,高原子系数元素X 线衰减率高,因此人们对利用高原子序数元素(例如金、铋、镱和钽)开发新型X 射线造影剂开发越来越感兴趣。金作为一种高原子序数和电子密度(金原子序数为 79,金电子密度 19.32 g/cm3)的金属材料,较常规的碘造影剂(碘原子序数 53,碘电子密度 4.9 g/cm3),金具有更高 X线衰减率,同摩尔浓度情况下其X 线衰减率是常规碘造影剂的 3 倍左右,增强显影效果更好[3,5,16]。本研究体外实验发现,在80 kV,300 mAs 的扫描条件下,随着浓度增加,PEGlatedAuNPs 粒子悬液与PEGlatedAuNPs 粒子悬液的CT 值均增加,浓度>0.2 mg/mL 时,我们此次制备的PEGlatedAuNPs粒子悬液的CT 值即高于相同浓度的Iopromide 溶液,浓度>0.4 mg/mL 时可以产生肉眼可辩的密度差别(CT 值相差约20 Hu),浓度等于0.8 mg/mL 时,PEGlatedAuNPs 粒子悬液几乎为相同浓度的Iopromide 溶液的两倍,且随着浓度的增加两者CT 值差异越来越大,与以往的金纳米粒子体外研究结果基本一致[3,17-18]。说明金纳米粒子的成像能力优于同浓度的碘溶液,其衰减系数高,这也是金纳米粒子作为CT 造影剂得以应用的首要条件,也是最基本的要求。
3.3 PEGlatedAuNPs 的体内成像
在体内皮下注射实验中我们发现,碘造影剂虽为高密度物质,但因其为小分子物质,容易在组织间分散成条片状,并极快进入血液循环代谢而逐渐降低密度,导致皮下停留时间极短,数分钟内即被清除而无影可寻。PEGlatedAuNPs 粒子悬液较碘形态更规则,始终表现为点状的高密度影,不易在皮下离散,我们猜测是由于两者的表面张力存在差异所致,并且在随后多个时间点CT 扫描发现皮下金溶液的CT 值有所上升,我们考虑是其液性成分被组织间隙吸收所致,并且在5 d 后≥0.4 mg/mL 浓度的皮下金溶液仍然可见,而本次研究所制得PEGlatedAuNPs 长径约为50~60 nm,短径为20~30 nm,在皮下能长时间停留而不易被内皮系统吞噬,5 d 后才开始逐渐向周围组织条状扩散,是一种理想的原位注射示踪剂,如果应用于表浅肿瘤的注射或者皮下种植瘤的注射,将来可以应用CT 来查看金纳米粒子在肿瘤部位的聚集与消散情况监测肿瘤的生长消散情况,又可以利用其在肿瘤原位长期存留不易消散的特性,再利用金纳米粒子的“ 光热效应”[19-20]的物理特征,通过近红外线开展肿瘤的光热治疗,使金纳米粒聚集的肿瘤部位迅速升温来实现肿瘤的精准治疗而不损伤周围正常的组织。本研究所制备的金纳米粒及其体内皮下注射的分布形态和特点,说明金纳米粒子除了优越的衰减系数应用于X 射线成像之外[21],还可以在肿瘤的原位注射监测生长、肿瘤的精准光热治疗、诱导肿瘤凋亡等方面[22-24]有更广泛的应用。
随着纳米技术的进步,2006 年Hainfeld[3]在体内首次应用金纳米粒作为 CT 造影剂应用于血管成像,之后陆续有实验证明的直径在 1~100 nm 的金纳米粒,因为表面更容易被修饰、携带靶向分子且无毒[16]、体内生物相容性好、体内循环时间长[5],是一种理想的 CT 造影剂物质。本研究所用的PEGlatedAuNPs 粒径均匀,分散性好,在体内鼠尾静脉造影剂注射实验中我们发现PEGlatedAuNPs 的在肝脏显像达峰时间为36 h,而肾脏基本未见强化,也证实了金纳米粒子体内循环时间长,主要经肝脏代谢的特点,作为CT 造影剂可以很好地克服碘造影剂肾毒性和循环时间短的缺点。根据Hainfield[3]报道,该团队采用1.9 nm直径的AuNPs,以2.7 g/kg 的剂量经鼠尾静脉注射浓度为270 mg/mL 的AuNPs 可以实现血管和血池的良好显像,但我们的研究考虑到经济成本,金的浓度和总量比较低,缓慢注入后迅速被血液稀释而无法使血池显示成高密度。就金纳米粒子的体内代谢和碘溶液的体内代谢而言,碘造影剂容易做到血池显像,而金纳米粒子的优势并不在于血池显像,而在于其可以在较小的用量下就能实现良好的器官显像,如果携带特定的功能基团可以实现器官或者组织的靶成像。
综上所述,本次研究所制备的PEGlatedAuNPs粒子作为新型CT 造影剂,具有高 X 线衰减率,体内生物相容性好,体内循环时间长的特点。此外,可用各种靶向配体(例如,叶酸,RGD 肽,抗体)进一步功能化PEGlatedAuNPs 粒子,实现CT 分子成像,利用其光热效应又可以实现肿瘤的精准治疗,具有广阔的应用前景。

