肿瘤坏死因子α诱导蛋白6在胃癌组织中的表达及其与预后的关系
戚利坤,王巍
胃癌是全球范围内常见的消化系统恶性肿瘤,其发病率与病死率均居所有恶性肿瘤的前列[1-2]。目前,胃癌患者的5年总体生存率仍不足40%,术后的局部复发或远处转移依然是胃癌临床治疗亟待解决的问题[3-4]。寻找胃癌复发转移相关的生物标志物对于患者的预后预测及后续治疗策略的制定具有重要的临床意义。肿瘤坏死因子α 诱导蛋白(TNFαIP)是由肿瘤坏死因子α(TNF-α)诱导产生的一类透明质酸结合蛋白家族,包括TNFαIP1、TNFαIP3、TNFαIP4、TNFαIP6、TNFαIP8 等[5]。研究发现,这些蛋白参与了包括炎症反应、免疫应答、细胞增殖、凋亡、细胞黏附等多种生物学进程,在多种疾病的发生、发展中扮演着至关重要的角色[6-7]。有研究发现,TNFαIP6 高表达与炎症性肠病的活动性及组织损伤程度有关[8-9]。基于肿瘤微环境中炎症反应与癌症之间的密切联系[10],笔者推测TNFαIP6可能参与了胃癌的发生发展过程。本研究通过免疫组化染色观察TNFαIP6蛋白在胃癌组织中的表达情况,分析TNFαIP6 表达与胃癌患者临床病理特征及预后的关系,旨在揭示其在胃癌转移中的作用及对预后的预测价值,为胃癌的分子靶向治疗提供依据。
1 对象与方法
1.1 研究对象 选取2015 年6 月—2019 年1 月青海省肿瘤医院收治并行手术治疗的133例胃癌患者作为研究对象。所有患者术后经组织病理学证实为原发性胃腺癌,术前未行任何治疗。收集患者术后的组织标本,肿瘤组织于癌中心部位取材,癌旁组织取胃癌组织周边5 cm以外的正常胃黏膜。收集胃癌患者的一般资料及临床病理特征,包括年龄、性别、肿瘤直径、组织学分化类型、Borrmann 分型、肿瘤TNM 分期、血管侵犯、神经浸润。本研究的设计与实施经本院伦理委员会批准,所有患者均签署告知同意书,明确手术标本的使用目的。
1.2 免疫组化染色检测TNFαIP6 表达 将胃癌组织标本连续切片制成4µm厚度的组织薄片,依次进行脱蜡、梯度乙醇脱水、抗原修复及去除内源性过氧化物酶。切片使用山羊血清封闭后,加入兔抗人TNFαIP6 单克隆抗体(1∶200,购自美国Santa Cruz)于4 ℃下孵育过夜;次日使用磷酸盐缓冲液(PBS)清洗切片3 次,二抗孵育后进行DAB 显色,苏木素复染,显微镜下观察染色强度及染色细胞的比例。随机读取4个高倍视野,以染色阴性或染色不清为0 分,浅黄色为1 分,棕黄色为2分,棕褐色为3分;同时,计数200个细胞,计算阳性细胞百分比,染色阳性细胞百分比<5%计0 分,5%~25%计1 分,26%~50%计2 分,51%~75%计3 分,>75%计4 分。TNFαIP6 在胃癌组织中的免疫组化评分基于染色强度与染色细胞比例得分的乘积,总分<4 分为低表达,≥4 分为高表达。
1.3 随访 所有患者于术后定期至我院门诊进行复查,具体项目包括:血清肿瘤标志物测定及胸、腹、盆腔CT 检查,每3个月1 次;胃镜,每年1 次,以监测肿瘤的复发与转移。术后随访通过电话及查阅病历等方式进行,末次随访时间为2020年7月,全部病例无失访,中位随访时间为45.3个月(2~61个月)。本研究的主要终点事件为总体生存期(overall survival,OS),即自手术之日起至末次随访或因任何原因死亡的时间。
1.4 统计学方法 采用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示;计数资料以例(%)表示,组间比较采用χ2检验。采用Kaplan-Meier 法绘制TNFαIP6 高表达与低表达患者的生存曲线,2 组患者的生存率差异采用Log-rank检验。采用Cox风险比例回归模型评估胃癌患者预后的影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 患者临床病理情况 133例患者中男83例(62.4%),女50例(37.6%);患者年龄34~90岁,平均(63.7±10.1)岁;中高分化腺癌69例,低分化腺癌64例;T1~T2 期71例,T3~T4 期62例;64例(48.1%)存在淋巴结转移,9例(6.8%)在诊断时已存在远处转移;血管侵犯与神经浸润的发生率分别为54.1%(72∕133)和16.5%(22∕133)。
2.2 不同临床特征患者的TNFαIP6 表达水平比较 免疫组化染色结果显示,TNFαIP6 在胃癌组织中呈明显阳性表达,以胞浆表达为主,呈弥漫性分布,而在癌旁组织中则多呈阴性表达或弱阳性表达,见图1。基于免疫组化染色评分,133例患者中TNFαIP6 低表达81例,高表达52例。低分化腺癌、Borrmann Ⅳ型、T3~T4期、M1期、血管侵犯及淋巴结转移者TNFαIP6高表达的比例更高,见表1。
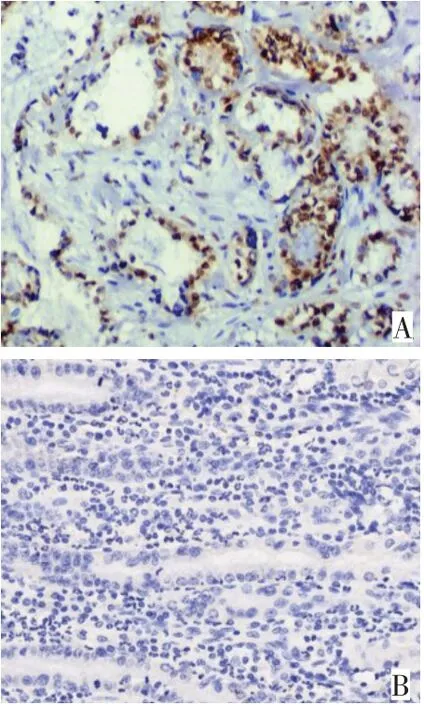
Fig.1 The expression of TNFαIP6 in gastric cancer and adjacent normal tissues detected by immunohistochemistry(×400)图1 免疫组化检测TNFαIP6在胃癌及癌旁组织中的表达(×400)
2.3 不同TNFαIP6 表达水平患者的生存分析结果 随访期内,共31例患者死亡,Kaplan-Meier 生存曲线显示,TNFαIP6 高表达与低表达患者5 年总生存率分别为56.5%和82.9%,差异有统计学意义(Log-rankχ2=12.404,P<0.01),见图2。
2.4 胃癌患者预后的影响因素分析 单因素Cox回归分析结果显示,肿瘤直径、Borrmann Ⅳ型、T分期、N分期、M分期、血管侵犯、神经浸润及TNFαIP6表达情况均为胃癌患者预后的影响因素,见表2。选取T分期、M 分期、TNFαIP6 表达情况纳入多因素Cox 回归分析,结果表明T3~T4期、M1期及TNFαIP6高表达是胃癌患者死亡的危险因素,见表3。
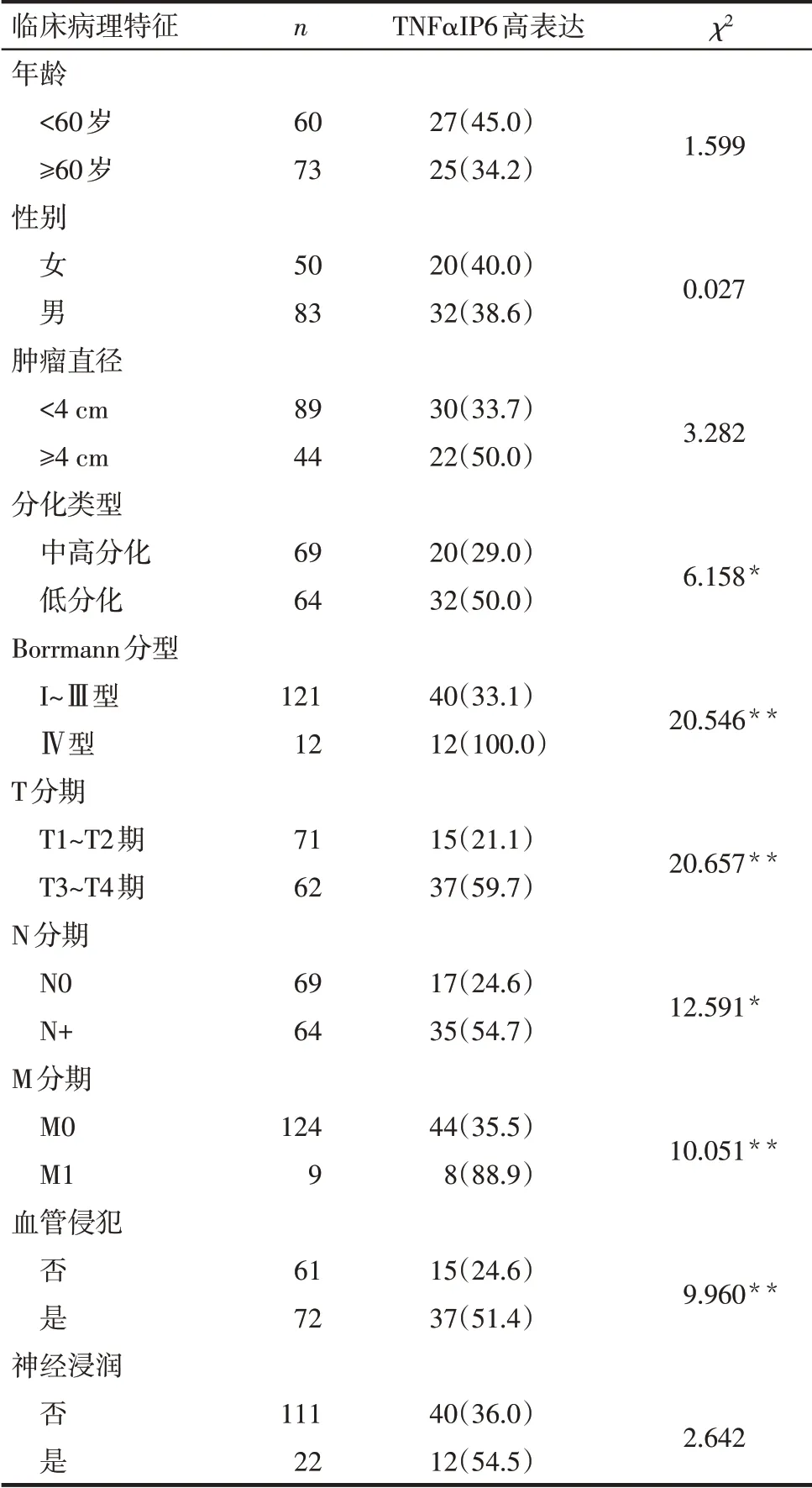
Tab.1 Comparison of TNFαIP6 high expression ratio in gastric cancer patients between different clinicopathological characteristics表1 不同临床病理特征的胃癌患者TNFαIP6高表达比例比较 [例(%)]
3 讨论
肿瘤术后的复发与转移是胃癌患者预后不佳的主要原因,寻找、认定胃癌患者预后相关的分子标志物对于揭示肿瘤发生发展的具体机制具有重要的意义。本研究通过免疫组化染色发现,与癌旁组织相比,TNFαIP6 在胃癌组织中呈明显阳性表达,且TNFαIP6高表达与胃癌一系列侵袭性的临床病理特征如低分化腺癌、Borrmann Ⅳ弥漫型胃癌、更深的肿瘤浸润、淋巴结转移、淋巴血管侵犯及远处转移有关,提示TNFαIP6 可能参与了胃癌的发生与进展。生存分析及回归分析进一步表明,TNFαIP6 高表达患者生存时间缩短,高表达者死亡风险是低表达者的2.742倍,提示患者预后不佳。
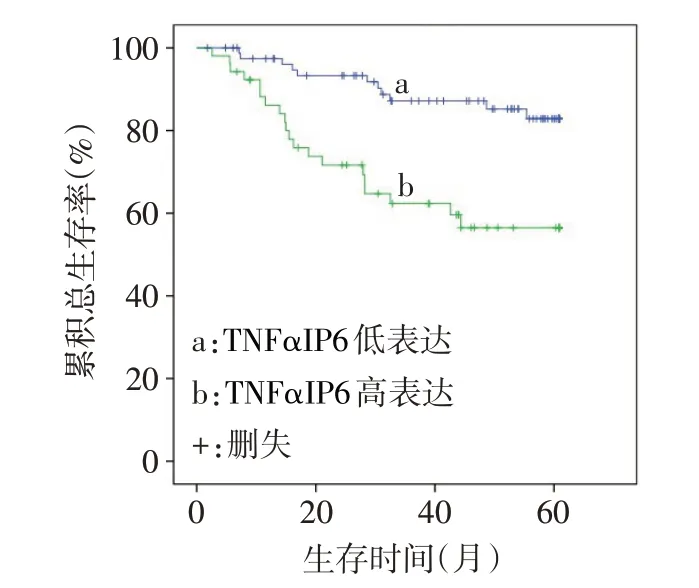
Fig.2 The Kaplan-Meier curves of patients with high and low expression levels of TNFαIP6图2 TNFαIP6高表达与低表达患者的生存曲线

Tab.2 Univariate Cox regression analysis on prognosis of gastric cancer patients表2 影响胃癌患者预后的单因素Cox回归分析
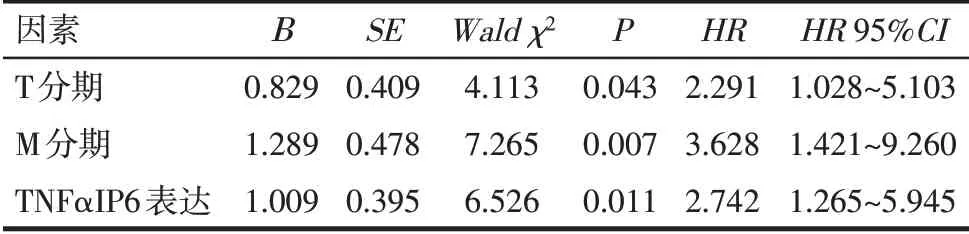
Tab.3 The multivariate Cox regression analysis identified independent predictors of the prognosis of gastric cancer patients表3 影响胃癌患者预后的多因素Cox回归分析
TNFAIP6 基因位于人类染色体2q23.3,TNFαIP主要分布于细胞外,是一类由TNF-α、干扰素γ、白细胞介素-1 等炎性细胞因子诱导产生的炎症相关蛋白[6,11]。既往研究发现,TNFαIP6在包括炎症性肠病[8]、风湿性性关节炎[12]等多种炎性疾病中呈明显异常表达。近年一些研究报道了TNFαIP6在实体肿瘤中的致癌作用,进一步揭示了肿瘤微环境中的炎性细胞、炎症因子及信号分子与恶性肿瘤侵袭和转移的关系。Chan 等[13]研究发现,TNFαIP6 蛋白在尿路上皮癌中呈明显阳性表达,其高表达与进展的肿瘤分期、淋巴结转移、神经浸润、血管侵犯及高有丝分裂率显著相关,是尿路上皮癌患者不良预后的独立预测因素。Rachidi 等[14-15]报道TNFαIP6 蛋白在结肠癌、卵巢癌组织中的表达较癌旁正常组织明显升高,是患者预后不良的标志。这些研究结果说明TNFαIP6 可能在恶性肿瘤的发生、发展过程中起重要作用,而检测TNFαIP6 的表达可能有助于肿瘤患者的预后评估及治疗策略的制定。目前越来越多的证据表明,进展期胃癌患者可以从术后的辅助化疗中获益,降低复发转移,改善长期生存结局[16-17]。本研究结果揭示,低分化腺癌、Borrmann Ⅳ型胃癌、T3~T4期肿瘤、淋巴结转移、血管侵犯者TNFαIP6高表达的比例更高。同时,TNFαIP6 高表达患者也更易发生远隔器官转移,预后更差。对于TNFαIP6 高表达的胃癌患者,更加积极的辅助治疗与密切的术后随访策略必不可少。
目前,已有多项研究证实,慢性炎症反应在多种恶性肿瘤的发生发展中扮演着至关重要的角色[18-20]。作为一种炎症相关因子,TNFαIP6 可能通过激活炎症细胞,募集炎症信号分子参与了肿瘤相关炎症反应,进而促进了肿瘤细胞的侵袭与转移。近 期Zhang 等[21]发 现,下 调 人 胃 癌 细 胞AGS 与MKN28中TNFAIP6表达能够显著抑制细胞增殖、侵袭与迁移能力,揭示了TNFAIP6 基因对胃癌细胞恶性生物学行为的作用。然而,到目前为止,关于TNFAIP6基因影响胃癌细胞增殖、侵袭、迁移的具体分子机制仍然没有被阐明。
综上,TNFαIP6 在胃癌组织中的阳性表达与肿瘤的侵袭性特征显著相关,是影响胃癌患者预后的一个独立预测标志物。TNFαIP6可能作为癌基因参与胃癌的发生与进展,其对胃癌生物学行为的影响及可能涉及的分子机制需要进一步研究探索。

