氧化铁红对印染废水中锑(V)的吸附性能
周楚晨,李成,钱建英,杨昆仑,胡韵璇,徐新华*
(1.浙江大学环境与资源学院,浙江 杭州 310058; 2.中煤科工集团杭州研究院有限公司,浙江 杭州 311201)
锑(Sb)是一种稀有元素,在人们的生产生活中应用广泛,如作为油漆颜料、聚合物催化剂和阻燃剂等。含锑的聚酯纤维原料将锑元素引入印染废水,主要以正五价(V)形式存在。由于锑元素具有一定毒性[1],进入环境后会给人类健康带来威胁,对含锑印染废水进行除锑处理十分必要。因此,在研究除锑方法时,需考虑各因素对除锑过程的影响。
吸附法作为常见的除锑方法,具有操作简便、经济高效等特点[2-4]。研究证明,铁氧化物,如针铁矿、赤铁矿、四方纤铁矿等均可有效去除锑,且Sb(V)主要以内层络合的形式吸附在铁氧化物表面[2,5-7]。氧化铁红的主要成分为氧化铁(Fe2O3),被大量应用于着色,如涂料、颜料等领域[8-9]。人工氧化铁红制备简便,价格低廉,具有成为较经济的除锑吸附剂的潜力。氧化铁红的制备条件对其表面物化性质有一定影响,因此本文采用3 种不同型号的氧化铁红材料进行实验与表征,探究其晶体结构组成与位点分布异同,及其对锑的吸附效果,为合成高效吸附材料提供参考。
根据实际印染废水条件,将3 种商业氧化铁红材料作为吸附剂,借助X 射线衍射仪(X-ray diffraction,XRD)、透射电子显微镜(transmission electron microscope,TEM)、X 射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS)、傅立叶变换红外吸收光谱仪(Fourier transform infrared spectroscopy,FTIR)、比表面积测定仪(Brunauer emmett teller,BET)等对材料进行表征,测定材料吸附性能,并分析溶液pH、离子浓度、共存含氧阴离子和染料对吸附的影响,以期为氧化铁红的实际应用提供数据支持与参考。
1 材料与方法
1.1 实验材料与试剂
氧化铁红购于灵寿县盛泰矿产品加工厂,型号分别为110、138 与190,记为T110、T138、T190。
盐酸、氢氧化钠、氯化钠、硫酸钠、碳酸氢钠、硝酸钠、磷酸钠、醋酸钠、抗坏血酸、硫脲、硼氢化钾等化学试剂均购于国药集团化学试剂有限公司。焦锑酸钾与锑单元素标准溶液购于阿拉丁试剂(上海)有限公司。
各试剂纯度达分析纯以上,使用前不再进行纯化。
1.2 主要仪器与表征技术
采用Tecnai G2 F20 高分辨场发射透镜电子显微镜(HRTEM)对3 种氧化铁红材料的微观形态结构进行观察,分析微观尺寸。采用ASAP2460 BET氮气吸附脱附仪测定材料的比表面积、孔径和孔容。
采用X'pert PRO XRD、Nicolet IS5 FTIR、Axis Ultra DLD XPS 等对材料进行系列表征,分析晶体结构、表面元素存在形式与表面官能团分布,以及吸附前后的变化。
采用Zetasizer Nano ZS Zeta 电位分析仪(Zeta),对3 种材料在不同pH 下的表面电荷分布进行测定。
1.3 吸附实验与分析方法
称取一定量焦锑酸钾溶液,用去离子水稀释定容,得到一定浓度的含Sb(V)模拟废水溶液。用1 mol·L-1的NaOH 和HCl 溶液调节模拟废水溶液的pH。实际废水取自嘉兴某印染厂的污水处理站气浮池。
在进行吸附实验时,量取50 mL 模拟废水和实际废水溶液,加入10 mg 氧化铁红材料(投加量为0.2 g·L-1),在25 ℃,130 r·min-1条件下,恒温振荡。用注射器快速取样,并通过0.45 μm 的微孔滤膜过滤。对所得滤液采用原子荧光分光光度计测定Sb(V)的浓度,计算锑去除率η(%)和吸附容量qe(mg·g-1):
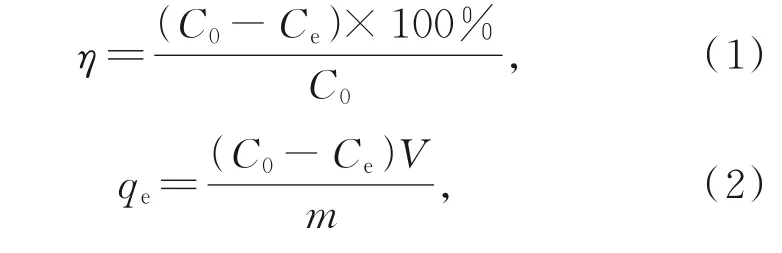
其中,C0为Sb(V)初始浓度(mg·L-1),Ce为吸附实验达到平衡时Sb 的浓度(mg·L-1),V为溶液体积(L),m为氧化铁红材料的投加质量(g)。
2 结果与讨论
2.1 XRD 表征
分别对T110、T138 与T190 进行XRD 分析,所得图谱如图1 所示。由图1 可知,3 种氧化铁红材料的特征峰位置相似,与α-Fe2O3的标准卡片所示的特征峰相符,表明其主要成分为α-Fe2O3。T138 具有相对较尖锐的特征峰,表明其可能具有较好的结晶度和较大的粒径。
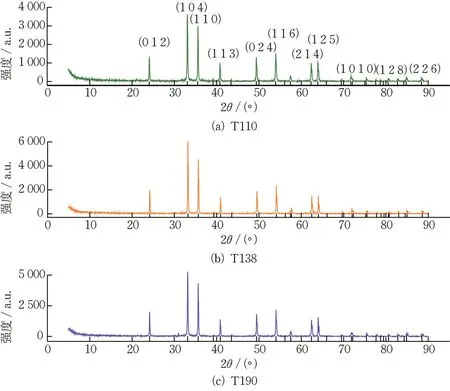
图1 3 种氧化铁红材料的XRD 图谱Fig.1 XRD patterns of three types of iron oxide red
采用Debye-Scherrer 方程,估计3 种氧化铁红材料的平均粒径:

其中,k=0.9 为谢勒常数,λ=0.154 nm 为X 射线波长,β为峰长半高处的峰宽,θ为衍射角。经计算,T110 的平均粒径约为93.43 nm,T138 的平均粒径约为94.23 nm,T190 的平均粒径约为97.97 nm。T110 的平均粒径较其他2 种材料相对更小。
2.2 TEM 表征
分别对3 种氧化铁红材料进行HRTEM 表征,以观察其形貌与微观结构差异,所得结果如图2 所示。由图2(a)~(c)可知,T110 形状为六边形,且厚薄程度与横向尺寸分布相对均匀,平均粒径约为143.67 nm。T138 的形貌与T110 具有显著差异,表面呈褶皱状,表明材料厚薄分布相对不均匀,存在不规则凹陷与凸起。T190 的形状、大小分布不均匀,存在明显团聚现象,可能影响其对Sb(V)的吸附效果。
由图2(d)~(f)可知,T110 体系内存在2 种衍射条纹,且晶格间距分别为0.268 nm(1 0 4 晶面),0.252 nm(1 1 0 晶面),表明材料的主要成分为α-Fe2O3。T138 的衍射条纹与α-Fe2O3的1 1 0 晶面衍射条纹相符,T190 的衍射条纹则与α-Fe2O3的1 0 4 晶面衍射条纹相符。3 种材料主要成分均为α-Fe2O3,但主要晶面取向各不相同,可能由于各材料生产工艺存在差别。

图2 氧化铁红110、138 和190 的HRTEM 结果Fig.2 HRTEM images of T110,T138 and T190
2.3 FTIR 表征
图3 为3 种氧化铁红材料在吸附前后的FTIR图谱。可知,3 种材料均在约3 420 和1 635 cm-1处具有吸收峰,由材料表面吸附水分子中—OH 的伸缩振动与变形引起。在480 和570 cm-1处的吸收峰是由Fe—O 伸缩振动引起的,且指纹区内的特征峰与α-Fe2O3的特征峰相似,表明材料的主要成分为α-Fe2O3[10],与XRD 的表征结果相符。
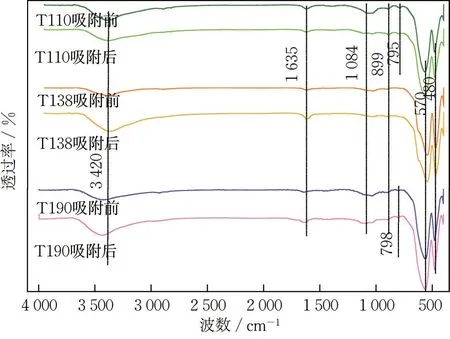
图3 3 种氧化铁红材料吸附前后的的FTIR 图谱Fig.3 FTIR images of three types of iron oxide red before and after adsorption
2.4 XPS 表征
图4 为3 种氧化铁红材料的XPS 图谱。由图4(a)可知,T138 表面O—H 峰的面积与其余2 种材料有明显差别,且其O—H 与Fe 原子数之比分别为T110 和T190 的1.8 和1.7 倍,表明T138 表面羟基含量相对较高。由图4(b)可知,3 种氧化铁红材料的Fe 2p1/2和Fe 2p3/2特征峰分别位于约724 和711 eV处。根据拟合结果,T110 与T190 的卫星峰均位于约732 和718 eV 处,T138 的卫星峰位于729 和715 eV 处,向低结合能方向偏移,体现了Fe2+的卫星峰特征,且T138 的Fe 2p 特征峰也具有向低结合能方向偏移的特征,以上结果表明,T138 中的α-Fe2O3可能被部分还原[11]。
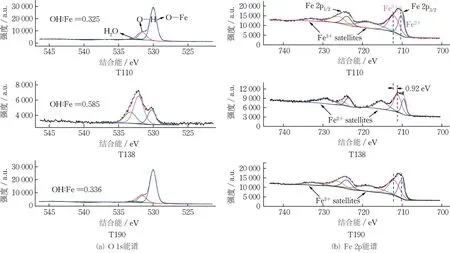
图4 3 种氧化铁红材料的XPS 图谱Fig.4 XPS images of three types of iron oxide red
3 种氧化铁红材料在吸附后的XPS 图谱如图5所示。可知,吸附后的氧化铁红材料的O 1 s 能谱均在约540 eV 处出现了Sb 3d 峰,表明3 种氧化铁红材料表面均能成功吸附Sb(V)。

图5 3 种氧化铁红材料吸附后的O 1 s 图谱Fig.5 O 1 s images of three types of iron oxide red after adsorption
2.5 吸附动力学
对实际印染企业废水进行取样,并测定相关参数,可知废水中Sb(V)浓度为180~200 μg·L-1,且呈中性。因此,本文将吸附实验的pH 设为7±0.1,Sb(V)初始浓度设为200 μg·L-1,以模拟印染废水。在模拟废水中分别加入3 种氧化铁红材料,并在0~24 h 内随机取样,以探讨吸附时间Sb(V)吸附量的影响,并进一步分析其吸附特性。
对实验结果进行拟合,拟合方程分别采用准一级动力学方程:
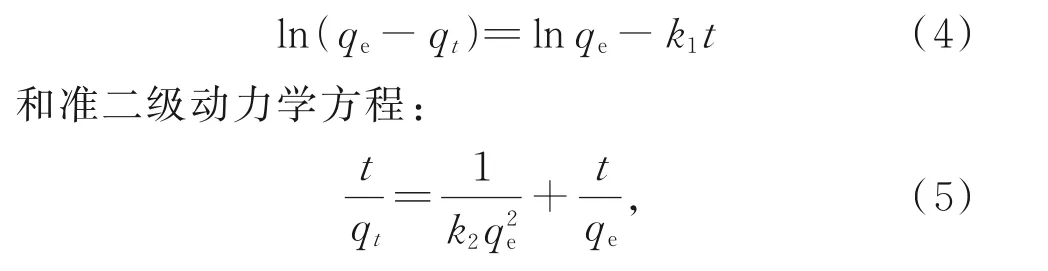
其中,t为吸附时间(min),k1(min-1)和k2(g·mg·min-1)分别为准一级和准二级动力学方程的速率常数,qt和qe(mg·g-1)分别为氧化铁红材料在t时刻与平衡时的Sb(V)吸附量。
拟合结果见图6,相关参数见表1。由图6 可知,3 种氧化铁红材料的吸附量在前120 min 均较大。T138 可于60 min 前达到平衡,且其平衡吸附量约为1.60 mg·L-1,高于T110 与T190,表明T138 表面可能具有更多的活性位点或活性位点更易与Sb(V)结合。
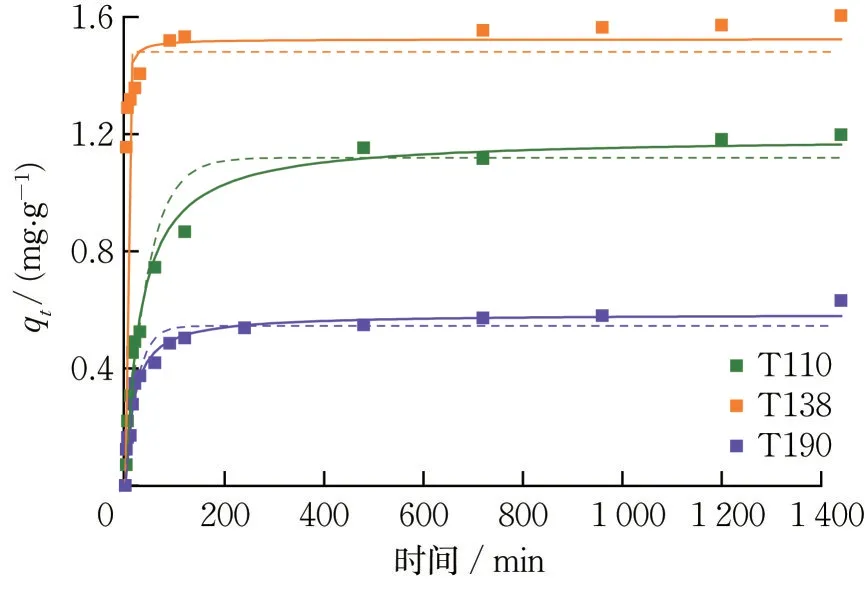
图6 吸附时间对氧化铁红的Sb(V)吸附效果影响(温度:298 K,吸附剂投加量:0.1 g·L-1,接触时间:24 h)Fig.6 Effect of time on Sb(V)adsorption by iron oxide red(T=298 K,adsorbents dosage=0.1 g·L-1,contact time=24 h)虚线为准一级动力学方程拟合结果,实线为准二级动力学方程拟合结果。The solid and dash lines correspond to pseudo-first and pseudo-second order kinetic fitting results.
由表1 可知,3 种氧化铁红材料的准二级动力学方程拟合系数R2均在0.97 以上,相比准一级动力学方程的R2更接近1,表明氧化铁红对Sb(V)的吸附过程更符合准二级动力学方程,以化学吸附为主,受到表面反应的制约[12]。
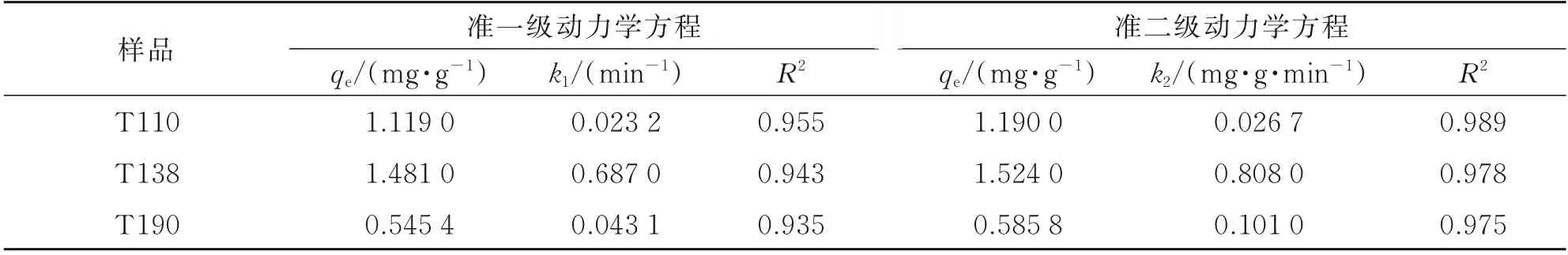
表1 氧化铁红对Sb(V)的吸附动力学拟合参数Table 1 Adsorption kinetic parameters of the Sb(V)adsorption by iron oxide red
2.6 吸附等温线
加而逐渐增加,并趋于饱和。相同浓度下,T138 的Sb(V)吸附量均高于其他2 种材料。
为进一步探究氧化铁红材料的Sb(V)吸附性能差异,对所得实验数据进行拟合,拟合方程分别采用Langmuir 吸附等温线模型:

其中,KL(L·mg-1)为温度相关的Langmuir 等温线常数,KF(mg(g·mg1/n)-1)为吸附容量相关的Freundlich 等温线参数,n为吸附强度的常数,qm(mg·g-1)为吸附剂的最大单分子层吸附量,Ce(mg·L-1)为吸附平衡时的Sb(V)浓度。
所得参数如表2 所示,拟合曲线如图7 所示。
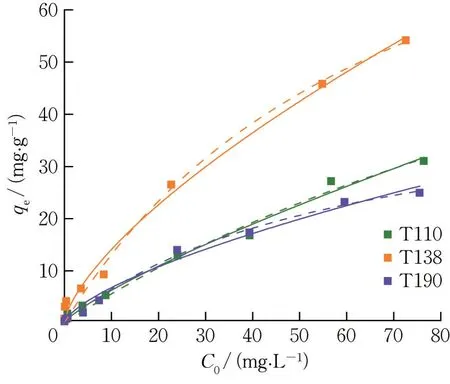
图7 Sb(V)初始浓度对氧化铁红的Sb(V)吸附效果影响(温度:298 K,吸附剂投加量:0.1 g·L-1,接触时间:24 h)Fig.7 Effect of initial concentration on Sb(V)adsorption by iron oxide red(T=298 K,adsorbents dosage=0.1 g·L-1,contact time=24 h)虚线为Langmuir 模型的拟合结果,实线为Freundlich模型的拟合结果。The solid and dash lines correspond to Freundlich and Langmuir models.
由表2 可知,3 种氧化铁红材料的Langmuir 模型、Freundlich 模型拟合参数R2均在0.98 以上,差别较小。T110 的Freundlich 模型拟合参数R2略高于Langmuir 模型,表明Freundlich 模型可更好地描述吸附过程。Freundlich 模型主要描述了非均相表面的吸附过程,表明T110 与T138 表面活性位点可能具有不均一性,吸附过程相对复杂[13]。T190 的Langmuir 模型拟合参数R2略高于Freundlich 模型,表明其吸附过程可能以单分子层吸附为主,吸附位点仅吸附单个分子或原子[14-15]。
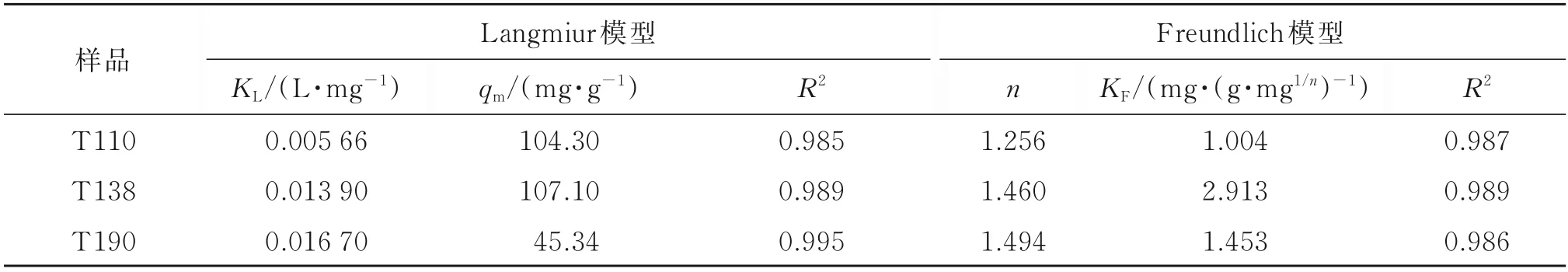
表2 氧化铁红对Sb(V)的等温吸附拟合参数Table 2 Adsorption isotherm parameters of the Sb(V)adsorption by iron oxide red
在Freundlich 模型拟合参数中,T138 具有较高的KF值,说明其表面较易吸附Sb(V)。在Langmuir模型拟合参数中,T110 与T138 对Sb(V)的最大吸附量分别为104.30 和107.10 mg·g-1,显著高于相似条件下α-Fe2O3(11.09±0.85 mg·g-1)、α-FeOOH(7.53±0.25 mg·g-1) 、β -FeOOH (7.53±0.25 mg·g-1)、γ-FeOOH(10.62±0.55 mg·g-1)以及水铁矿(17.7 mg·g-1)等铁氧化物的最大吸附量[2,16]。
T138 具有较高的Sb(V)吸附能力,可能由于其表面分布较丰富的羟基活性位点,且分布较为粗糙,有利于对溶液中Sb(V)的吸附。此外,T138 在较低和较高浓度下,均可较好地吸附Sb(V),表明其在实际应用环境中具有更高的应用潜力。表3 为3 种氧化铁红材料的BET 分析结果,3 种材料的比表面积均小于10 m2·g-1。T138 平均孔径较大,可能对其Sb(V)吸附能力有促进作用[17-18]。
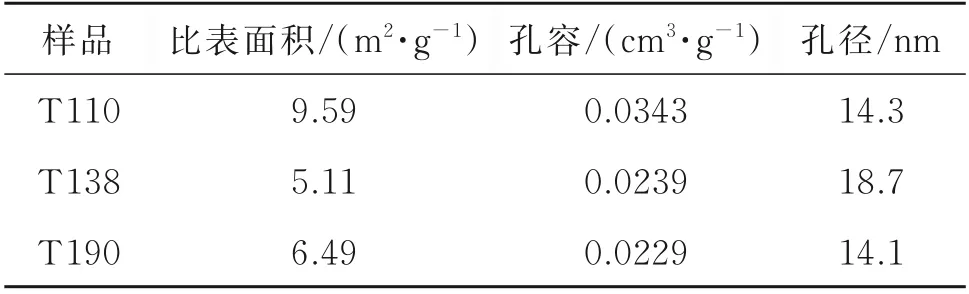
表3 氧化铁红材料的比表面积、孔容与孔径对比Table 3 the specific surface area,pore volume and aperture analysis of iron oxide red
2.7 初始pH、离子强度与共存含氧阴离子对吸附的影响
由图8 可知,在溶液pH 为4~11 时,3 种氧化铁红材料的Sb(V)吸附量均随pH 的增加而减少,且T138 的锑吸附量大于其他2 种材料。

图8 溶液初始pH 对氧化铁红的Sb(V)吸附效果的影响(温度:298 K,吸附剂投加量:0.1 g·L-1,接触时间:24 h)Fig.8 Effect of pH on Sb(V)adsorption by iron oxide red(T=298 K,adsorbents dosage=0.1 g·L-1,contact time=24 h)
在碱性条件下,3 种氧化铁红材料的Sb(V)吸附量较低,这可能与不同pH 条件下材料表面电荷变化有关。因为T110、T138 与T190 的等电荷点分别为9.56、7.68 与8.00,且Sb(V)在溶液中主要以SbO-3形式存在,当溶液pH 小于等电荷点时,材料表面电荷为正,对SbO-3具静电吸附作用,可见氧化铁红材料对Sb(V)的吸附能力相对较强。当溶液pH超过等电荷点时,材料表面电荷为负,与SbO-3相互排斥,从而阻碍了氧化铁红对Sb(V)的吸附,吸附量急剧减小。3 种氧化铁红材料的等电荷点均大于7,表明3 种氧化铁红材料在中性实际废水的除锑应用中具有一定潜力。
印染废水成分较为复杂,需进一步探究实际废水中离子浓度与共存含氧阴离子对氧化铁红材料的吸附影响,并讨论除锑机理。以NaCl 为背景电解质,在不同离子浓度下测定氧化铁红材料的Sb(V)去除率,结果如图9(a)所示。可知,3 种材料的Sb(V)去除率随离子浓度变化较小,仅在较高浓度时轻微抑制Sb(V)吸附,这可能是由于离子浓度高时吸附剂表面电荷减小,SbO-3受到斥力,有效扩散范围减小,不易被吸附在材料表面[19-20]。
本文于200 μg·L-1的中性模拟废水中添加了实际废水中常见的含氧阴离子,在系列浓度梯度下进行吸附实验。由图9(b)可知,氧化铁红的Sb(V)去除率受PO3-4、CO2-3以及SO2-4影响相对较大,其中PO3-4的抑制作用最大。在无共存含氧阴离子情况下,T110、T138 与T190 的Sb(V)去除率分别可达90.41%、99.44%与65.21%,当PO3-4浓度为0.1 mmol·L-1时,Sb(V)去除率降至10% 以下,当PO3-4浓度达1 mmol·L-1时,氧化铁红的Sb(V)去除率均降至5%以下,表明PO3-4可能与SbO-3之间具有强烈的竞争吸附作用,并与氧化铁红形成稳定配合物[21-22]。
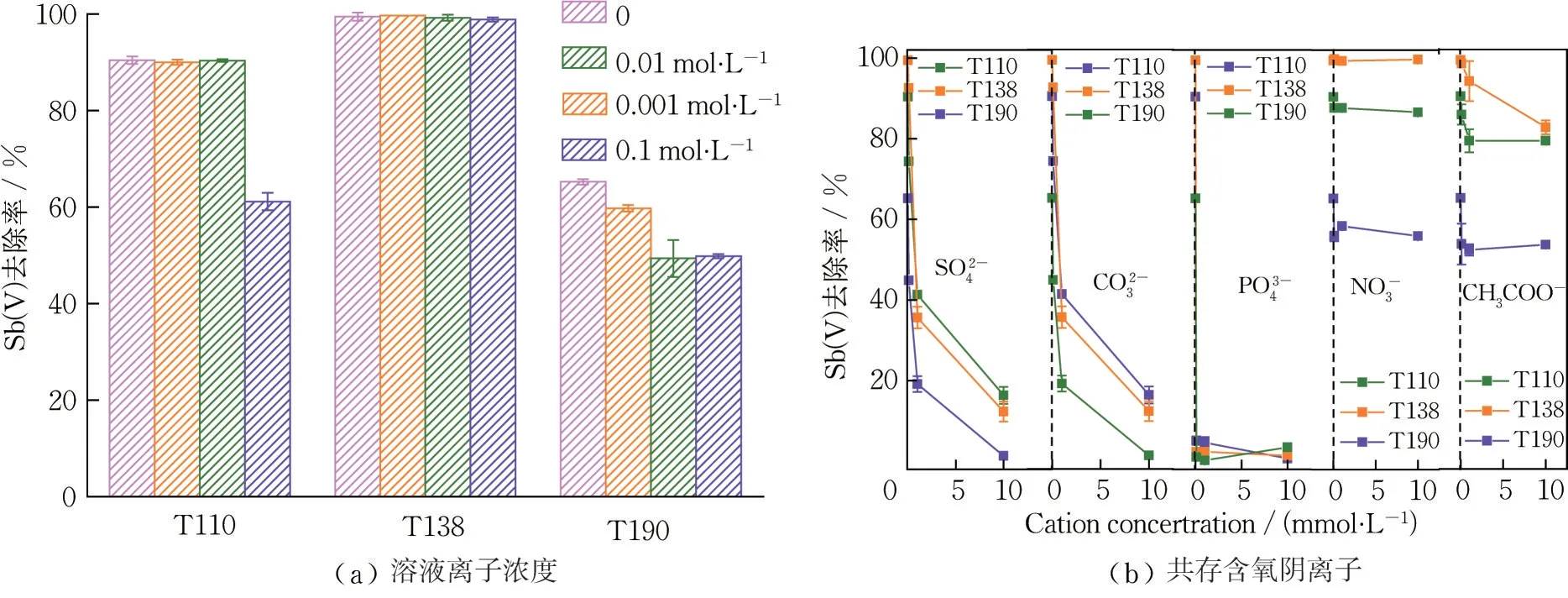
图9 溶液离子浓度与共存含氧阴离子对氧化铁红的Sb(V)吸附效果影响(温度:298 K,吸附剂投加量:0.2 g·L-1,接触时间:24 h)Fig.9 Effect of ionic strength and coexisting oxoanions on Sb(V)adsorption by iron oxide red(T=298 K,adsorbents dosage=0.2 g·L-1,contact time=24 h)
2.8 染料对吸附的影响与不同投加量对实际废水吸附效果
为探究染料对氧化铁红锑吸附性能的影响,选取印染企业的常用染料进行吸附实验。模拟废水中Sb(V)初始浓度为200 μg·L-1,在添加染料后调节初始pH 为7±0.1。
由图10 可知,分散蓝对氧化铁红的Sb(V)吸附过程影响最大,这可能与分散蓝表面存在相对较高浓度的胺基(—NH2)有关。胺基通过取代氧化铁红材料表面的羟基(—OH)位点,并与表面游离态的Fe3+产生化学配位作用,从而与SbO-3产生竞争吸附[23-24]。活性黑的胺基含量相对较小,因此对锑吸附的抑制作用小于分散蓝。3 种材料中,T138 受染料影响相对较小,具有较好的吸附选择性。
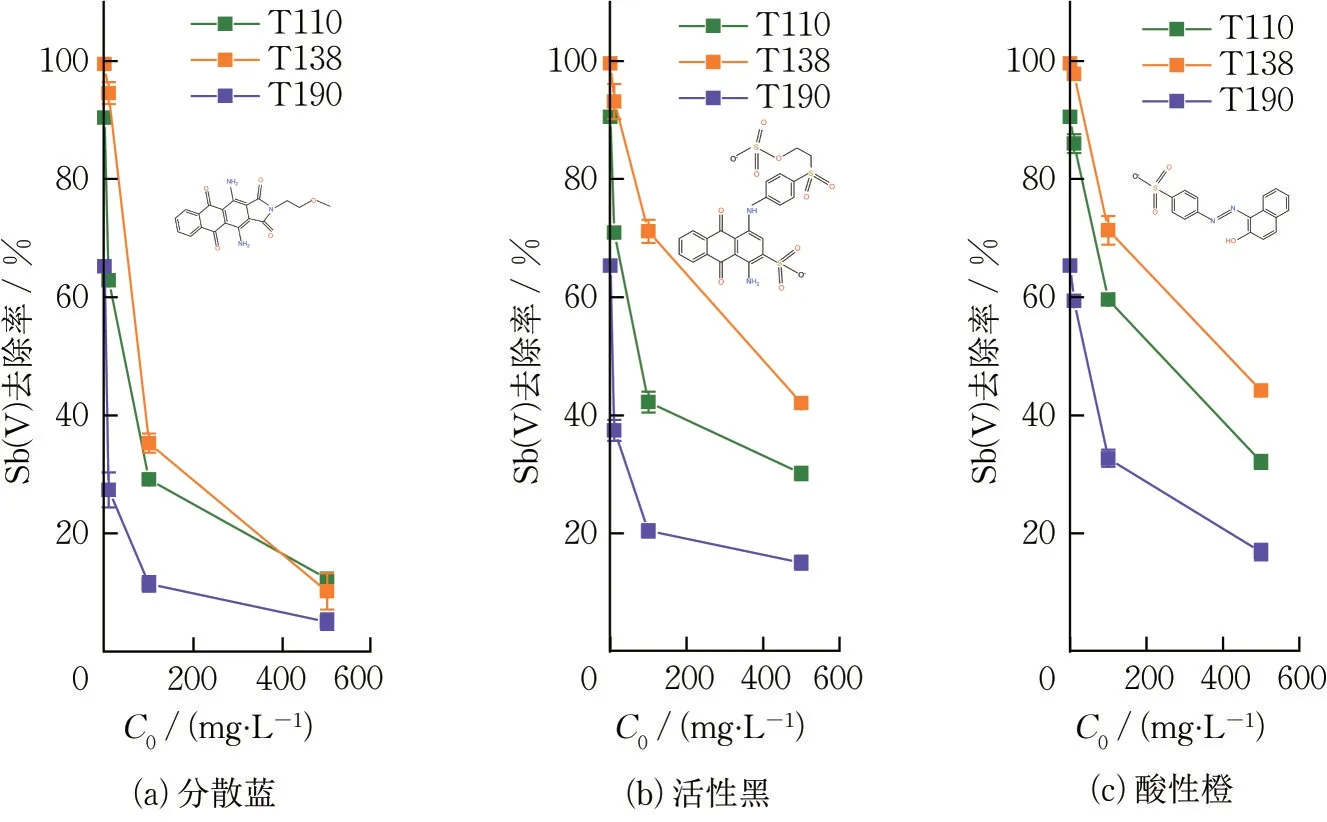
图10 各染料对氧化铁红的Sb(V)吸附效果影响(温度:298 K,吸附剂投加量:0.2 g·L-1,接触时间:24 h)Fig.10 Effect of different dyes on Sb(V)adsorption by iron oxide red(T= 298 K,adsorbents dosage =0.2 g·L-1,contact time= 24 h)
氧化铁红的投加量(0.2、0.3 与0.4 g·L-1)对实际废水的除Sb(V)实验结果如图11 所示。实际废水中Sb(V)初始浓度为198 μg·L-1,随着投加量增加,吸附后废水中剩余Sb(V)浓度逐渐减小。当氧化铁水投加量为0.2 g·L-1时,吸附后Sb(V)浓度均大于100 μg·L-1,这可能是由于实际废水成分相对复杂,其中的共存阴离子与染料等阻碍了吸附剂对锑的吸附。当投加量增至0.4 g·L-1时,T110 与T138 表现较佳,吸附后的Sb(V)出水浓度分别为90.61 与92.84 μg·L-1,Sb(V)吸附效果相似且均可满足达标排放的要求。

图11 不同投加量的氧化铁红在实际印染废水中的Sb(V)吸附效果Fig.11 The Sb(V)adsorption performance of iron oxide red with different dosing quantity in practical textile wastewater
T110 与T138 价格相近,均具有实际应用的潜力。以T110 或T138 作为吸附剂,对投加量为0.4 g·L-1时的成本进行简单初步核算后发现,每吨材料可处理约2 500 m3废水,所需成本约为2 700 元,即处理每立方米废水所需成本约为1.08 元。
2.9 吸附机理分析
观察氧化铁红材料吸附前后的FTIR 图谱(图3)发现,3 种氧化铁红材料位于1 635~1 640 cm-1处的峰均发生了一定红移。T110 由1 635.29 cm-1迁移至1 631.99 cm-1,T138 由1 634.23 cm-1迁移至1 628.42 cm-1,T190 由1 643.12 cm-1迁移至1 636.21 cm-1。由于该峰与表面吸附水中羟基变形产生的峰相对应,其位移表明,Sb(V)的吸附机理可能与材料表面的羟基相关[25]。XPS表征结果表明,氧化铁红表面存在羟基,且T138的O 1s图谱中O—H 在O 原子中的占比较T110与T190明显高(图4)。这一现象说明,T138具有更多的羟基位点,从而更易与SbO-3结合,有利于T138去除Sb(V),与T138在模拟废水中较佳的除Sb(V)表现相符。除此之外,各氧化铁红材料在吸附后的XPS 图谱中出现的Sb 3d峰,可为Sb(V)在氧化铁红表面形成的配合物提供证据[26]。HAYES 等[27]通过3 层表面络合模型构建外球络合与内球络合模型,研究离子浓度对材料吸附的影响。研究发现,内球络合模型受离子浓度影响较小,外球络合模型中的吸附效果随离子浓度的增大而显著减弱。根据本文结果,氧化铁红的Sb(V)去除率在不同离子浓度下几乎没有变化(图8(a)),表明Sb(V)可能主要以内球配合物Fe—O—Sb的形式与氧化铁红结合。此外,铁氧化物的Sb(V)吸附效果随着溶液pH 的增大而变化,直至pH 达等电荷点,Sb(V)去除率显著降低,表明存在静电吸附作用。
3 结 论
(1)在吸附剂投加量为0.2 g·L-1,吸附时间为24 h,振荡频率为130 r·min-1以及温度为25 ℃条件下,用氧化铁红对Sb(V)初始浓度为200 μg·L-1、pH 为7 的模拟印染含锑废水进行吸附实验,T138的Sb(V)去除率可达99.44%,除Sb(V)表现最佳。
(2)氧化铁红的Sb(V)吸附动力学行为相对更符合准二级动力学模型。T110 与T138 的吸附等温线较符合Freundlich 模型,T190 的拟合结果则与Langmuir 模型较符合。
(3)T110 与T138 均具较大的吸附速率常数与Sb(V)吸附容量,尤其是T138,表明其具有较好的Sb(V)吸附性能与应用潜力。T138 含还原态的铁,表面具更丰富的—OH 基团,有利于提供更多的吸附活性位点,促进对Sb(V)的吸附。
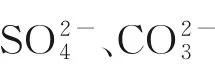
(5)在实际废水中氧化铁红的Sb(V)吸附效果减弱,可能受到了废水溶液中复杂组分的影响,其中T110 与T138 对实际废水的处理效果较好。

