不同碳氮浓度对重组胶原蛋白表达影响的研究
张发勇,宋 富,齐 磊,吴飞陶,刘 鑫,于月欣,李 华,冯 毅,邵文亮,张玮倩,徐兰举
(1.河北省药品医疗器械检验研究院,河北 石家庄 050000;2.河北纳科生物科技有限公司,河北 石家庄 050000;3.河北农业大学 食品科技学院,河北 保定 071001)
胶原被定义为含有三螺旋分子结构的细胞外基质分子[1],其是人体内含量最丰富的蛋白质,是一种被广泛应用于生物医学和生物工程的天然材料。胶原的3条多肽聚集在一起形成一个左旋卷曲的、绳索状的三重螺旋结构[2],胶原蛋白的氨基酸序列是以大量甘氨酸(约占组合物的1/3)和脯氨酸(约占组合物的1/5)为特征。甘氨酸残基是必需的,每3个氨基酸残基中,甘氨酸残基就出现1次,因为甘氨酸是唯一的1种小到可以容纳在三重螺旋中心的氨基酸[3]。这导致在所有三螺旋结构域的序列中观察到一个特征性的重复氨基酸序列(Gly-Xaa-Yaa)n[4]。对于哺乳动物来说胶原蛋白是十分重要的,因其具有多种生理调节功能,主要包括:保健作用、美容作用、免疫作用、助吸收、缓解关节疼痛、预防和治疗骨质疏松症等[5]。对胶原结构和生物学功能的研究大多是利用提取的动物胶原。比如从牛、猪和其他动物的组织中获得高纯度的Ⅰ、Ⅱ和Ⅲ型胶原[6],但是动物提取的胶原蛋白在实际应用中存在不易溯源、产量有限和加工处理复杂等诸多限制因素。为了解决这些问题,目前虽然已有较为成熟的化工合成技术,但是其技术复杂、产量少和代价昂贵,并且难以标准化。因此,大量学者在多种不同表达系统中探索,包括:微生物(大肠杆菌、酵母菌等)[7-9]、细胞培养系统(CHO细胞、COS细胞、黑腹果蝇)[10-11]、转基因动物(老鼠、蚕等)[12-13]、转基因植物(烟叶、玉米种子和水稻种子等)等[14-16]。国内外对胶原蛋白的需求量正稳步增长,重组胶原蛋白的表达量提升有利于进一步满足市场的需求。
笔者先将Ⅲ型胶原蛋白α1链的624个氨基酸序列的编码基因进行密码子优化;然后化学合成,用KpnⅠ和NdeⅠ酶切位点连接到质粒pET-30a上,转入到EscherichiacoliBL21(DE3)中获取发酵菌株,经验证确认转化成功;最后通过正交实验优化发酵用的培养基,并确定优化后培养基的表达情况,进而对得到的蛋白进行纯化和表征。
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒
菌种为EscherichiacoliBL21(DE3);重组Ⅲ型人源化胶原蛋白基因及表达质粒pET-30a由笔者实验室保藏[17]。
1.1.2 培 养 基
种子培养基(质量浓度):蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L。
发酵培养基(质量浓度):酵母粉7.5 g/L,蛋白胨15.0 g/L,甘油12.0 g/L,磷酸氢二钠17.9 g/L,磷酸二氢钾6.8 g/L,硫酸铵4.0 g/L,硫酸镁1.0 g/L,微量元素1 mL/L,氢氧化钠溶液10%调至pH 7。
补料培养基(质量浓度):酵母粉90 g/L,蛋白胨120 g/L,甘油200 g/L,硫酸镁5 g/L,维生素B1 0.5 g/L,微量元素5 mL/L。
1.2 方 法
1.2.1 摇瓶培养
将-80 ℃保藏的含重组Ⅲ型人源化胶原蛋白基因的大肠杆菌接种于含30 mL液体LB培养基中,180 r/min、37 ℃振荡培养过夜。以10%接种量转接到发酵培养基中,180 r/min、37 ℃培养2 h,加入终浓度为0.5 mmol/L的IPTG进行诱导,25 ℃培养12 h。
1.2.2 5 L发酵罐发酵
将-80 ℃保藏的实验菌株接种于含100 mL的LB液体培养基中,180 r/min、37 ℃振荡培养过夜;以10%的种子液接入300 mL LB液体培养基中,培养至OD600约为1,以10%接种量接入5 L发酵罐中,控制溶氧和pH值,37 ℃培养8~10 h后加入终浓度为0.5 mmol/L的IPTG,25 ℃培养14 h[18]。
1.2.3 正交实验设计
通过调整蛋白胨、酵母粉和甘油的质量浓度调整碳氮比例,根据蛋白胨和酵母粉的氨基氮质量浓度设计3因素4水平正交实验,根据胶原蛋白表达量情况确定最优的氮源和碳源添加浓度。
1.2.4 胶原蛋白表达量检测
在优化的最适培养条件下发酵生产胶原蛋白,每组实验进行3次重复,用SDS-PAGE检测目的蛋白,并应用BioAnaly软件与已知BSA条带进行比对分析表达量。
1.2.5 胶原蛋白纯化和表征
菌体经均质机破碎后进行离心澄清,再进行亲和层析。亲和层析之前样液进行过滤处理,除去大颗粒不溶物;亲和层析样品进行SDS-PAGE实验确定纯度收率,纯化样品进行相关表征实验。
2 结果与分析
2.1 菌株的构建
对转化成功的菌株进行菌液PCR验证。提取质粒进行单酶切和双酶切验证,酶切结果如图1所示。质粒单酶切反应符合预期结果,双酶反应获得约为2 000 bp的片段,与设计大小相同。结果表明菌株构建成功。
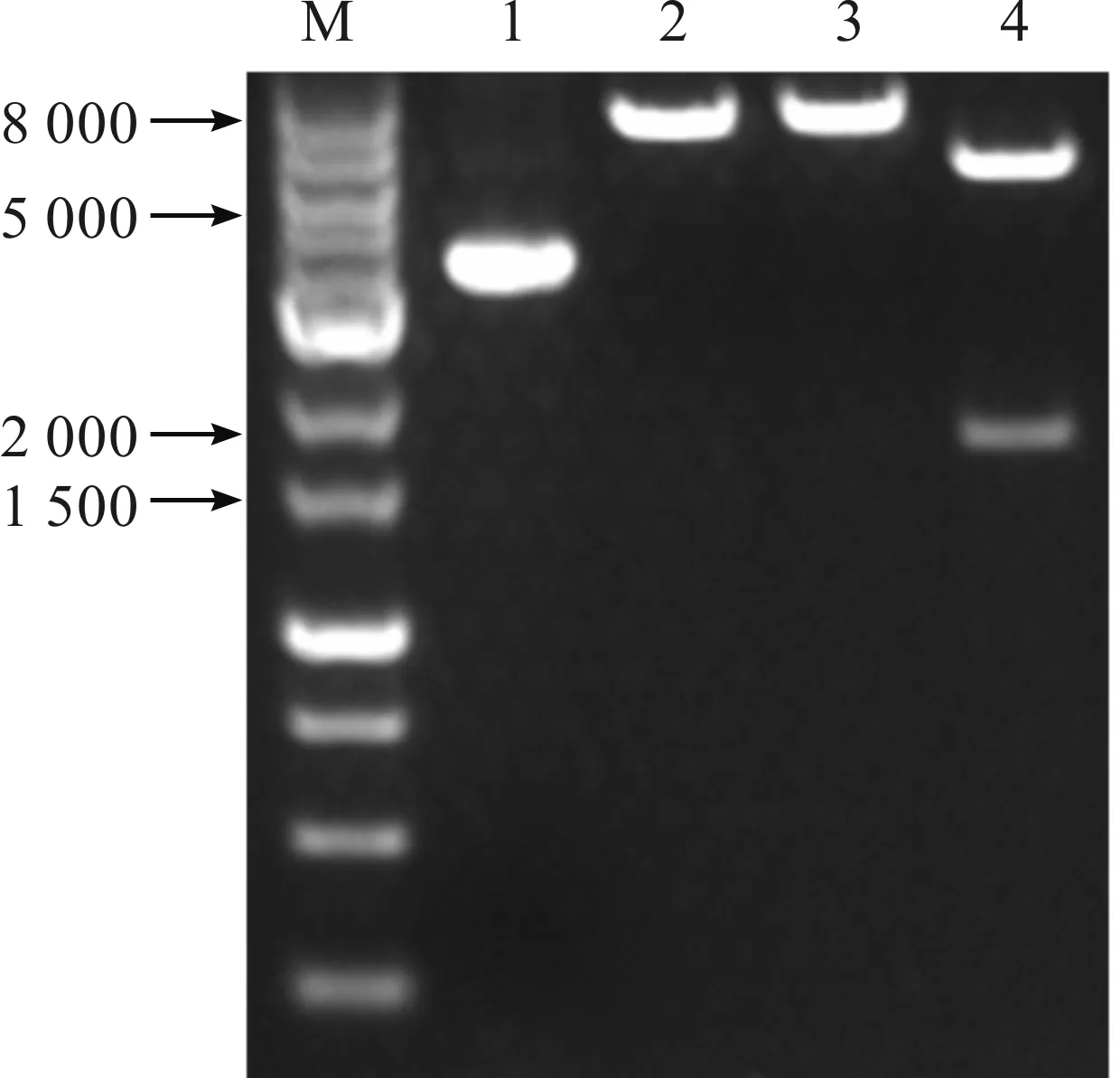
M—Maker泳道;1—构建质粒泳道;2—KpnⅠ酶酶切泳道;3—NdeⅠ酶酶切泳道;4—KpnⅠ和NdeⅠ酶双酶切泳道。图1 重组Ⅲ型人源化胶原蛋白表达载体酶切结果Fig.1 Enzyme digestion results of recombinant type Ⅲ humanized collagen expression vector
2.2 正交试验优化培养基
2.2.1 正交实验设计
在大肠杆菌培养过程中提高基碳源和氮源的浓度是培养的关键点,如果氮源浓度偏高,会导致菌体生长过于旺盛,进而造成提前衰老自溶;碳浓度偏高,细菌代谢不平衡,菌体繁殖数量少,不利于目的蛋白的积累。碳源和氮源浓度均过高会积累大量代谢抑制物,使细胞生长和外源蛋白的表达受到抑制,降低生产效率。碳源和氮源浓度过低,不利于菌体生物量的提高,难以达到较高的发酵密度。因此,优化氮源和碳源浓度以及碳氮源之间的配比,既可以满足大肠杆菌新陈代谢的需要,又可以获得高密度发酵的理想结果[19]。根据设计的实验控制因素和水平,建立一个3因素4水平的正交实验,正交实验碳氮浓度配方如表2中所示。
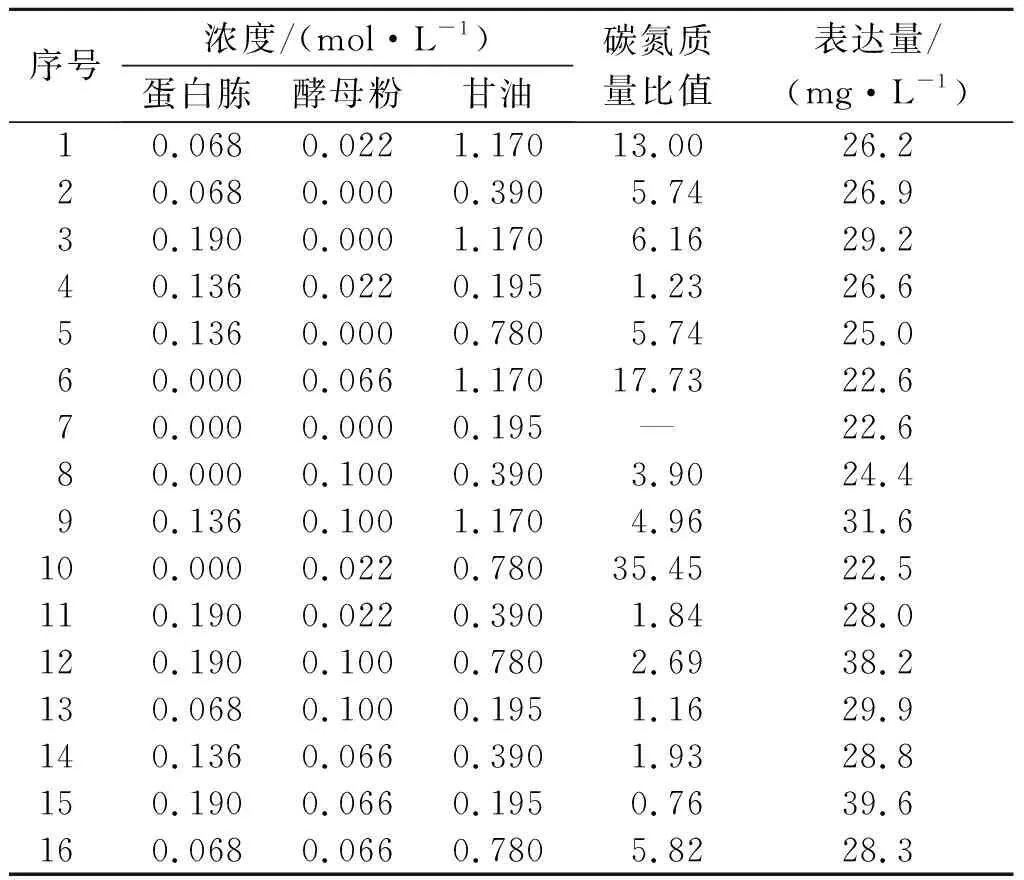
表2 正交实验培养基碳氮配方
2.2.2 正交试验结果
按照方法1.2.1节进行摇瓶发酵实验,各个实验组的菌株生长情况如图2所示。
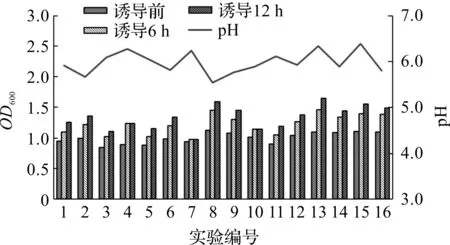
图2 正交实验配方发酵菌株增长情况Fig.2 Growth of fermentation strains in orthogonal experiment
由图2可以看出:氮源浓度较低时,菌株后期发酵能力较弱,诱导后增长较慢或几乎不增长。氮源浓度太高时菌株增长较为缓慢,配比较为适量的氮源浓度,进入诱导后期仍能提供较多的氮源和能量。
根据表2中的表达量进行方差分析(表3),可知蛋白胨和酵母粉对胶原的表达具有显著影响,碳氮源3个因素的主要影响关系依次为蛋白胨>酵母粉>甘油。通过对比每个因素的不同水平对表达量影响的平均值可以得出最佳组合:蛋白胨质量分数为2%(0.19 mol/L)、酵母粉质量分数为1.25%(0.11 mol/L)、甘油质量分数为0.6%(0.195 mol/L),m(碳)∶m(氮)=1∶1.54,此时胶原蛋白表达量占比最高约为15%。
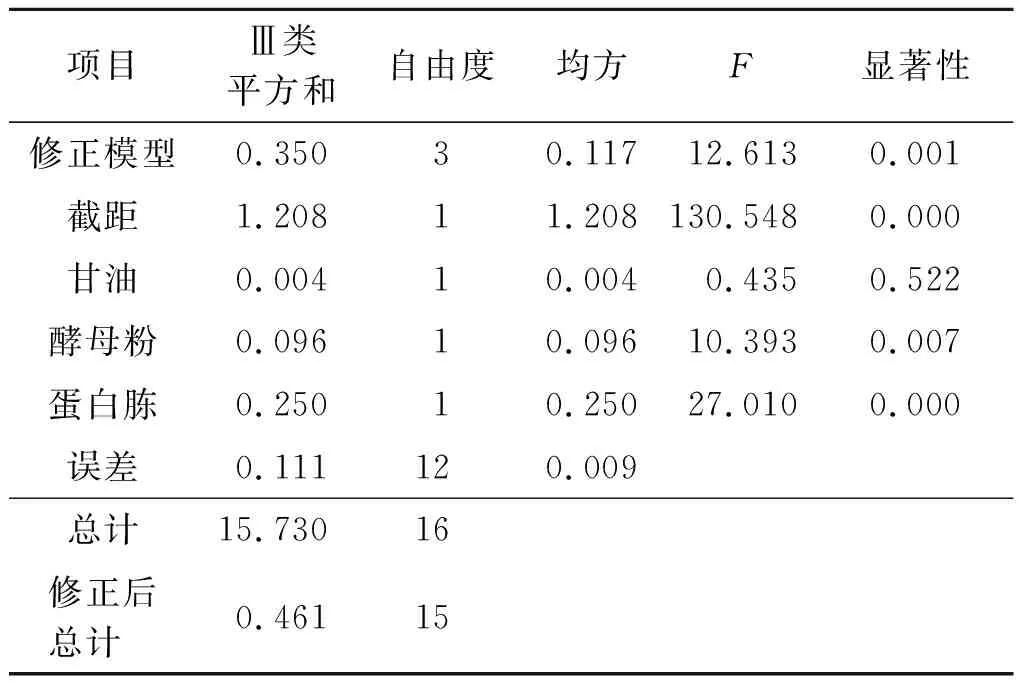
表3 实验数据方差分析
2.2.3 摇瓶发酵验证
以调整过的完全培养基为对照培养基,验证正交得到配方发酵情况,培养基成分如表4所示。根据表4中培养基配方,按照1.2.1节摇瓶发酵方法进行发酵,摇瓶发酵增长情况和表达情况如图3所示。由图3(a)可以看出:诱导12 h的OD600均低于6 h的OD600,表明该菌株诱导后期环境改变和营养物质的变化导致菌株量减少,但表达量均有不同程度的提高(图3b),其中2号培养基的表达量明显要高于其他实验组表达量,其菌株的增殖过程也较为稳定,重复进行3次实验结果基本相同。因此,正交优化培养基在摇瓶水平的表达量显著高于完全培养基和其他调整后的培养基。
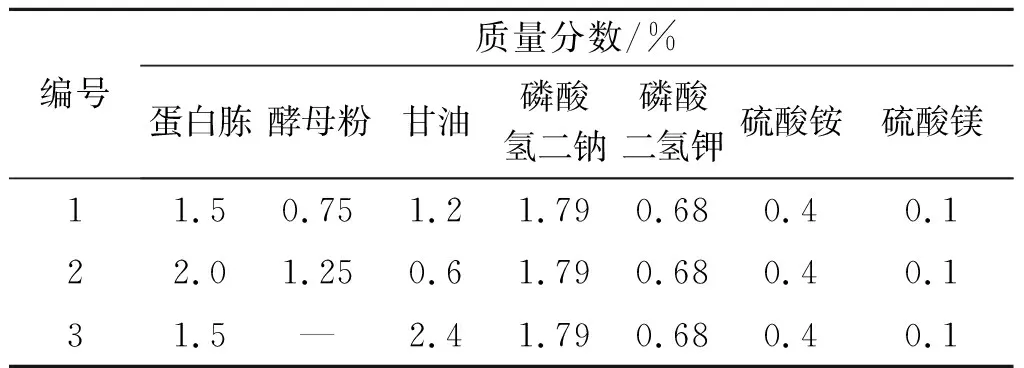
表4 验证实验培养基成分
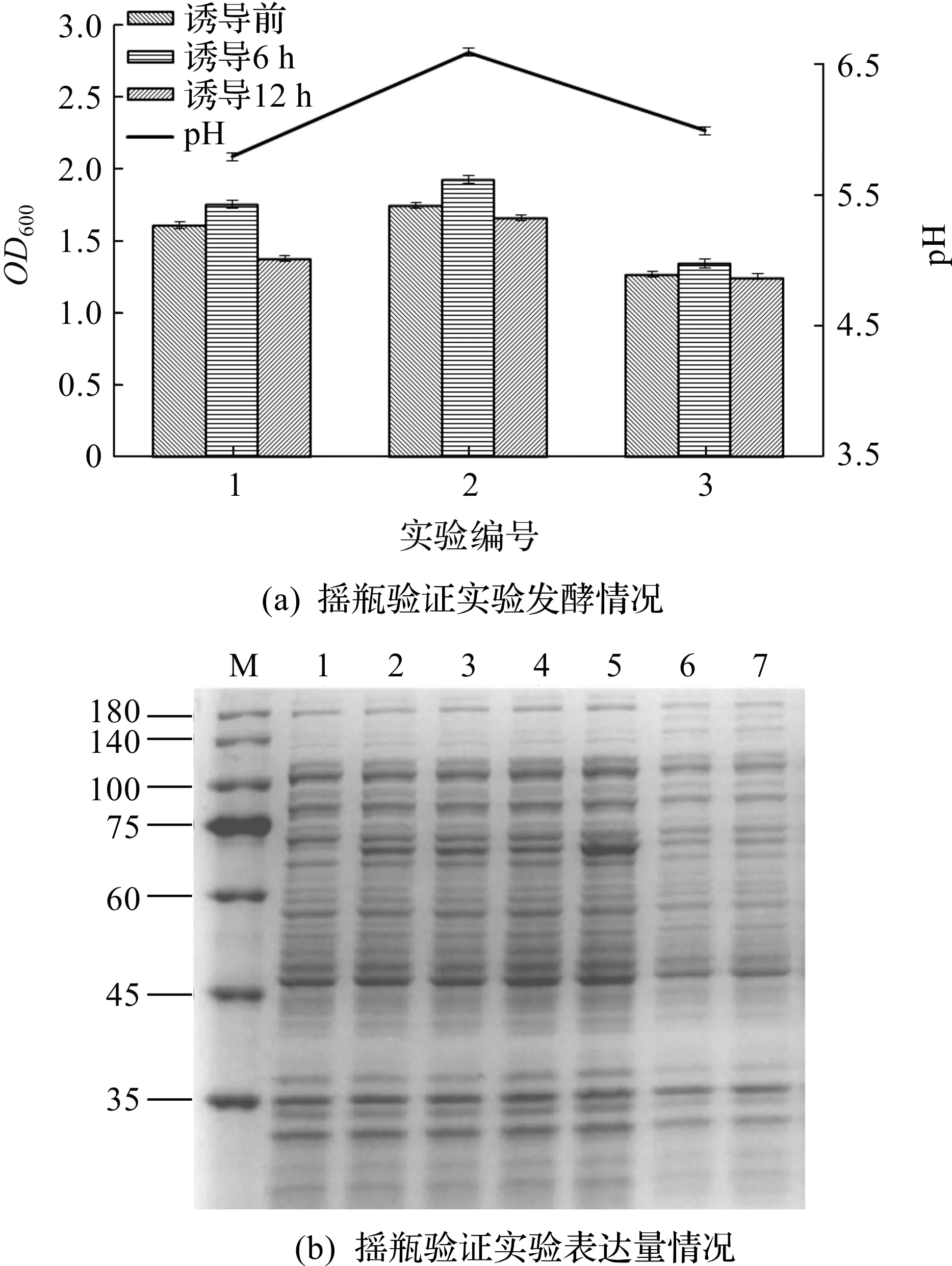
M—Maker泳道;1—诱导前样品;2—1号样品诱导6 h;3—1号样品诱导12 h;4—2号样品诱导6 h;5—2号样品 诱导12 h;6—3号样品诱导6 h;7—3号样品诱导12 h。图3 摇瓶发酵增长情况和表达情况Fig.3 Growth and expression of shake flask fermentation
2.3 5 L发酵罐发酵验证
重组蛋白表达通常会对宿主细胞带来极大的代谢负担,对细胞生理也会产生重要影响,尤其是当重组蛋白表达量有明显的提升时影响会更加显著[19]。因此,在摇瓶工艺条件得到确定以后,进行了5 L发酵罐放大实验,既可以验证碳氮比例的调整对重组Ⅲ型人源化胶原蛋白表达量的影响,又能判断较高浓度的重组Ⅲ型人源化胶原蛋白表达对宿主大肠杆菌的菌株生长的影响。
按照方法2.2.2节的发酵方法进行5 L发酵实验,比较培养基优化前后的的表达量和菌浓度差别,发酵罐发酵情况如图4所示。由图4(a,c)可以看出:优化后的培养基进行发酵时,菌株的增长速度有明显的升高,溶氧控制更为稳定,诱导后菌体的湿重较为稳定,发酵结束后菌体湿重达到了22%,增加了约120%。由图4(b,d)可以看出:相同诱导时间的表达量要明显高于优化前的表达量,通过软件分析可知优化前最终表达量为3.45 g/L,碳氮浓度比优化后的表达量增加了10.31 g/L,提高了199%。实验重复3次,结果稳定。

M—Maker泳道;1—诱导前样品;2—诱导3 h;3—诱导8 h;4—诱导11 h;5—图(b)诱导15 h,图(d)诱导14 h;6—图(b)0.5 μg BSA,图(d)10 μg BSA。图4 发酵罐发酵情况Fig.4 Fermentation in fermentor
2.4 蛋白纯化
完成发酵培养后,离心收集菌体,经高压均质机进行破碎,在温度为4 ℃,转速为7 000 r/min条件下,离心20 min收集上清液,用0.22 μm纤维滤膜过滤上清后进行蛋白纯化,经SDS-PAGE及软件分析计算出重组Ⅲ型人源化胶原蛋白纯度高于95%,收率可以达到78%(图5),冻干后样品浓度和性质与纯化样品相同。
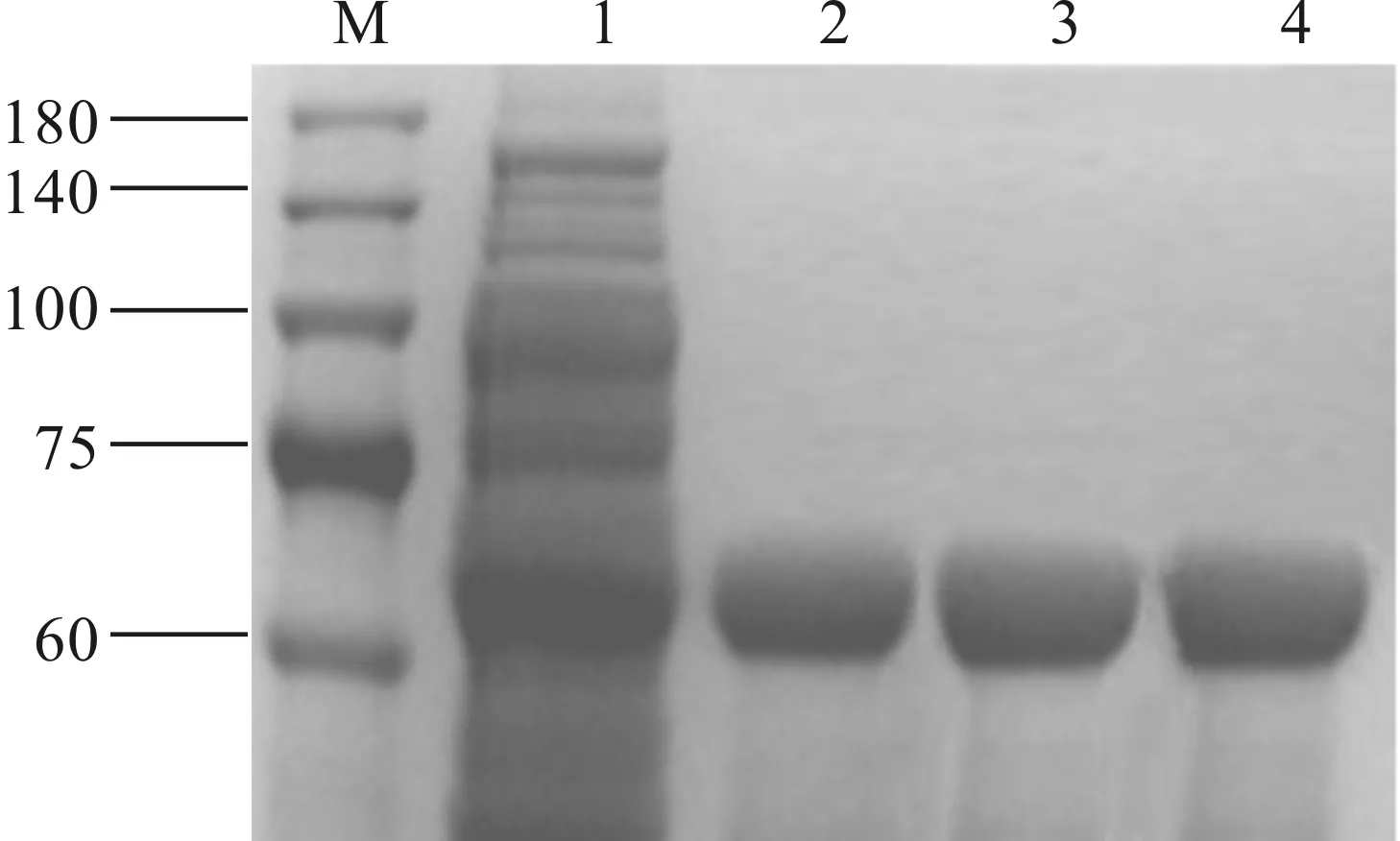
M—Maker泳道;1—纯化前样品;2,3—纯化后样品;4—冻干后样品。图5 重组胶原蛋白纯化样品SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant collagen purified samples
2.5 类人胶原蛋白的N端测序
重组Ⅲ型人源化胶原蛋白结构是最为关键的因素,N端的序列影响其整体的生物学功能。经检测重组Ⅲ型人源化胶原蛋白N端分析与预期蛋白N端序列结果一致,结果为Gly-Leu-Ala-Gly-Tyr-Pro-Gly-Pro-Ala-Gly-Pro-Pro-Gly-Pro-Pro。
2.6 分子质量和等电点检测
纯化后的样品经LC-MS/MS测定分子质量为53 kDa,与理论分子质量一致,纯化的重组Ⅲ型人源化胶原蛋白分子质量与设计序列分子质量大小无差异。毛细管等电聚焦法测定等电点为pH为9.6,根据等电点进行了纯化过程优化,提高了纯化收率。
3 结 论
以摇瓶发酵为出发点,初步确定重组Ⅲ型人源化胶原蛋白的发酵配方,通过5 L发酵罐验证配方及优化发酵工艺,菌体量提高120%,蛋白表达量提高199%。优化纯化过程目前重组Ⅲ型人源化胶原蛋白收率可以达到78%,纯度高于95%。该过程既可以为生产放大提供有效的工艺参数和基础培养基,又可以为后期碳氮补料工艺提供参考;通过优化补料中的碳源和氮源的添加比例可以进一步提高胶原蛋白的表达量。研究成果也为重组Ⅲ型人源化胶原蛋白的产业化提供了研究基础,可促进重组Ⅲ型人源化胶原蛋白在食品、医疗和美容等行业的快速发展。

