枇杷果粉对植物乳杆菌的培养特性研究
肖舒珺,吴红宇,赵广生,胡钢亮,袁海娜,肖功年
(1.浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2.杭州千岛湖康诺邦健康产品有限公司,浙江 杭州 311705;3.杭州新希望双峰乳业有限公司农业部国家乳制品加工技术研发专业中心,浙江 杭州 311100)
植物乳杆菌(Lactobacillusplantarum)是一种重要的肠道菌群微生物,对维持人类肠道微生态稳定起到非常关键的作用[1]。植物乳杆菌是一种革兰氏阳性厌氧菌,通常能够在许多发酵食品中被发现,是乳酸菌中的重要菌种[2-3],因其具有益特性,所以被选择用于益生菌发酵乳的制造。研究表明:植物乳杆菌与人们的生活有着密切联系,它可以定植于人体肠道[4],抑制肠道致病菌[5-6],对增强机体免疫力[7-8]也有重要作用。枇杷果实酸甜可口、柔软多汁,并且富含多种营养成分和活性物质[9]。目前,国内虽然有关于植物乳杆菌培养的营养特性的报道[10],但与枇杷果粉的协同作用方面的研究报道却很少。
从菌落形态差异及生长特性出发,通过单因素试验对植物乳杆菌在添加不同质量浓度枇杷果粉的MRS培养基中的生长情况进行考察,研究了不同质量浓度的枇杷果粉对植物乳杆菌生长的影响及其共生特性,为枇杷果粉的高值化利用提供数据支撑。
1 材料与方法
1.1 实验材料
菌种:植物乳杆菌(LactobacillusplantarumKCTC3104),由浙江科技学院生物与化学工程学院实验室分离并保存。
试剂:MRS肉汤,杭州百思生物技术有限公司;MRS琼脂,杭州百思生物技术有限公司;琼脂,北京奥博星生物技术有限公司;枇杷果粉:杭州千岛湖康诺邦健康产品有限公司;大豆蛋白,上海博微生物试剂有限公司;胰蛋白,上海博微生物试剂有限公司;脲,分析纯AR,国药集团化学试剂有限公司;蔗糖,分析纯AR,上海展云化工有限公司。
仪器与设备:YXQ-LS-50SⅡ立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;超净工作台,苏州苏净集团有限公司;HWS型恒温恒湿器,宁波东南仪器有限公司;FA2004N电子天平,上海菁海仪器有限公司;HH-6数显恒温水浴锅,国华电器有限公司;UV-5200PC紫外可见分光光度计,上海元析仪器有限公司。
1.2 实验方法
1.2.1 不同枇杷果粉添加量下的植物乳杆菌菌落形态
1) 菌种的活化
菌种活化参照文献[11]进行,称取MRS肉汤5.22 g溶于100 mL水中,振荡摇匀,使其完全溶解,分装到若干试管中加塞灭菌,待冷却后在超净工作台上用移液枪移取0.1 mL菌液至试管中,将接种完的试管置于35 ℃恒温培养箱中培养24 h。
2) 镜检(革兰氏染色)
取完成培养的菌种常规涂片,干燥,并固定。滴加结晶紫染液染色1~2 min,水洗。用碘液冲洗至无残液,并用碘液覆盖约1 min后水洗。用滤纸吸去载玻片上残液,并用95%乙醇脱色,至流出液无紫色时(一般用时为20~30 s),立即水洗。用番红液复染约2 min后水洗,干燥后用油镜观察,被染成蓝紫色的菌体是植物乳杆菌。
3) 培养基配制及倒平板
称取6份质量为6.4 g的MRS培养基,溶于6个装有100 mL水的锥形瓶中,用电子天平分别称取枇杷果粉添加量为0,0.5,1.0,1.5,2.0,2.5 g于锥形瓶中,分别标注为1#~6#,振荡摇匀,放入高压蒸汽灭菌锅(121 ℃)灭菌15 min。灭菌完毕后取出冷却到50 ℃,在超净工作台倒平板,待培养基冷却凝固后倒置。
表3为加入置信机制的KNN算法中的部分样例数据,#为测试样本分在该类别时样本中大于该测试样本奇异值的数量,从图1可知其值越大,置信度越大。
4) 单菌落分离实验
单菌落分离实验参照文献[12]进行,使用接种环以无菌操作沾取少许植物乳杆菌,在无菌平板表面进行平行划线,倒置培养皿于35 ℃恒温培养箱中培养,24 h后观察分离效果。
1.2.2 不同枇杷果粉添加量下的植物乳杆菌生长活力测定
1) 培养基配制
称取MRS肉汤5.22 g及琼脂质量分数为0.5%,分别称取枇杷果粉添加量为0,0.5,1.0,1.5,2.0,2.5 g于锥形瓶中,分别标注为1#~6#,溶于100 mL水中,振荡摇匀,使其完全溶解,分装到若干试管中加塞灭菌。
2) 接 种
待培养基冷却后,在超净工作台上用接种针蘸取少量活化后的植物乳杆菌并穿刺至试管中,将接种完成的试管置于35 ℃恒温培养箱中培养24 h。
1.2.3 不同枇杷果粉添加量下的植物乳杆菌生长趋势测定
1) 培养基配制
称取MRS肉汤5.22 g于100 mL水中,分别称取枇杷果粉添加量0,0.5,1.0,1.5,2.0,2.5 g于锥形瓶中,分别标注为1#~6#,溶于100 mL水中,振荡摇匀,使其完全溶解,分装到若干试管中加塞灭菌。
2) 接种和测量
用移液枪移取菌液0.1 mL于试管中,并设置对照组,接种完后以0添加量对照组对分光光度计(分光光度值A595)进行调零,然后对各浓度试管进行分光光度进行测量,每隔4 h测量1次。
1.2.4 枇杷果粉作用下不同碳氮源对植物乳杆菌生长情况的影响
1) 培养基配制
称取MRS肉汤5.22 g及枇杷果粉1.0 g于100 mL水中,并分别称取质量大豆蛋白0.5 g、胰蛋白0.5 g、脲0.5 g、蔗糖0.5 g于锥形瓶中,标号,溶于100 mL水中,振荡摇匀,使其完全溶解,分装到若干试管中加塞灭菌。
2) 接种和测量
同1.2.3方法。
2 结果与分析
2.1 植物乳杆菌在MRS固体培养基中的菌落形态
根据乳酸菌的形态学特征[13],菌落经革兰氏染色,得到蓝紫色杆菌,故鉴定为植物乳杆菌。通过划线分离法得到呈单个、成对或短链状的植物乳杆菌。菌落表面无芽孢,直径约3 mm,凸起,表面光滑,呈蓝紫色。在10×100油镜下可观察到经革兰氏染色后呈蓝紫色,结果如图1所示。
图1 植物乳杆菌革兰氏染色结果Fig.1 Gram staining results of Lactobacillus plantarum
在不同质量浓度枇杷果粉的MRS固体培养基中,对植物乳杆菌菌落的生长形态进行分析,其植物乳杆菌菌落形态如图2所示。图2中,编号1为0 g枇杷果粉添加量的MRS培养基,编号2~6分别为0.5,1.0,1.5,2.0,2.5 g枇杷果粉添加量的MRS培养基。由图2可知:枇杷果粉添加量为0.5~2.0 g时,对植物乳杆菌的生长略有抑制作用;枇杷果粉添加量为2.5 g时,对植物乳杆菌生长的影响不大。
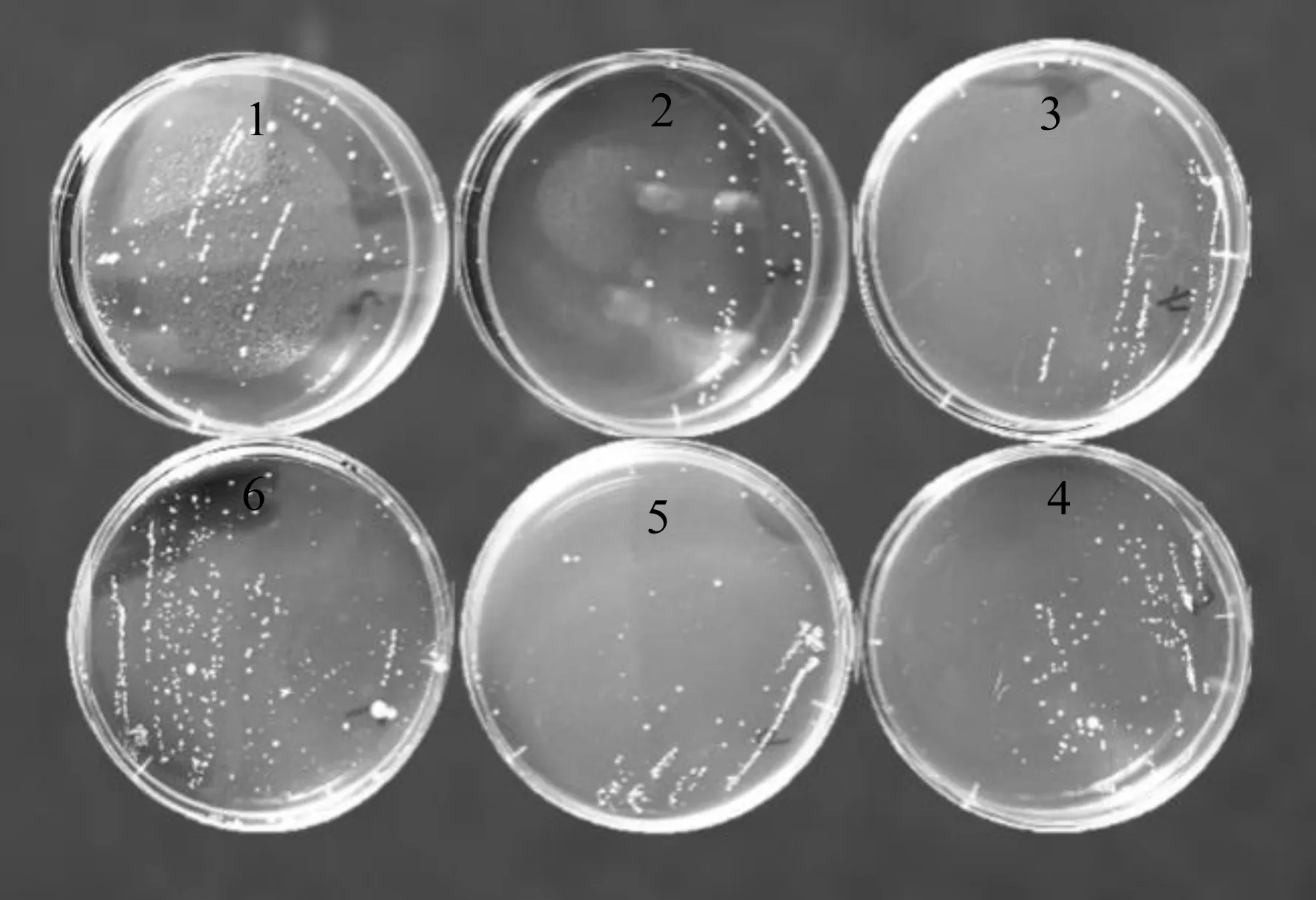
图2 不同枇杷果粉添加量下MRS培养基中 植物乳杆菌菌落形态Fig.2 Colony morphology of Lactobacillus plantarum in MRS medium with different loquat fruit powder addition
2.2 不同枇杷果粉添加量下的植物乳杆菌生长活力测定
植物乳杆菌在果粉MRS半固体培养基中,均沿穿刺路径生长,并向四周生长延伸。基于植物乳杆菌的生长情况分析如表1所示,枇杷果粉对植物乳杆菌的生长虽然略有抑制作用,但抑制作用不是很明显,与1.2.1节的实验结果相符合。
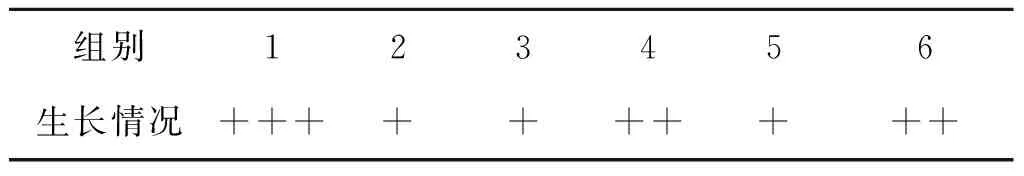
表1 植物乳杆菌在MRS半固体培养基 中的生长情况表
2. ++代表生长情况较佳。
3. +++代表生长情况良好。
2.3 不同枇杷果粉添加量下的植物乳杆菌生长趋势测定
不同质量浓度枇杷果粉对植物乳杆菌生长速度的影响实验结果如图3所示,经过一段时间的培养,植物乳杆菌的大量繁殖虽然使得MRS液体培养基变浑浊,分光光度值上升,但添加枇杷果粉组植物乳杆菌分光光度均低于未添加枇杷果粉组。
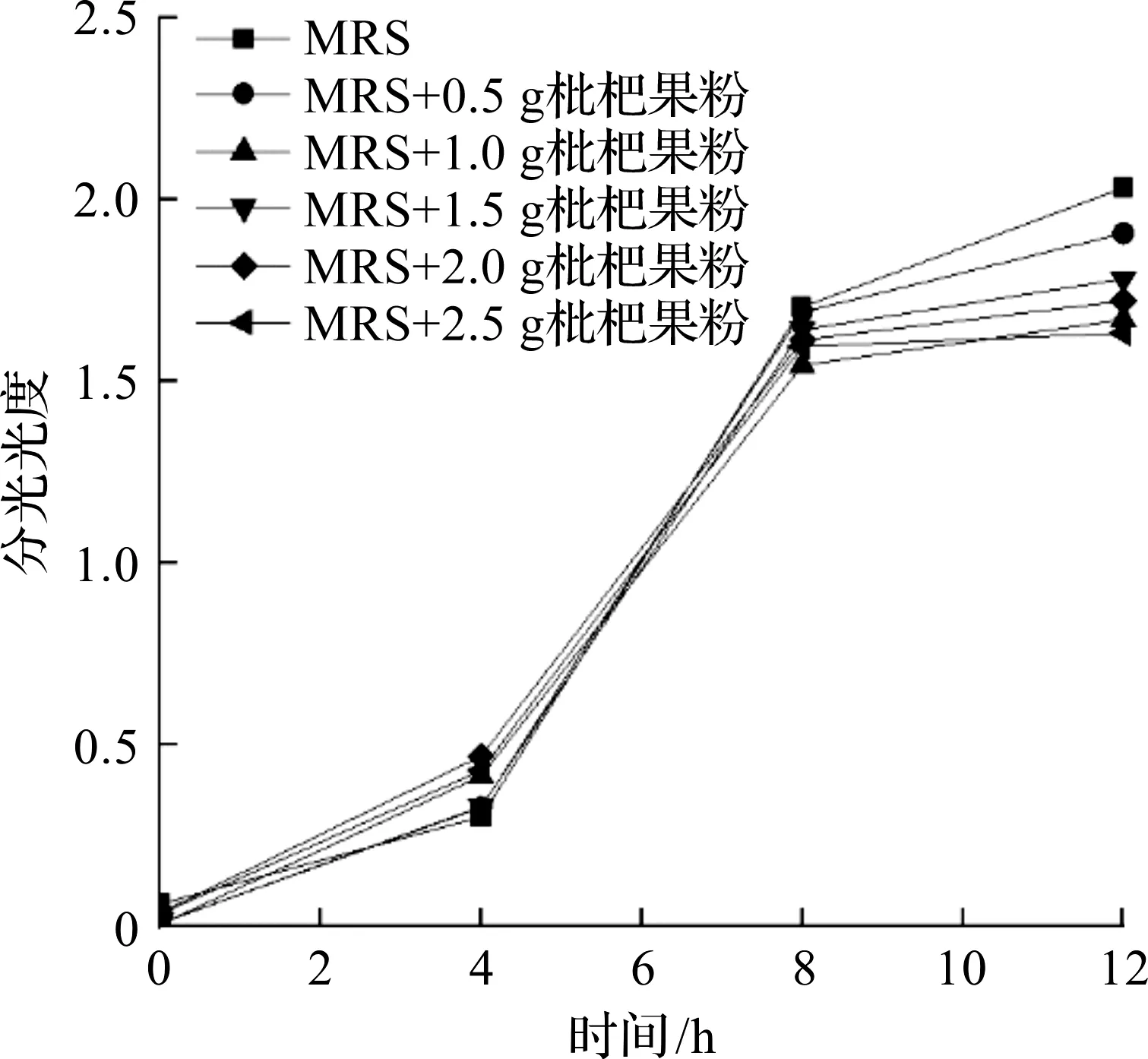
图3 不同添加量枇杷果粉对植物乳杆菌生长速度的影响Fig.3 Effect of loquat fruit powder with different dosage on growth rate of Lactobacillus plantarum
由图3可知:不同添加量枇杷果粉下植物乳杆菌的生长基本符合“J”型曲线,未添加枇杷果粉组植物乳杆菌的生长情况明显好于添加枇杷果粉组,且枇杷果粉的添加使得植物乳杆菌生长受到不同程度的抑制;枇杷果粉对植物乳杆菌在0~12 h内的生长略有抑制作用,且6~12 h枇杷果粉对植物乳杆菌生长的抑制作用较为明显,与1.2.1,1.2.2节的实验结果基本吻合。
2.4 枇杷果粉作用下不同碳氮源对植物乳杆菌生长情况的影响
枇杷果粉作用下不同碳源和氮源对植物乳杆菌在MRS液体培养基中生长情况的影响如图4所示。不同碳源和氮源对植物乳杆菌生长情况的影响不同,与单纯的MRS液体培养基相比,由于MRS液体培养基加了大豆蛋白、胰蛋白、脲和蔗糖,植物乳杆菌的生长情况均较好。
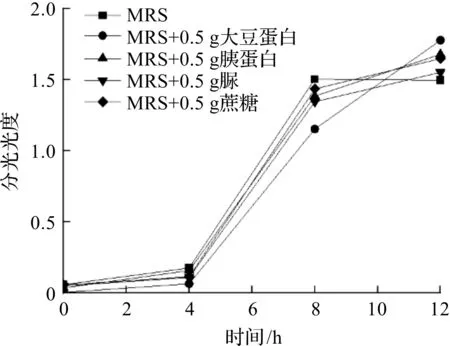
图4 不同碳氮源对植物乳杆菌生长速度的影响Fig.4 Effect of different carbon and nitrogen sources on growth rate of Lactobacillus plantarum
从图4中可以看出:枇杷果粉作用下不同碳源和氮源对植物乳杆菌在MRS液体培养基中生长情况基本符合“J”型曲线,其中大豆蛋白对植物乳杆菌的生长有较好的促进作用,能够显著促进植物乳杆菌生长;胰蛋白对植物乳杆菌的生长也起到一定的促进作用;单一的脲和蔗糖对植物乳杆菌的生长并未有明显的促进作用。
3 结 论
从菌落形态差异及生长特性出发,研究了添加不同质量浓度枇杷果粉的MRS培养基中的植物乳杆菌生长情况及趋势,以及在枇杷果粉作用下不同碳源、氮源对MRS液体培养基中植物乳杆菌生长情况的影响。结果表明:在0~12 h,枇杷果粉对植物乳杆菌的生长略有抑制作用,在6~12 h,枇杷果粉对植物乳杆菌生长的抑制作用较为明显;大豆蛋白对植物乳杆菌的生长情况有较为明显的促进作用;胰蛋白对植物乳杆菌的生长促进作用略次于大豆蛋白,而单一的脲和蔗糖对植物乳杆菌生长并无明显促进作用。根据枇杷果粉在不同应用中的需求,还需要对益生特性的优势方面作更深一步的探究,以求发挥其最大作用。

