自身抗体与熊去氧胆酸治疗原发性胆汁性胆管炎生化应答的关系探讨
黄桂芳,杨晋辉
昆明医科大学第二附属医院消化内科,昆明 650000
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种自身免疫介导的慢性进行性肝内胆汁淤积性疾病[1],主要病理表现为慢性非化脓性胆管炎及肝内小叶间胆管被破坏。PBC可进一步发展为肝纤维化、肝硬化及相关并发症,甚至进展为肝衰竭、肝癌,严重影响患者的生活质量,增高病死率。据统计,PBC的人群年患病率为(1.9~40.2)/10万,年发病率为(0.3~5.8)/10万[2]。
PBC的免疫学特征是特异性的线粒体抗原、核抗原及着丝粒抗原的自身抗体[3-5],其中抗线粒体抗体(AMA)是检测PBC敏感度、特异度均较高的免疫标志物,PBC患者的AMA阳性率为95%[3]。部分特异性抗核抗体(ANA)对PBC的诊断特异度高,与疾病的进展及预后有关[6]。目前,熊去氧胆酸(ursodeoxycholic acid,UDCA)是国际上公认的治疗PBC的一线药物,指南推荐的最佳治疗剂量为13~15 mg/(kg·d),但约40%的患者对UDCA应答不佳[7]。国外曾有研究表明,针对难治性PBC患者,大剂量UDCA的治疗效果较好[8]。但目前国内外采用>15 mg/(kg.d)或<13 mg/(kg.d) UDCA治疗PBC的研究甚少。有研究表明,抗gp210、抗sp100、抗着丝点抗体等特异性ANA与PBC的病情严重程度及预后不良有关[9-10],但针对自身抗体与不同剂量UDCA治疗生化应答之间关系的研究尚少。本研究探讨了自身抗体与不同剂量UDCA应答之间的关系,以期早期发现难治性PBC人群并对其及时实施治疗。
1 资料与方法
1.1 一般资料 选择2013年1月-2020年8月昆明医科大学第二附属医院消化内科收治的PBC患者122例,其中男14例,女108例。纳入标准:(1)符合2009年美国肝病学会颁布的PBC诊断标准;(2)基线碱性磷酸酶(ALP)大于正常上限的1.5倍;(3)既往无UDCA口服史,从基线日起开始口服UDCA,此后持续定期治疗1年;(4)有完整基线资料及随访数据。排除标准:(1)合并其他胆道系统梗阻性疾病、原发性胆汁性胆管炎/自身免疫性肝炎(PBC/AIH)重叠综合征、慢性乙型及丙型肝炎病毒感染、非酒精性脂肪性肝炎及酒精性肝病;(2)肝衰竭或其他自身免疫性疾病;(3)UDCA治疗随访期间使用类固醇或免疫抑制药物;(4)有严重的心、脑、肺、肾相关疾病;(5)妊娠。本研究方案通过医院伦理委员会审批(批号审-PJ-2020-110),所纳入患者均签署知情同意书。
1.2 研究方法 查阅病历收集受试者UDCA治疗前及治疗1年后的一般资料、生化免疫指标及病理资料。指南推荐UDCA治疗的最佳剂量为13~15 mg/(kg.d)[2],该剂量对顽固性PBC患者的疗效欠佳,本院针对病情重、病理晚期的患者予>15 mg/(kg.d)的UDCA(商品名:优思弗)治疗,病情轻的患者予标准剂量或小于标准剂量的UDCA治疗。据此将本组122例患者分为>15 mg/(kg.d) UDCA组(n=71)与≤15 mg/(kg.d) UDCA组(n=51)。比较两组患者的基线资料,分析不同剂量UDCA治疗对PBC患者生化及免疫指标的影响,并研究抗体分型及病理分期与不同剂量UDCA治疗应答的关系。UDCA治疗生化应答的评判标准为:UDCA治疗1年后ALP水平≤3ULN(正常值上限),AST水平≤2ULN,总胆红素水平≤17.1 μmol/L。
1.3 指标检测 患者空腹8~12 h于次日清晨抽取静脉血,采用全自动生化分析仪检测白蛋白(ALB)、前白蛋白(PAB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、ALP、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、总胆汁酸(TBA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血钙、白细胞(WBC)、血小板(PLT)、红细胞分布宽度变异系数(RDW-CV)、红细胞分布宽度标准差(RDW-SD)及免疫球蛋白M(IgM)水平;ELISA法检测血清抗线粒体抗体Ⅱ型(AMA-M2)、抗ANA、抗gp210、抗sp100、抗干燥综合征抗原A(SSA)、抗干燥综合征抗原B(SSB)、抗Ro-52、抗着丝点抗体。
1.4 统计学处理 应用SPSS 25.0软件对数据进行分析。符合正态分布的计量资料以±s表示,两组间比较采用t检验,治疗前后比较采用配对t检验;非正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用Mann-WhitneyU检验,治疗前后比较采用配对Wilcoxon检验;计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法检验,治疗前后比较采用McNemar's检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基线资料比较 >15 mg/(kg.d) UDCA组患者BMI、ALB、PAB均低于≤15 mg/(kg.d)UDCA组,而AST、ALP、GGT、TBA、TBIL、RDW-CV、RDW-SD、IgM、抗gp210阳性率、AMA-M2阳性率均高于≤15 mg/(kg.d)UDCA组,差异有统计学意义(P<0.05)。进行肝穿刺活检者共72例,其中>15 mg/(kg.d) UDCA组的病理分期以Ⅲ、Ⅳ期为主,而≤15 mg/(kg.d) UDCA组以Ⅰ、Ⅱ期为主(表1)。
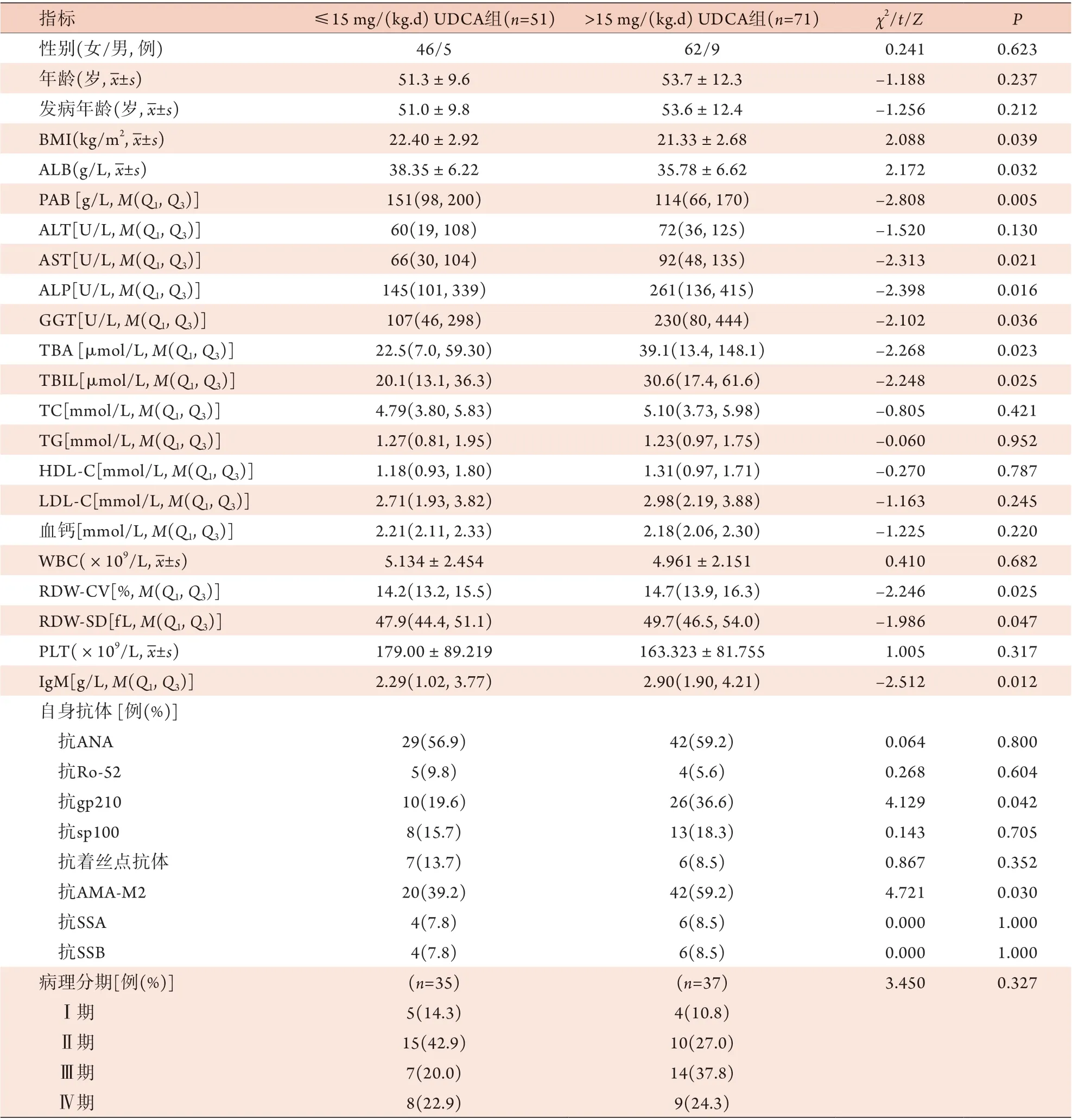
表1 两组PBC患者基线资料比较Tab.1 Comparison of baseline data between PBC patients treated by UDCA with different dosage
2.2 不同剂量UDCA治疗对生化及免疫指标的影响 >15 mg/(kg.d) UDCA组71例患者治疗1年后,PAB较治疗前显著升高,ALT、AST、ALP、GGT、TBIL、IgM、ANA阳性率较治疗前显著下降,差异有统计学意义(P<0.05);≤15 mg/(kg.d) UDCA组51例患者治疗1年后,PAB较治疗前显著升高,ALP、GGT、AMA-M2阳性率较治疗前显著下降,差异有统计学意义(P<0.05,表2)。
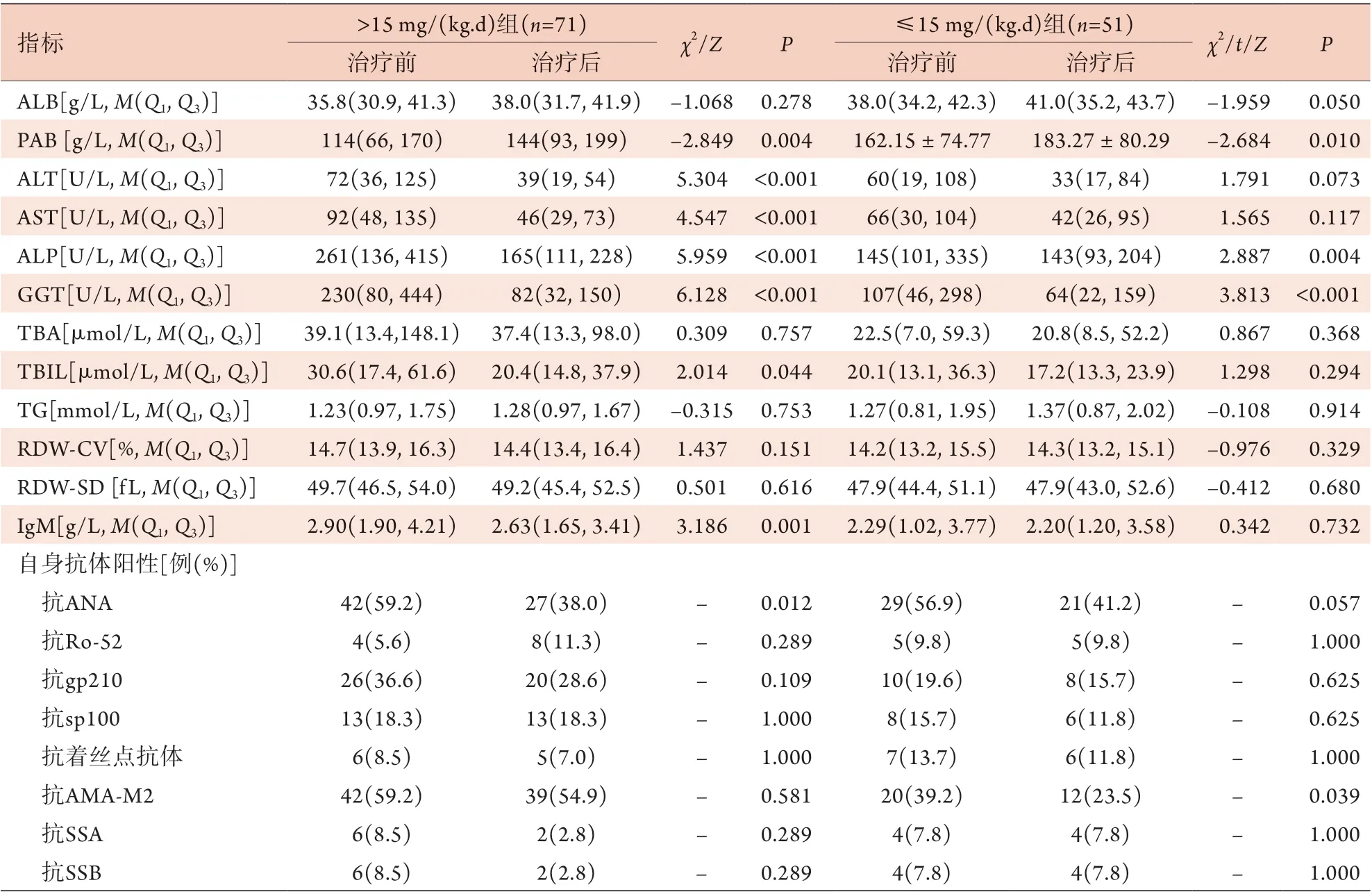
表2 不同剂量UDCA治疗对PBC患者生化及免疫指标的影响Tab.2 Comparison of biochemical immune indexes in PBC patients before and after treatment with different UDCA dosage
2.3 抗体分型与不同剂量UDCA治疗应答的关系
>15 mg/(kg.d) UDCA组71例患者中,有应答者24例(应答组),无应答者47例(无应答组),应答组的抗SSA阳性比例高于无应答组,差异有统计学意义(P<0.05)。≤15 mg/(kg.d) UDCA组51例患者中,有应答者23例(应答组),无应答者28例(无应答组),两组自身抗体阳性比例差异无统计学意义(P>0.05,表3)。
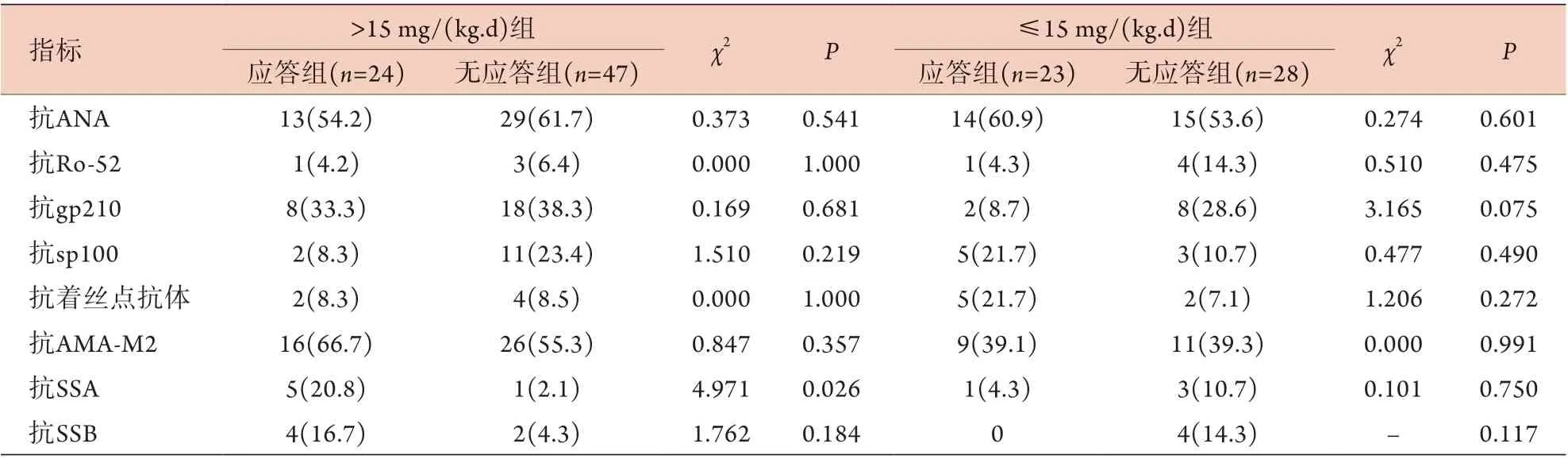
表3 PBC患者抗体分型与不同剂量UDCA治疗应答的关系[例(%)]Tab.3 Comparison of autoantibodies in PBC patients treated by different dosage of UDCA [n(%)]
2.4 病理分期与不同剂量UDCA治疗应答的关系
>15 mg/(kg.d)UDCA组71例患者中,应答组与无应答组的病理分期差异无统计学意义(P>0.05)。≤15 mg/(kg.d) UDCA组51例患者中,应答组病理分期Ⅱ期比例高于无应答组,差异有统计学意义(P<0.05,表4)。
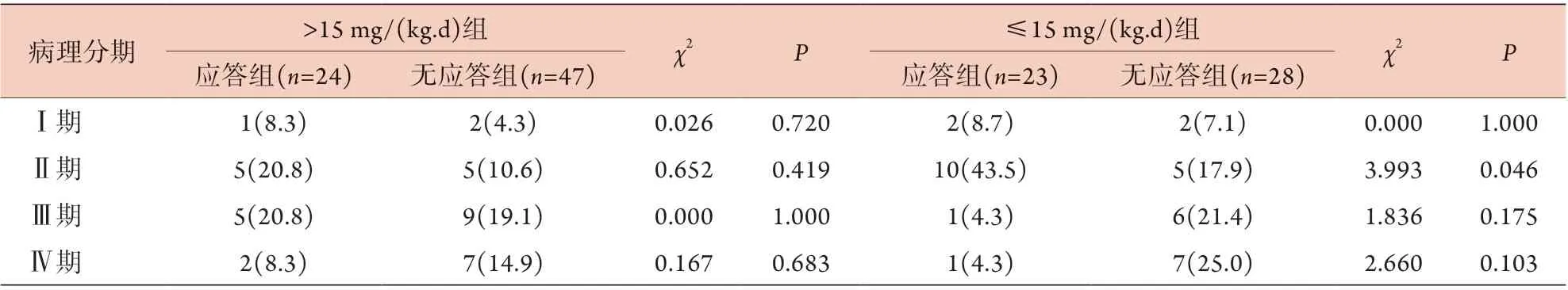
表4 PBC患者病理分期与不同剂量UDCA治疗应答的关系[例(%)]Tab.4 Pathological stage distribution of patients treated by different dosage of UDCA [n(%)]
3 讨 论
随着环境、遗传因素的改变,PBC的发病率逐渐升高,约40%的PBC患者对UDCA治疗应答欠佳,因此难治性PBC的早发现、早治疗对于延缓疾病进展及延长生存期尤为重要。有数据表明,部分PBC自身抗体与疾病的严重程度相关,可能是预后不良的标志[11]。本研究旨在探讨PBC自身抗体与不同剂量UDCA治疗生化应答之间的关系,以期通过基线抗体分型来评估UDCA的疗效。
本研究结果表明,基线抗SSA阳性与>15 mg/(kg.d) UDCA治疗的生化应答有关,可能作为评估>15 mg/(kg.d) UDCA治疗应答有效的指标;病理分期Ⅱ期与≤15 mg/(kg.d) UDCA治疗应答有效有关。大小剂量UDCA均可改善PBC的生化及免疫指标,但从占比来看,>15 mg/(kg.d) UDCA组的病理分期主要以Ⅲ、Ⅳ期为主,而≤15 mg/(kg.d)UDCA组以Ⅰ、Ⅱ期为主。这些数据可能表明无论UDCA剂量的大小均可改善PBC患者体液免疫及生化反应,但对病情重、病理分期晚期的患者,建议使用>15 mg/(kg.d) UDCA治疗。基线抗SSA阳性、病理分期Ⅱ期在评估不同剂量UDCA对PBC患者的治疗效果中起重要作用。
抗SSA抗体是机体免疫应答发生紊乱、免疫系统针对自体细胞内小核糖核酸蛋白发生免疫反应产生的免疫球蛋白,常见于干燥综合征,也可见于系统性红斑狼疮、原发性胆汁性肝硬化,还可见于药物性肝损害、病毒性肝炎等非自身免疫性疾病[12]。既往有学者认为PBC合并其他自身免疫性疾病是UDCA应答不佳的一个重要因素,其中抗SSA抗体与干燥综合征密切相关,但本研究纳入的PBC患者均未合并其他自身免疫疾病。Granito等[13]研究表明,抗SSA抗体阳性PBC患者的TBIL及IgM水平更高,抗SSA抗体可识别出PBC患者晚期的活动性疾病,提示其可能与疾病的预后较差有关。但本研究显示基线抗SSA阳性的PBC患者对UDCA治疗应答良好,对于存在这种差异的原因最可能的解释是:(1)PBC患者选择的差异性:不同区域的患者可能存在个体、地区的差异性,且Granito等[13]的研究发现抗SSA抗体阳性率为2.8%,明显低于本研究抗SSA抗体的阳性率(8.2%);(2)不同的抗体检测技术灵敏度存在一定的差异;(3)样本量不充足,Granito等[13]研究样本量(105例)低于本研究(122例)。有研究表明,基线抗gp210及抗sp100阳性与UDCA应答之间无明显相关性[14],与本研究结果一致。从占比来看,本研究发现不同剂量无应答组的gp210阳性率数值高于应答组,与辛克锋等[15]的研究一致,因此对gp210阳性者需提高警惕,必要时早期可按难治性PBC行二线治疗。
国外研究表明,基线肝组织学结果可用作临床研究的替代终点来确定接受二线治疗的个体[16]。本研究发现病理分期Ⅱ期与≤15 mg/(kg.d) UDCA组的应答情况有关,提示UDCA的治疗应答与PBC的病理分期相关,原因可能是由于Ⅱ期患者处于胆管增生期,临床症状轻,UDCA治疗可减轻汇管区周围的炎症坏死,并使胆管增生得到改善,但病理分期与>15 mg/(kg.d) UDCA组的治疗应答无关,因此建议针对病理分期早期的患者使用≤15 mg/(kg.d)UDCA治疗。Namisaki等[17]研究发现,UDCA治疗反应欠佳与PBC患者的不良预后相关。本研究因资料不全,未对病理分期与预后的关系进行分析。
目前,关于PBC相关自身抗体在疾病临床过程中的变化研究甚少。有研究表明,抗gp210滴度下降甚至转阴与UDCA反应改善有关[6,14];本研究也证实自身抗体阳性率在随访期间出现下降,>15 mg/(kg.d) UDCA组治疗1年后,抗ANA阳性率显著下降,而≤15 mg/(kg.d) UDCA组治疗1年后,抗AMA-M2阳性率显著下降,与Tang等[18]的研究一致,考虑与UDCA的免疫调节、抑制肝内自身免疫反应有关。
目前治疗PBC的药物主要有UDCA、奥贝胆酸等法尼酯X受体(FXR)激动剂,非诺贝特等过氧化物酶体增殖物激活受体α(PPARα)激动剂,成纤维细胞生长因子-19类似物,布地奈德,跨膜G蛋白偶联受体5激活剂及生物制剂等[19-20]。UDCA是PBC的一线治疗药物,但约40%的患者对其应答欠佳,而对于UDCA应答欠佳的患者是否需要继续服用UDCA治疗,仍是值得探讨的话题。有研究表明,对UDCA治疗应答欠佳患者的生存率明显高于未经UDCA治疗的患者,因此,无论对UDCA的反应如何,PBC患者均应长期维持UDCA治疗[21-22]。对于UDCA应答不佳或不耐受的患者,奥贝胆酸及非诺贝特可作为二线治疗药物,经奥贝胆酸治疗的患者可能出现可逆的血脂水平改变[23],而且奥贝胆酸对UDCA应答不足的PBC患者疗效较好,已被美国食品药品管理局批准为PBC治疗的二线药物,主要用于对UDCA应答欠佳的成人PBC,即在奥贝胆酸治疗基础上联用UDCA治疗,或用于对UDCA不良反应严重难以接受的成人PBC单药治疗。在UDCA联用奥贝胆酸或非诺贝特疗效不佳时,可三者联用,能更有效地改善生化反应;对于早期应答不佳的患者,应密切监测。
鉴于本研究时间较短,目前尚无法提供关于大剂量UDCA治疗安全性的有效信息,但众所周知,UDCA经口服后进入肠道可被结肠菌群转化为7-脱氧产物(LCA)。LCA是一种动物肝毒素,可在肝脏中被有效地硫酸化,并迅速从肠肝循环中消除。一项来自意大利的研究发现,在服用常规剂量[13~15 mg/(kg.d)] UDCA的患者中,LCA没有明显累积,在服用30 mg/(kg.d) UDCA的患者中也没有观察到LCA,且其唯一不良反应是仅1例PBC患者出现轻度腹泻,这表明即使对于大剂量[30 mg/(kg.d)]UDCA,PBC患者也有良好的耐受性[24]。基于上述研究结果,目前还没有充分理由说明使用大剂量UDCA是不安全的。
综上所述,基线抗S S A 阳性的P B C 患者对>15 mg/(kg.d) UDCA治疗应答良好,而病理分期Ⅱ期的PBC患者对≤15 mg/(kg.d) UDCA治疗应答良好,它们可能分别作为评估>15 mg/(kg.d) UDCA与≤15 mg/(kg.d) UDCA治疗应答有效的指标,有助于难治性PBC的早期识别,并及时进行二线治疗,从而延缓疾病进展。大小剂量UDCA均能改善PBC的生化及免疫指标,但对于病情重、病理分期晚期的患者建议使用大剂量UDCA治疗。

