经颅直流电刺激干预下脑卒中患者的脑网络研究
郑威,于洪丽,王春方,李建波
1. 天津医科大学朱宪彝纪念医院 设备科,天津 300134;2. 河北工业大学 省部共建电工装备可靠性与智能化国家重点实验室,天津 300130;3. 天津市人民医院 康复医学科,天津 300121
引言
脑卒中是我国发病率较高的疾病,患者运动功能恢复的缓慢和困难对其日常生活和工作极其不利[1-2]。Bobath技术、Brunnstrom技术、Rood技术及PNF技术等训练方法是治疗脑卒中疾病的传统康复方法,其对下肢功能的恢复具有积极作用,而对上肢效果较差,因此探究一种新的并且有效的康复治疗方法具有重要临床意义。经颅直流电刺激(Transcranial Direct Current Stimulation,tDCS)作为一种非侵入性的神经调控技术被认为是神经康复领域中一项非常有前途的方法[3-4]。tDCS具有较高的安全性,可对大脑多个功能区进行调节,增加大脑的可塑性变化,进而促进脑卒中后运动功能的恢复[5-6]。Lefebvre等[7]探讨了tDCS联合运动技能训练得出其对慢性脑卒中患者感觉运动皮层的功能网络具有积极的改善作用。Allman等[8]在一个为期9 d的运动训练中引入tDCS技术,结果改善了脑卒中患者的临床治疗效果。尽管有证据显示tDCS可以调节脑卒中患者大脑功能区,对运动皮层进行刺激以促进患者运动功能的恢复,但仍有许多问题没有得到解决,如tDCS确切的临床疗效主要是通过临床量表进行评定,缺少结合神经电生理等相应的技术方法,深入分析其作用机理,为评定患者康复情况提供依据。因此,基于脑电(Electroencephalogram,EEG)的tDCS对脑卒中疾病的疗效及机理研究具有重要的应用前景。
为了解决上述问题,本文结合脑卒中患者的EEG数据采集实验,通过EEG信号的偏定向相干性(Partial Directed Coherence,PDC)分析,构建不同受损部位患者tDCS刺激前、中、后的脑网络。通过对不同状态下脑网络对比和大脑网络拓扑特性的定量分析表明,tDCS对脑卒中疾病治疗效果具有积极作用。
1 材料与方法
1.1 被试的选择
本研究与天津市人民医院康复医学科合作,选择21例脑卒中患者(天津市人民医院康复医学科患者)作为被试者(17例男性,4例女性),均为右利手,其中10例为左侧半球受损,11例为右侧半球受损,患者知情实验内容且同意参与实验。被试入选标准:① 被试首次患病,且符合2005年《中国脑血管病防治指南》诊断标准,经CT或MRI确诊为单侧半球缺血性脑卒中患者;② 被试意识清醒,无认知障碍,可以配合完成本项研究;③ 被试病情稳定,且患病时间小于4个月(均处于发病后的前6个月上肢和手功能康复黄金期)。被试排除标准:① 有精神类疾病或病史;② 有癫痫病、脑外伤疾病或者器质性脑损伤病史;③ 有电休克疗法治疗史。
左侧患者平均年龄(57.6±6.6)岁,患病时间为(52.1±7.9)d,左侧患者男性7例;右侧患者平均年龄(56.7±6.7)岁,患病时间为(50.6±7.6)d,左侧患者男性10例;对被试在年龄、性别、患病时间的基本情况进行ANOVA检验,结果表明,差异均无统计学意义(P>0.05)。(其中一名被试年龄82岁,患病时间达102 d未进行统计学分析)。
1.2 实验设备及实验参数的选择
实验采用德国Neuroconn公司生产的型号为DCSTIMULATOR PLUS电刺激仪,选取tDCS模式将阳极电极放置于脑卒中患者的患侧初级感觉运动区(Primary Motor Cortex,M1),将阴极电极放置于对侧脑区。实验选用表面积为2.6 cm×2.6 cm的电极片,设置0.2 mA的电流强度,目的是减小刺激电极对EEG信号采集的干扰。EEG信号测量仪采用Neuracle公司生产的32导无线EEG采集系统,采集被试tDCS前(静息态)、中、后的EEG信号。图1为实验设计流程图,图2为实验数据采集示意图。实验采用5 min交替闭眼、睁眼的设计,tDCS刺激时间为20 min。为减小电流后效应[9-10],患者在完成tDCS实验后休息10 min,除休息时间外,全程采集患者的EEG数据。

图1 实验流程图

图2 实验数据采集示意图
1.3 EEG数据的采集及预处理
被试在实验数据采集时保持放松无肢体动作。EEG采集场所为弱光暗室、安静、无人员打扰和电磁干扰。采集EEG时电极阻抗小于10 kΩ,以CPZ作为参考电极,记录32导头皮EEG信号,实验数据的采样频率为250 Hz。
数据预处理部分主要包含匹配电极、去坏电极、滤波(0.5~40 Hz)、重参考(改为平均参考)、使用独立成分分析去除干扰信号、去伪迹等,该过程通过Matlab软件eeglab工具包完成。
1.4 处理方法
1.4.1 PDC
PDC是格兰杰因果用于计算时间序列在频域上的多变量自回归方法。归一化的PDCxj→xk值在[0,1]之间,表示xj流向xk的信号占所有从xj流出信号的比例,接近0说明两通道之间无联系,大于0.1则两通道间有联系[11]。以10 s为单位分析21名被试在闭眼状态下tDCS前、中、后全频段60 s的EEG数据,计算6个10 s PDC的平均值作为该状态下每名被试的PDC值。具体研究算法如下。
对于多通道AR模型,其表示式如式(1)所示。

式中,
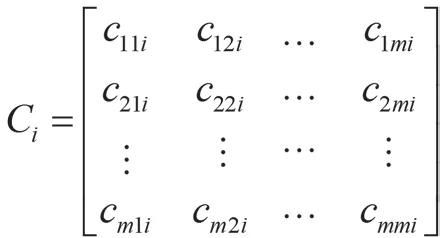
所处理数据为32导联EEG信号,即32个通道,对应m=32,获得32导联EEG数据时域AR模型之后,再对式(1)进行傅里叶变换,得式(2)~ (3)。

式中,I表示维数为m=32的单位矩阵。xj→xk的PDC可定义为式(4)。
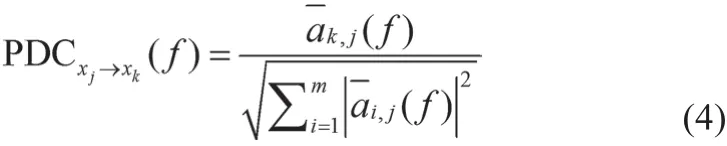
1.4.2 脑功能网络的构建
本研究通过计算32节点间PDC值,建立不同受损部位不同状态下脑卒中患者的有向加权脑网络。对于生成的网络,应用以下4个拓扑参数进行定量的描述。
(1)节点度。本研究构建有向网络图,故分为入度和出度,入度为此节点流入边的数量,出度为此节点流出边的数量。
(2)集群系数。表示所构建网络的集团化程度。节点i的集群系数Ci表示和节点i实际相连的节点数值ei与其可能相连的节点最大数值[ki(ki-1)/2]的比值,具体计算公式如式(5)所示。

整个网络的集群系数为所有节点集群系数均值,见式(6)。

(3)中介中心度。用来表征网络节点的作用和地位,其数值越大表示节点在网络中的枢纽作用越强,是该网络的核心节点,具体计算公式如式(7)所示。

式中,σjk为节点j到节点k所有最短路径的数值,σjk(i)为节点j到节点k的最短路径中通过节点i的数值。
(4)网络效率。表示为网络的信息传输能力,分为全局效率和局部效率。全局效率计算公式如式(8)所示。

式中,N为节点,lij为节点i和j之间的最短路径长度。局部效率计算公式如式(9)所示。

其中,E(Vi) 的计算公式如式(10)所示。
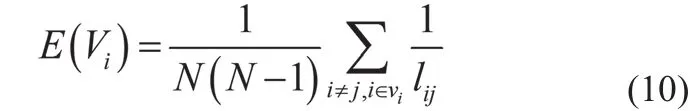
式中,Vi表示节点i的邻居节点组成的子图。
为了确定不同受损部位不同状态下患者的平均脑网络,并将其转化为有向二值脑网络进行分析,采用如下方法进行:对计算所得PDC值设定不同的阈值μ0(μmin≤ μ0≤ μmax),其中,最小值 μmin取 0.1,最大值 μmax取节点个数N(32)的自然对数3.46,在取值区间内μ0的递增量为0.05[12]。本研究选取μ0=0.28为阈值。
利用单尾单样本t检验,假设样本均值为μ,提出零假设,有H0:μ≤μ0,H1:μ≤μ0。μ0为设定的PDC阈值,检验统计量如式(11)所示。

若t落在拒绝域,即拒绝原假设,说明两导联间的连接强度大于阈值μ0,即对应脑网络中两节点间有连接;反之,则说明两节点间无连接,以此来构建脑网络。
运用配对t检验方法分析tDCS刺激前、中、后等3种状态下计算所得参数是否具有显著性差异;由于节点出度不满足正态分布,进行符号秩和检验。
2 结果
为减小个体差异性对实验结果的影响,本文分别计算闭眼状态下10例左侧半球受损、11例右侧半球受损tDCS前、中、后预处理EEG数据平均值,以自身作为对照组,用以探究基于EEG的tDCS对脑卒中患者的脑机制是否发生变化。计算32导联间PDC值,得到两两导联的因果关系和信息流向情况,三种状态下脑网络的连接变化如图3~4所示。从图中可以看出,左、右侧半球受损患者在三种状态下入度均呈现分布较均匀,而出度则不明显。

图3 左侧半球受损患者不同状态下脑网络图

图4 右侧半球受损患者不同状态下脑网络图
2.1 度分布
入度代表信息流入某节点的情况。由图5可以得出,左、右侧半球受损患者节点入度较均匀地分布在32个节点,在tDCS前、中、后基本呈现先增长后减小,但刺激后的值大于刺激前,对节点入度进行两两配对t检验,表1结果显示均具有显著性差异(P<0.05)。
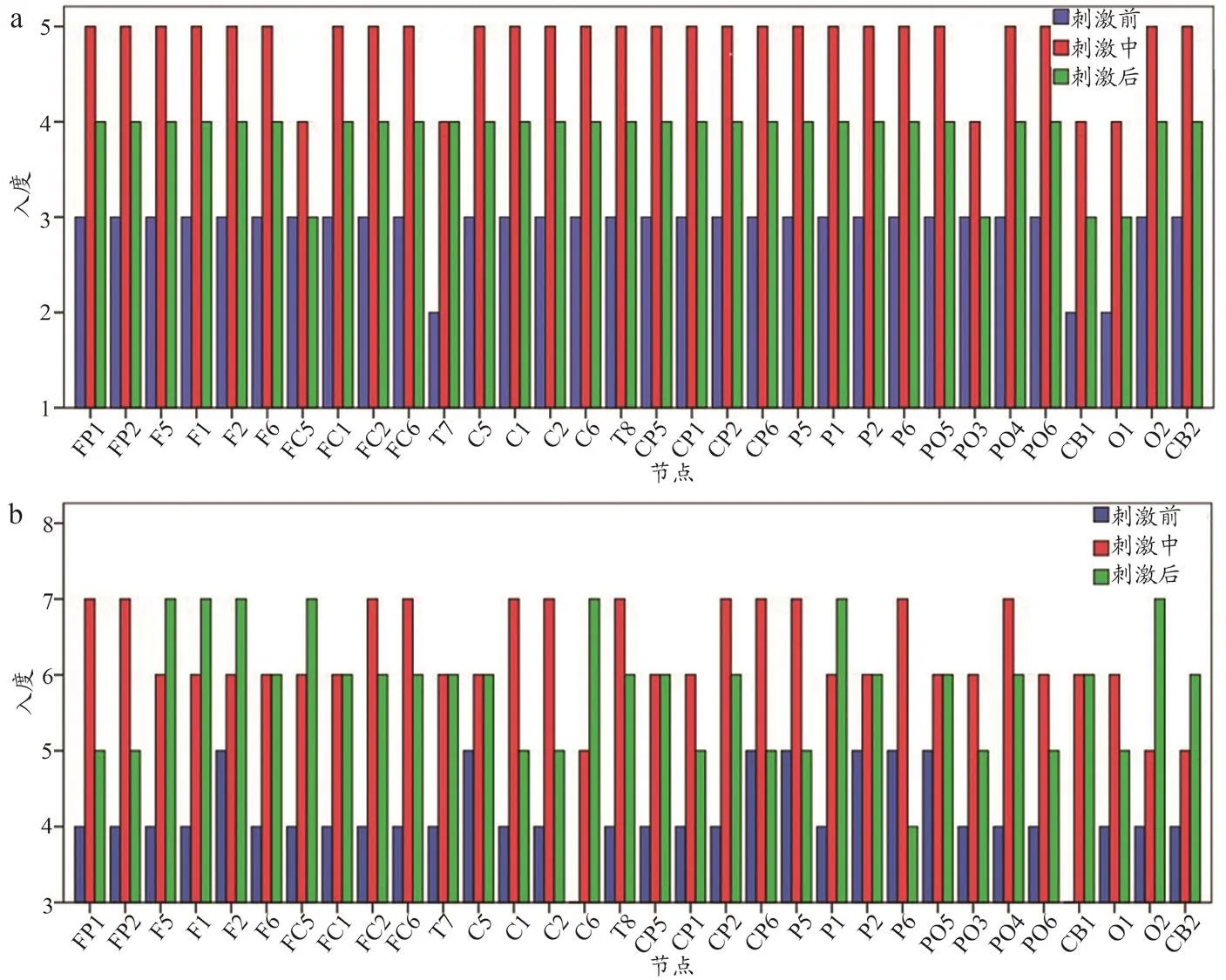
图5 脑网络节点入度
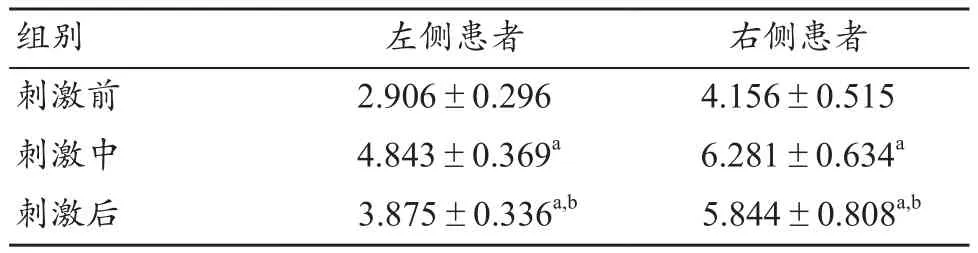
表1 节点入度统计结果
出度代表信息流出某节点的情况。由图6可以得出,节点出度只存在于某些节点且这些有值节点大多与其他节点都有连接。左侧半球受损患者在位于左半球的FC5、T7、PO3、CB1、O1节点有值;右侧半球受损患者在13个节点有值,相对自身刺激前对照组,刺激后在左额叶(F5)、中央区(C6)、枕叶(O2)有所减小,而顶区(P5、P2、P6、PO5、PO3)有所增加,由于节点出度不满足正态分布,进行符号秩和检验,显示均无显著性差异(P>0.05)。
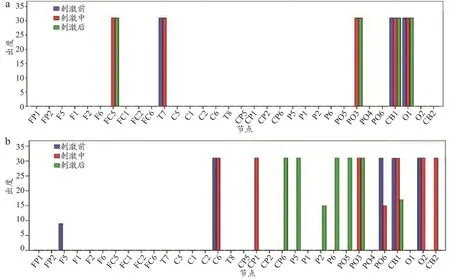
图6 脑网络节点出度
2.2 集群系数
集群系数与集团化程度和信息传输效率成正比。左侧半球受损患者在三种状态下平均集群系数分别为0.0968、0.1613、0.1290,呈现刺激中最高,刺激中及刺激后相对刺激前分别增加66.63%和33.26%。右侧半球受损患者平均集群系数分别为0.1341、0.2025、0.1826,同样呈现刺激中最高,刺激中及刺激后相对刺激前分别增加51.01%和36.17%。表2为集群系数统计结果,两组患者在三种状态下的集群系数均具有显著性差异(P<0.05)。结果表明,tDCS刺激后左侧和右侧半球受损患者脑网络集团化程度均增加,网络信息传输效率均提高。

表2 集群系数统计结果
2.3 中介中心度
表3为不同受损部位在不同状态下中介中心度有值节点。左侧半球受损患者的中介中心度在刺激前有3个节点有值,均为0.6,说明此状态下的枢纽节点集中分布在上述3个节点;在刺激中有5个节点有值,均为0.43;在刺激后有4个节点有值,均为0.54,相比刺激前和刺激中,网络枢纽节点的个数分别增大1.3倍和减少0.8倍。右侧半球受损患者在刺激前有2个节点有值,均为0.5;在刺激中有3个节点有值,均为0.33;在刺激后有6个节点有值,其中 CP6(0.2)、P5(0.16)、P2(0.07)、PO5(0.36)、PO3(0.16)、CB1(0.07),相比于刺激前和刺激中状态,刺激后枢纽结点个数分别增大3倍和2倍,分布更加分散。由此得出,tDCS干预下网络节点的地位出现变化,枢纽节点分散且存在转移情况,枢纽节点的核心地位降低。
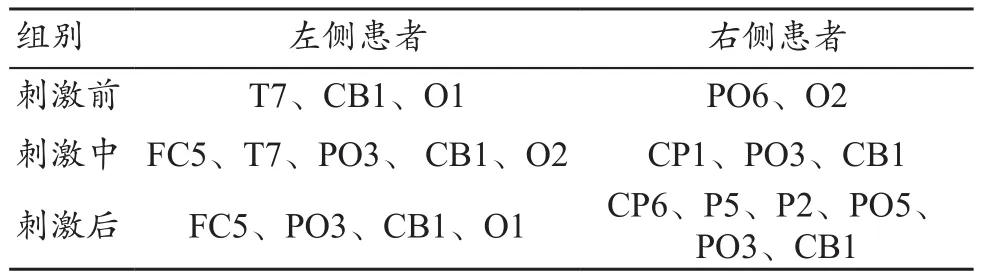
表3 不同受损部位在不同状态下中介中心度有值节点
2.4 网络效率
被试在三种状态下脑功能网络的全局效率和局部效率对比结果如图7所示。左、右侧半球受损患者的全局效率和局部效率在刺激前、中、后均呈现先增大后减小的趋势,且刺激后比刺激前明显增加。图7a中,单一半球受损状态下,刺激后的整体呈现水平比刺激中降低但高于刺激前,且对比分析刺激前、中、后的两侧半球受损情况,发现右侧半球受损的全局效率都要高于左侧。图7b中,左侧半球受损状态与上述结果相同;但右侧半球受损状态下,刺激后的局部效率远高于刺激前,并与刺激中基本持平。由表4可以得出,左侧半球受损患者的全局效率和局部效率在三种状态下均具有显著性差异(P<0.05);右侧半球受损患者的全局效率和局部效率在刺激中和刺激后的t检验均无显著性差异(P>0.05)。
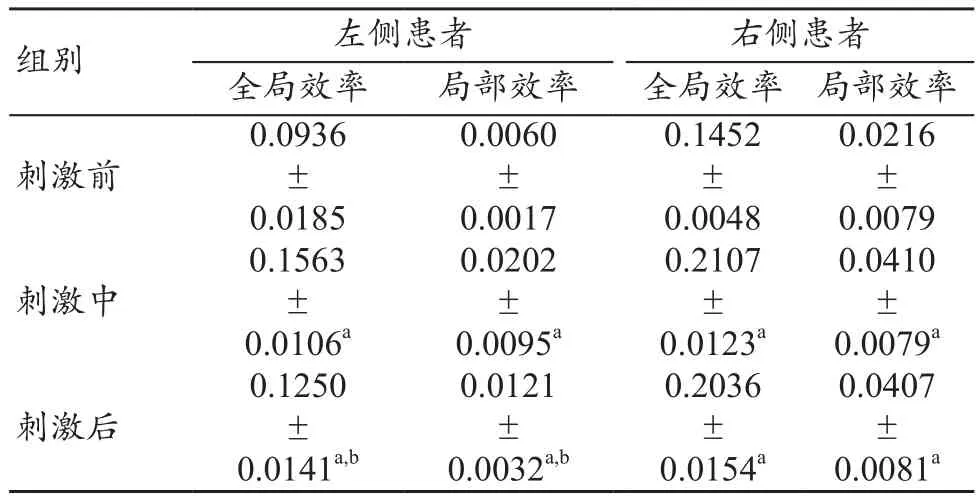
表4 网络效率统计结果
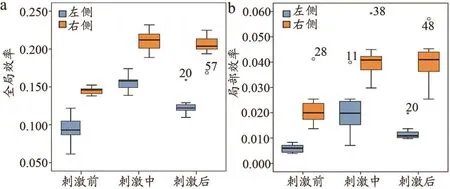
图7 大脑不同受损部位在不同状态下全局效率和局部效率的箱线图
3 讨论
本研究运用PDC和有向传递函数方法对脑卒中患者的EEG信号构建脑网络及大脑有效连接模型,并对不同受损部位患者tDCS刺激前、中、后的脑网络特性和有效连接强度进行了对比分析,以探究tDCS干预下脑卒中患者的脑连接变化及tDCS对该疾病的治疗效果和作用机制。
研究发现,不同受损部位患者基于EEG的tDCS刺激M1区在刺激前、中、后3种状态下所构建的脑功能网络存在不同,分析其网络拓扑参数发现,节点入度相对节点出度均呈现均匀分布的特点,且节点入度在tDCS刺激前、中、后均先增加后降低,这说明tDCS可以提高各节点的信息传输[12]。Hordacre等[13]研究卒中后患者接受tDCS是否改变脑功能网络连接性,结果显示脑连通性增强。部分学者利用tDCS刺激卒中后失语症患者的M1区,结果改善了患者脑功能的整体正常化,增加了网络内部通信[14-16],这与本结果相一致。出度体现信息流出情况,左侧半球受损患者的有值节点大都位于患者患侧,这可能与病灶位置有关,而右侧半球受损患者的有值节点不存在此情况,后续将进行深入研究。而本文主要研究tDCS对患侧的改善,从入度结果发现tDCS对患侧具有明显的改善作用。
Lee等[17]探究tDCS应用于M1区,结果改善了脑卒中患者上肢功能。有研究学者发现在M1区施加tDCS会诱导相对持久的神经元塑性和神经元群体之间的关联改变并调节运动性能[18-20]。Yin等[21]分析脑卒中患者脑网络拓扑性质,发现中介中心度、全局效率和局部效率发生显著改变。有研究显示tDCS可以引起大脑半球内和半球间连接性的显著改变[22]。本研究从宏观EEG角度得出,不同受损部位脑卒中患者tDCS刺激后相对刺激前脑网络的集团化程度增加,网络信息传输效率上升,核心节点有所转移且枢纽节点的核心地位下降,网络的全局效率和局部效率明显增加,这一结果说明tDCS对脑卒中疾病的康复疗效具有积极作用。
4 结论
本文基于EEG评估tDCS刺激患侧对脑卒中患者的调控作用,通过对刺激前、中、后的脑网络及有效连接模型对比分析发现tDCS有助于改善患者的大脑连接状况,增加信息流交互作用,提高脑网络的集团化程度和网络运行效率,降低枢纽节点的核心地位的同时,增加左右半球之间的连接。为tDCS应用于脑卒中疾病的治疗提供临床实验依据,客观评估tDCS的作用效果。由于本实验为单次刺激实验,未形成刺激的累积效应,按疗程进行tDCS刺激将有助于产生累积刺激效应,有可能提高对脑卒中的长期改善作用。

