农业活动对黑土剖面有机碳含量和酶活性的影响
谭 琴,李梦寒,胡才希,杨家纯,童 蕾,2*
(1.中国地质大学(武汉)环境学院,湖北 武汉 430078;2.黑龙江省黑土地水土资源研究重点实验室,黑龙江 哈尔滨 150036)
黑土是自然界中肥力最高、最适合农耕的土壤类型之一,它含有丰富的有机质和矿物质,在我国主要分布于东北平原的黑龙江省和吉林省[1]。然而,随着农业的发展,农业活动对土壤的利用程度不断加大,土壤的环境也随之发生变化,其中主要的影响因素包含土地利用方式的改变、施肥和灌溉等[2-3]。
土壤中总有机碳(TOC)作为衡量耕地土壤质量与土壤肥力的关键指标,在提高农业生态系统的生产力方面起着重要的作用[4]。土壤中溶解性有机碳(DOC)是活性有机碳的重要组成部分,它易溶解、移动快、不稳定、易氧化分解、易矿化,是活性较高的土壤碳素,受内外因素的影响强烈,在冬季冻土中,DOC为微生物活动提供碳源,与土壤生态系统中TOC的分解释放、迁移与固持有密切联系[5]。在一定区域内,当成土过程中的自然因素基本相同时,时间和人为因素是导致水稻黑土中TOC分布差异的主要因素。
土壤中酶是土壤有机组分中最活跃的部分,土壤的水、热状况与外源性营养元素的输入等都会影响各类土壤中酶的活性,酶的活性也会随着土壤深度的改变而改变[6-7]。土壤中酶参与土壤中一切复杂的生化循环过程,所以土壤中酶的活性可以反映土壤中有机质的转化能力与土壤中微生物活性的大小。研究证明,蔗糖酶的活性与土壤中有机质、微生物数量和土壤呼吸强度等因子有一定的相关性。一般情况下,土壤肥力越高,蔗糖酶的活性越强[8]。因此蔗糖酶的活性不仅能表征土壤生物学活性强度,还能作为评价土壤肥力水平的一个指标。过氧化氢酶广泛存在于土壤和生物体内,土壤中过氧化氢酶能促进过氧化氢的分解,防止其对生物体的毒害作用[9],并能表征土壤生物氧化过程的强弱[10]。
目前关于东北黑土区土壤中TOC的研究较多,而关注土壤中酶活性的研究较少。前人的研究主要关注土地利用方式变更对土壤中TOC影响的研究,或是灌溉水源对农作物生长特性的研究,而较少关注不同灌溉水源对土壤中有机碳的影响,特别是对不同耕作年限黑土质量的研究。因此,种植年限和灌溉水源这两个农业活动条件是本文研究的重点。为此,本文选取黑龙江省海伦市不同种植年限和灌溉水源背景的黑土为研究对象,以TOC含量、DOC含量、蔗糖酶活性和过氧化氢酶活性作为评价指标,阐明这些指标在土壤不同深度的分布规律,通过其分布规律来揭示水稻种植年限和灌溉水源对黑土质量的影响,以期为东北水稻土耕作提供科学支撑。
1 研究区概况与样品采集
1.1 研究区概况
研究区海伦市地处黑龙江省中部地区(46°58′~47°52′N,126°14′~127°45′E),为小兴安岭山地向松嫩平原的过渡地带,属于松嫩平原的典型黑土区[11]。区域内无高山,多为波状起伏的高平原,海拔在147~471 m范围内[12]。海伦市位于中温带亚湿润气候区,属寒温带大陆性季风气候;年降水量为500~600 mm,年平均气温为1~2℃;冬季漫长寒冷,气候干燥少雨,夏季气候湿热多雨。海伦市耕地面积约26万hm2,土壤类型主要为黑土和草甸土,其中草甸土占17.77%,黑土占81.53%,土壤母质主要为河湖相冰水沉积物。
1.2 样品采集
2019年4月底,在海伦市长华乡采集不同种植年限和灌溉水源背景的水稻田土壤即水稻土。在本次采样中,共采集4个剖面的土样,其分布情况见图1。水稻灌溉水源包括地表水(SW)和地下水(GW)。剖面土样分别为地表水灌溉70 a以上的水稻田土壤[SW(70a)]、地表水灌溉1 a的旱改水稻田土壤[SW(1a)]、地下水灌溉3 a的旱改水稻田土壤[GW(3a)]和地下水灌溉20 a的水稻田土壤[GW(20a)]。采样在相同的气候、成土母质与地形条件下进行。
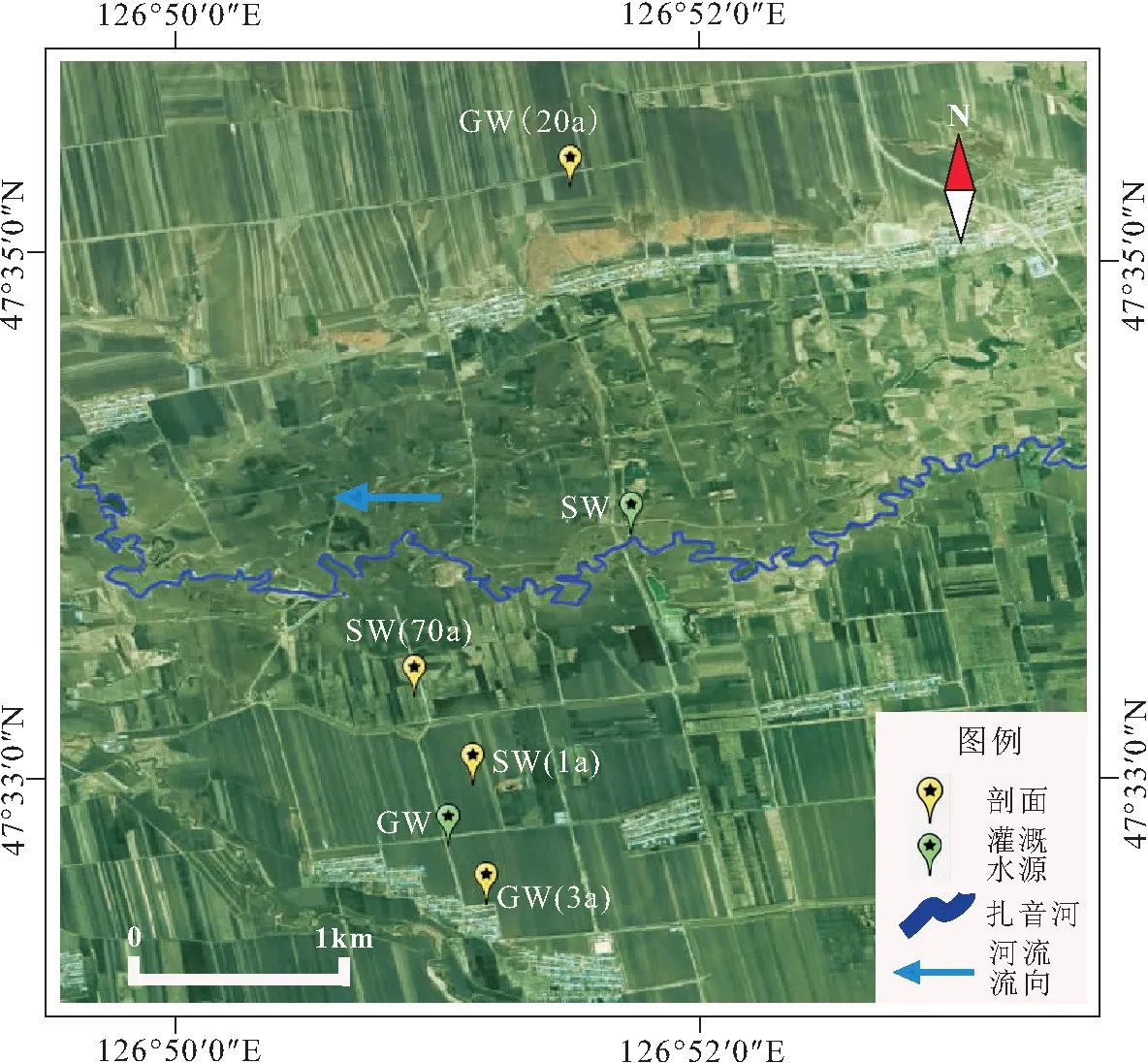
图1 研究区水稻土剖面点位及灌溉水源分布Fig.1 Points location of paddy soil profile and distribution of irrigation water sources in the study area
4月底为东北冻土的消融期,土壤冻层在水稻土剖面30 cm以下,使用洛阳铲进行采样。采样的总深度为80 cm,在土壤深度为0~30 cm范围内每5 cm进行一次分层取样;在土壤深度为30~80 cm范围内每10 cm进行一次分层取样。每层土样都采集多点等量土壤并混合均匀,样品采集时保证至少有10%的平行双样,且平行样的检测精密度均在20%以下。
1.3 分析方法
(1) 土壤中TOC含量的测定:采用德国delta v advantage稳定同位素质谱仪对土壤样品中TOC含量进行上机测试[13]。具体方法为:将土壤样品研磨过150目筛后,取1.00 g于50 mL离心管中,加入1 M稀盐酸,充分混匀,静置12 h;再将离心管置于离心机中以8 000 r/min的转速离心5 min,倒掉上清液,再加入50 mL超纯水混匀,离心5 min,倒掉上清液;重复上步骤至上清液接近中性后,于60℃环境下烘干至恒重,再研磨过150目筛后,进行上机测试[14]。
(2) 土壤中DOC含量的测定:采用水提取法测定土壤样品中DOC含量。具体方法为:取10.00 g新鲜土壤,按照5∶1的水土比例加入去离子水,在常温下以300 r/min的转速振荡1 h,后用离心机以8 000 r/min的转速离心20 min,再用0.45 μm的滤膜过滤上清液;采用TOC分析仪测定浸提液中TOC含量,并根据浸提液中TOC含量和土壤含水量计算出土壤中DOC的含量[15]。
(3) 土壤含水率的测定:采用烘干法测定土壤样品的含水率。具体方法为:用土钻进行取样,装入铝盒并在0.1 g精度的天平上称量土样的重量,记作湿重M(g);在105℃的烘箱内烘6~8 h,将土样烘至恒重,并测定土样的干重Ms(g),空铝盒重量为M0(g),按下式计算土壤含水率:

(1)
(4) 土壤中过氧化氢酶活性的测定:采用紫外分光光度法测定土壤样品中过氧化氢酶活性。具体方法为:先取2.00 g土壤样品于锥形瓶中,加入40 mL去离子水和5 mL 0.3%过氧化氢(H2O2)溶液,加塞密封后,在常温、转速为180 r/min条件下放入摇床中振荡20 min;然后加入1 mL饱和明矾,立即过滤于盛有5 mL 1.5%硫酸溶液的锥形瓶中,滤干后,将滤液直接在240 nm处用1 cm石英比色皿测定吸光度,同时做无土和无基质的对照试验;最后绘制标准曲线,对照标准曲线得到溶液中过氧化氢的浓度,并按照下面公式计算土壤中过氧化氢酶的活性[16]:
(2)

(3)
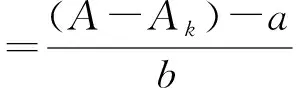
(4)
式中:E为20 min内每克土壤分解的H2O2的毫克数,表示酶活性(mg/g);T0为样品空白的H2O2质量(g);T剩为样品中反应剩下的H2O2质量(g);W为样品的称样量(g);A0为样品空白的吸光度;A为样品的校正吸光度;Ak为对应样品的无基质吸光度;a为校准曲线截距;b为校准曲线的斜率。
(5) 土壤中蔗糖酶活性的测定:采用二硝基水杨酸比色法测定土壤样品中蔗糖酶活性。具体方法为:取5.00 g新鲜土壤于50 mL锥形瓶中,加入15.0 mL 8%的蔗糖溶液、5.0 mL pH为5.5的磷酸溶液和5滴甲苯,摇匀后置于生化培养箱,在37℃下培养24 h;然后以6 000 r/min转速离心10 min,立即取1.0 mL上清液于50 mL比色管中;最后按照标准比色方法比色,并依据标准曲线按下式计算土壤中蔗糖酶的活性(以培养24 h后每克土壤中葡萄糖的毫克数表示):[17]
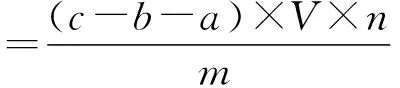
(5)
式中:a为不加土壤加蔗糖溶液的对照组葡萄糖毫克数(mg);b为加土壤不加蔗糖溶液的对照组葡萄糖毫克数(mg);c为正常加入土样及蔗糖溶液的试验组葡萄糖毫克数(mg);V为显色体积(mL);n为分取倍数;m为土重(g)。
为了消除土壤中原有的蔗糖、葡萄糖引起的误差,每一土样需做无基质对照,整个实验需作无土壤对照。
1.4 数据处理
试验数据经Microsoft Excel 2016软件整理后,采用Origin 2017软件绘制土壤样品中各指标含量的分布图,Pearson相关性分析采用SPSS 22软件完成。
2 结果与讨论
2.1 水稻土剖面中TOC含量和DOC含量的垂向分布特征
水稻土剖面中TOC含量和DOC含量的垂向分布图,见图2。
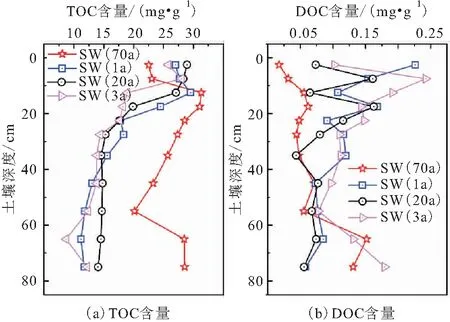
图2 水稻土剖面中TOC含量和DOC含量的垂向分布图Fig.2 Vertical distribution of TOC content and DOC content in paddy soil profile
由图2(a)可以看出:
(1) 4个剖面中TOC含量主要集中在表层土的0~20 cm之间,其中地表水灌溉的水稻土中TOC含量呈先增加后减少的趋势,但SW(70a)水稻土样中TOC含量在深层60 cm左右仍存在增加的情况,SW(1a)水稻土样中TOC含量的变化在深层则表现得较为稳定;地下水灌溉的水稻土中TOC含量在表层0~10 cm范围内最高,然后不断下降并在30cm左右保持稳定。
(2) 表层土(0~10 cm)受农耕活动扰动的影响较大,SW(1a)和GW(3a)水稻土旱改水的时间虽然短,但也有较长的开垦历史,相对而言GW(20a)水稻土的种植年限最短,说明种植年限越长的水稻表层土中TOC含量越低,这与刘景双等[18]的研究结果相似。对于10~30 cm深度的土壤,地表水灌溉的水稻土中TOC含量明显高于地下水灌溉的水稻土。30 cm以下深度的土壤中TOC含量则与土壤母质相关[19],该层水稻土中TOC含量随着水稻种植年限的增长而增加。这是因为在水稻种植过程中,其有机质来源比旱地土壤多[20],而淹水状态下土壤中微生物的呼吸作用减弱,弱化了有机质的分解作用,从而有利于土壤中TOC随灌溉水的淋滤作用在深层土中累积。
(3) 整体上,SW(70a)水稻土中TOC含量最高,GW(20a)水稻土中TOC含量随土壤深度的增加而降低,SW(70a)、SW(1a)和GW(3a)水稻土中TOC含量在表层先增加而后降低,这可能是消融期的冰雪将上层土壤中TOC淋洗到下层土壤造成的[21]。
由图2(b)可知,表层水稻土中DOC含量差异较大,深层水稻土在30~60 cm范围内DOC含量差异较小,但60 cm深度以下土壤中DOC含量差异又变大。SW(70a)水稻土的表层土壤中DOC含量最低,随土壤深度由浅到深逐渐增加,SW(1a)水稻土则相反,表层土壤中DOC含量较大,到深层逐渐减小;地下水灌溉的水稻土剖面DOC含量随土壤深度呈先增加后减少的趋势,且在表层种植年限短的水稻土中DOC含量高于种植年限长的,反映出表层土壤中DOC迁移到深层土壤和深层土壤中有机碳的溶解都需要一定的时间。4月底土壤处于消融期,表层土壤的水分下渗导致表层水稻土中DOC含量降低,GW(3a)水稻土中DOC含量在55 cm深度处存在异常增加,可能是因为土壤本身的有机质含量较高所致。
对比图2(a)和(b)可知,地表水灌溉的水稻土中DOC含量/TOC含量比值在0.08%~0.84%之间,地下水灌溉的水稻土中该比值为0.24%~1.51%,说明地表水灌溉的水稻土中TOC易分解组分所占比例不高,利于土壤中TOC的积累。
2.2 水稻土剖面中过氧化氢酶活性和蔗糖酶活性的垂向分布特征
土壤中过氧化氢酶是土壤动物新陈代谢和土壤植物根系分泌及残体分解的重要酶类[22-23]。土壤中蔗糖酶与土壤TOC转化密切相关,能够促进土壤中有机质的分解,为微生物提供养料,进而促进微生物繁殖。水稻土剖面中过氧氢酶活性和蔗糖酶活性的垂向分布图,见图3。
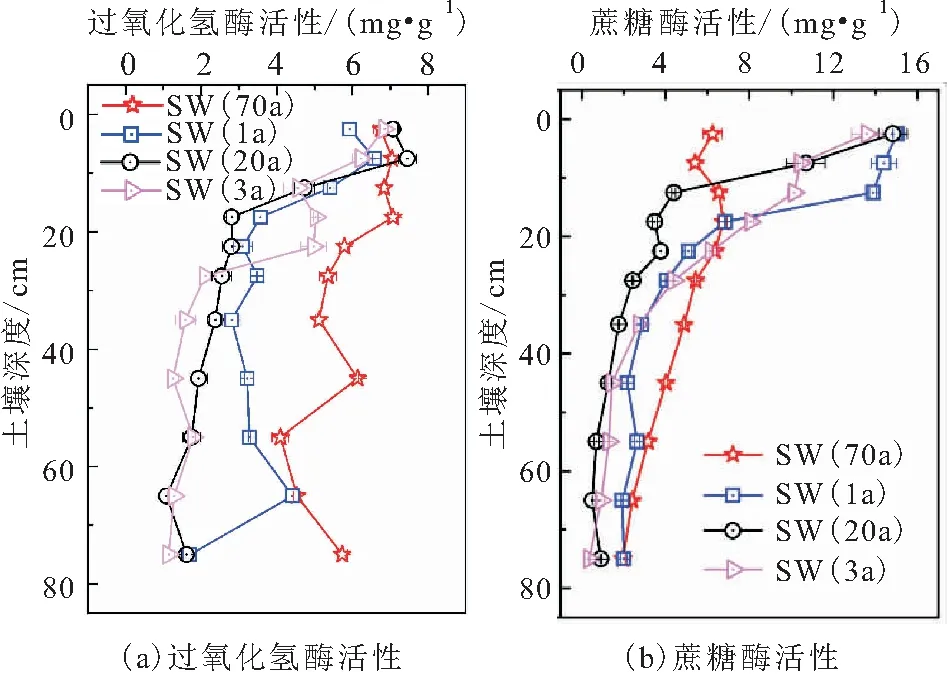
图3 水稻土剖面中过氧化氢酶活性和蔗糖酶活性的 垂向分布图Fig.3 Vertical distribution of catalase activity and sucrase activity in paddy soil profile
由图3(a)可知:地表水灌溉的水稻土中过氧化氢酶活性比地下水灌溉的水稻土高,种植年限长的水稻土中过氧化氢酶活性整体上高于种植年限短的;4个水稻土剖面中,表层0~10 cm水稻土中过氧化氢酶活性相差不大,从10 cm深度开始过氧化氢酶活性差异变大,表现为10~30 cm深度的土壤中过氧化氢酶活性大小顺序为:SW(70a)>GW(3a)>SW(1a)>GW(20a),30 cm深度以下的土壤中过氧化氢酶活性大小顺序为SW(70a)>SW(1a)>GW(20a)>GW(3a)。
由图3(b)可知:4个水稻土剖面中蔗糖酶的活性均在表层土壤中最大,并随着土壤深度的增加而减小,但在40 cm深度以下水稻土中蔗糖酶的活性基本趋于稳定,这与关松荫等[24]关于哈尔滨黑土剖面中蔗糖酶活性的研究结果相同;深层水稻土中蔗糖酶的活性表现为地表水灌溉的水稻土优于地下水灌溉的水稻土,深层水稻土中蔗糖酶活性的分布规律与过氧化氢酶活性相似,SW(70a)水稻土中蔗糖酶的活性在表层0~10 cm土壤中相对较低,这与该剖面土壤中TOC含量在表层较低一致。这是由于土壤中有机质含量低,为微生物呼吸作用提供的底物不足,酶的活性也会相应降低;另外,SW(70a)表层水稻土因长期淹水,也不利于土壤微生物生化作用的进行。
结合图3(a)和(b)所呈现的分布规律可知,两种酶的活性在水稻土中均表现为地表水灌溉的水稻土优于地下水灌溉的水稻土,可能是由于地下水中含有的盐分较地表水高,盐分积累会抑制地表和地下微生物的生化作用,从而降低土壤中酶的活性。此外,也有研究表明,相较地表自流灌溉水,地下井水灌溉对水稻和玉米的产量有抑制作用[25-26]。
2.3 水稻土环境因子相关性分析
为了探究不同灌溉水源和种植年限对水稻土产生的影响,对4种水稻土样中TOC含量、DOC含量、过氧化氢酶活性和蔗糖酶活性4个指标分别进行了相关性分析。
2.3.1 地表水灌溉的水稻土理化性质的相关性分析
地表水灌溉的水稻土中TOC含量、DOC含量、过氧化氢酶活性和蔗糖酶活性的相关性分析结果,见表1。
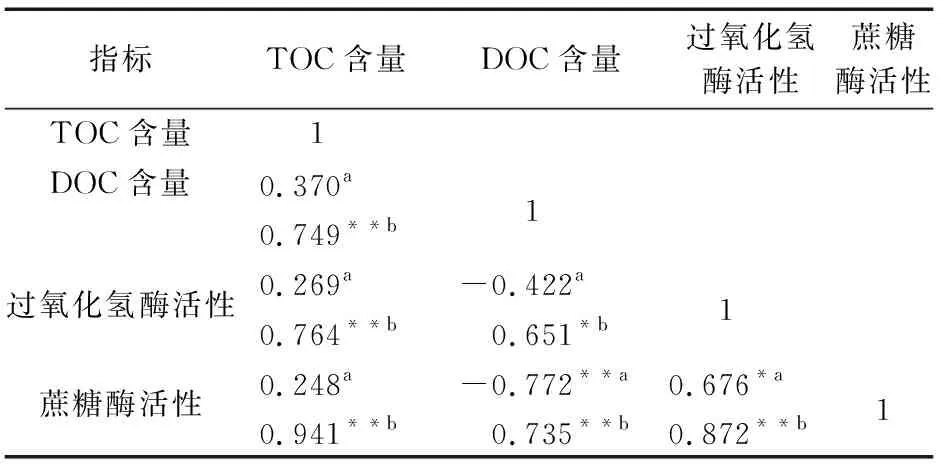
表1 地表水灌溉的水稻土中TOC含量、DOC含量、过氧化氢酶活性和蔗糖酶活性的相关性矩阵(n=11)Table 1 Correlation matrix of TOC content,DOC content,catalase activity and sucrase activity in paddy soil irrigated by surface water (n=11)
由表1可知:地表水灌溉、种植年限为70 a的剖面土壤中蔗糖酶活性与DOC含量呈极显著负相关关系(r=-0.772**,p<0.01),这与多数研究结果相反,可能是由于前期施肥增加了深层土壤中DOC含量,而浅层土壤中DOC在休耕期流失[27],导致该剖面土壤中DOC含量异常;SW(70a)水稻土中过氧化氢酶活性与蔗糖酶活性呈显著正相关关系(p<0.05);SW(1a)土壤中TOC含量与其他3个指标含量均呈极显著正相关关系(p<0.01),SW(1a)水稻土中DOC含量与过氧化氢酶活性呈显著正相关(p<0.05)、与蔗糖酶活性呈极显著正相关关系(p<0.01),SW(1a)水稻土中过氧化氢酶活性与蔗糖酶活性呈极显著正相关关系(p<0.01)。这些结果与前人的研究结果一致。土壤中TOC含量决定了DOC含量,酶活性的高低直接影响着有机碳库的周转速率,而过氧化氢酶能分解对作物有害的过氧化氢,其酶活性高也有利于蔗糖酶转化作用的进行。
2.3.2 地下水灌溉的水稻土理化性质的相关性分析
地下水灌溉的水稻土中TOC含量、DOC含量、过氧化氢酶活性和蔗糖酶活性的相关性分析结果,见表2。
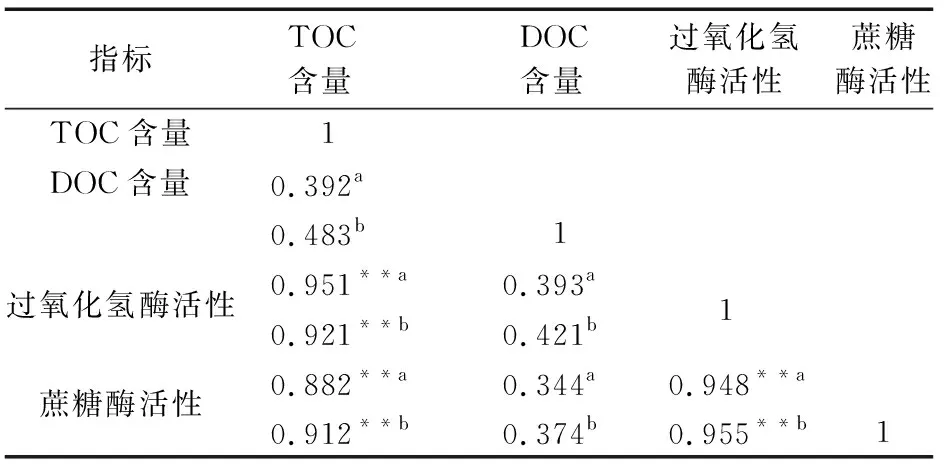
表2 地下水灌溉的水稻土中TOC含量、DOC含量、过氧化氢酶活性和蔗糖酶活性的相关性矩阵(n=11)Table 2 Correlation matrix of TOC content,DOC content,catalase activity and sucrase activity in paddy soil irrigated by ground water(n=11)
由表2可知,两个地下水灌溉的水稻土剖面土壤中TOC含量与过氧化氢酶活性、蔗糖酶活性呈极显著正相关关系(p<0.01),土壤中过氧化氢酶活性与蔗糖酶活性呈极显著正相关关系(p<0.01)。
除受前期施肥影响的SW(70a)水稻土外,其余3个水稻土剖面中TOC含量与过氧化氢酶和蔗糖酶活性均呈极显著正相关关系,这与多位学者的研究结论相同[28-31],证实了这两种土壤酶是影响土壤中TOC含量的重要因子。另外,在所有水稻土剖面中,土壤中这两种酶活性之间的正相关性也很强,这与前人的研究结果相同[32],在郑勇等[33]关于旱地红壤酶活性和焦晓光等[34]关于黑土和暗棕壤土酶活性的研究中,这两种酶之间也存在显著的正相关关系,说明在不同土壤类型上,过氧化氢酶和蔗糖酶活性在反映土壤性质方面具有一定的共性。
地表水灌溉的水稻土相比于地下水灌溉的水稻土中TOC积累更多,过氧化氢酶和蔗糖酶活性较高,而DOC含量较低,一方面是由于较高的酶活性利用DOC的效率高,且DOC转化快、易被作物吸收,另一方面是施肥、耕作等人为活动的影响,造成局部土壤中DOC含量异常。
3 结 论
(1) 水稻种植年限对海伦市黑土有机碳和土壤酶活性的影响在不同土壤深度表现不同,但总体上种植年限越长,越有利于土壤中TOC的积累,同时土壤中过氧化氢酶的活性也越高。种植年限对土壤中蔗糖酶活性的影响则没有明显的规律。土壤中TOC的积累及较高的酶活性表征着土壤具有较高的土壤肥力,能为水稻生长提供更多的养分。
(2) 灌溉水源采用地表水比地下水更利于土壤中TOC的积累(DOC含量/TOC含量比值更小),地表水灌溉的土壤中过氧化氢酶和蔗糖酶活性也更高。但河流水-井水多水源灌溉是否比单一地表水灌溉效果更好,还需要进一步研究。
(3) 土壤中TOC含量与过氧化氢酶活性和蔗糖酶活性之间的正相关性极显著,说明土壤中这两种酶是影响黑土中TOC含量的重要因子。多种类型土壤中TOC含量与这两种酶之间都存在显著正相关性,说明其酶活性反映土壤性质具有一定的普适性。

