甲状腺素腹腔注射对负透镜诱导近视豚鼠生长发育和屈光状态的影响
杨成秀,吴建峰,郭滨,林思思,蒋文君,毕宏生
1 山东中医药大学眼科与视光医学院,济南250014;2 山东省中西医结合眼病防治重点实验室;3 山东省眼病防治研究院;4 山东省眼视光与青少年视力低下防控临床医学研究中心
近年来,我国青少年近视发病率逐年上升[1],目前尚无有效治疗手段。研究表明,甲状腺功能亢进症(后简称甲亢)患者下丘脑—垂体—性腺(HPG)轴分泌雌二醇(E2)水平增高[2],刺激血清中生长激素(GH)分泌,进而导致胰岛素样生长因子1(IGF-1)水平增高[3]。动物实验发现,血清中E2水平升高与基质金属蛋白酶2 表达升高有关[4],可导致巩膜重塑,加重近视病情。有学者对雏鸡模型玻璃体腔注射IGF-1,使脉络膜中IGF-1 水平升高,导致眼轴伸长[5]。还有研究显示,高度近视和单纯型近视患者血清IGF-1水平升高[6]。E2和IGF-1水平升高可加重近视发展,提示甲状腺素与近视病程关系密切。动物实验显示,大鼠经甲状腺素灌胃7 ~30 d 可出现体质量减轻、体温高、烦躁不安、易怒等症状,与甲亢临床表现相符合[7]。本课题组前期研究结果显示,0.05 mg/kg 的左旋甲状腺素能成功复制甲亢模型,且致死率较低。在此基础上,2021 年4 月—7 月,本研究对发育期豚鼠进行左旋甲状腺素钠联合负透镜诱导造模,构建甲亢型近视豚鼠模型,观察甲状腺素对生长发育和屈光状态的影响,现报告如下。
1 材料与方法
1.1 实验动物 36 只2 周龄英国种雄性三色短毛豚鼠购自丹阳市昌益实验动物养殖有限公司,许可证号SCXK(苏)2021-0002,体质量110 g 左右。饲养环境温度保持在24 ℃左右,并控制12 h/12 h 的昼夜节律,自由饮食。实验开始前先对豚鼠进行眼部疾病筛查,排除先天性近视、白内障、角膜病等眼部疾病。
1.2 动物分组与处理 将36 只豚鼠随机分为对照组、模型组和实验组,每组12 只。实验组于每日上午8:30 ~10:30腹腔注射左旋甲状腺素钠0.05 mg/kg(上海阿拉丁生化科技股份有限公司),每日1 次,连续4周;对照组、模型组于同一时间腹腔注射等量生理盐水。腹腔注射第4天起,模型组、实验组右眼戴-6.00 D 透镜,连续4周,左眼不戴镜作为自身对照;对照组不戴镜。
1.3 一般情况观察及体质量、肛温测量 造模前后观察豚鼠的一般状况,包括豚鼠的毛发色泽、行为状态、饮食及大小便情况;每日记录豚鼠的体质量(精确到0.01 g);将医用润滑液(黑龙江省运加医疗科技有限公司)滴在豚鼠肛门和温度计探头上,VICKS 温度计测量肛温,每2 周记录1 次。
1.4 眼生物参数测量 造模前和造模4 周后分别测量各组屈光度及眼轴长度。豚鼠双眼结膜囊内滴10 g/L 盐酸环喷托酯滴眼液(美国爱尔康公司)4 次,每次间隔5 min。90 min 后,在睫状肌麻痹状态下,于暗室用带状光检影镜进行垂直及水平子午线上的检影(工作距离保持0.5 m),分别在子午线上加球镜,得到A、B 两组数据,等效屈光度为垂直及水平两条主子午线检测值的均数。测量眼轴长度时,首先将豚鼠固定,用盐酸奥布卡因滴眼液(参天制药株式公社)滴入结膜囊内,行表面麻醉,将A型超声(Cinescan,法国Quantel Medical 公司)探头垂直于角膜平面,对准瞳孔中央,连续测量10 次,排除明显偏离的数值,取平均值,精确到0.01 mm。A 型超声仪手动模式下设置超声不同介质中的传播速度,前房为1 557 m/s,玻璃体为1 540 m/s,晶状体为1 723 m/s。
1.5 血清激素和环核苷酸检测 采用ELISA 法检测豚鼠血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、E2、睾酮(T)、环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)。
1.6 后极部巩膜厚度观测 造模结束后,对豚鼠进行腹腔注射水合氯醛麻醉,迅速摘除眼球,眼球固定液(武汉赛维尔生物科技有限公司)固定脱水,石蜡包埋,在石蜡切片机上平行于视神经方向切片。当视神经出现时收集切片,切片厚4 μm,经HE 染色,每眼取3 张切片,在光镜下(200×)测量各组后极部巩膜厚度。每张切片取显微镜下巩膜组织中央区域厚度作为测量值。
1.7 统计学方法 采用SPSS22.0 统计软件。计量资料经W检验呈正态分布,以±s表示,Levene 法检验方差齐性,重复测量数据行重复测量方差分析,多组比较采用单因素方差分析(ANOVA),造模眼与自身对照眼数据比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组豚鼠造模后生长情况及体质量、肛温比较 造模后实验组豚鼠体质量下降明显,肛温升高,活动频率增高,毛发枯槁无光泽、易脱落,多食消瘦,大便干结色黑,易怒躁动,兴奋好斗,不易被抓取。对照组和模型组豚鼠体征正常。造模4周后,模型组体质量高于实验组(P<0.05)。从造模第2周开始,实验组肛温高于模型组(P均<0.05)。见表1、表2。
表1 各组造模不同时间体质量比较(g,±s)

表1 各组造模不同时间体质量比较(g,±s)
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别实验组模型组对照组n 12 12 12体质量0周110.083±7.477 108.182±7.795 106.182±6.096 1周138.900±11.330 142.382±10.341 148.018±21.798 2周157.217±15.115*#171.436±17.034 177.182±27.450 3周172.317±19.784**##200.418±24.809 207.655±29.430 4周192.167±17.356**##230.636±31.050 238.691±35.497
表2 各组造模不同时间肛温比较(℃,±s)

表2 各组造模不同时间肛温比较(℃,±s)
注:与对照组相比,**P<0.01;与模型组相比,##P<0.01。
组别实验组模型组对照组n 12 12 12肛温0周37.642±0.529 37.833±0.186 37.661±0.371 2周38.978±0.378**##38.439±0.334 38.633±0.626 4周38.981±0.331**##38.212±0.249 38.397±0.254
2.2 各组豚鼠造模后血清激素和环核苷酸水平比较 造模4 周后,实验组血清FT3、FT4、E2、cAMP、cAMP/cGMP 水平高于对照组和模型组,T 水平低于对照组和模型组(P均<0.05)。详见表3。
表3 各组豚鼠造模后血清激素和环核苷酸水平比较(±s)

表3 各组豚鼠造模后血清激素和环核苷酸水平比较(±s)
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别实验组模型组对照组n 12 12 12 FT3(pmol/L)16.313 ± 0.677*##14.250 ± 0.580 13.887 ± 1.229 FT4(pmol/L)43.987 ± 8.397*#29.491 ± 2.396 27.419 ± 6.220 E2(nmol/L)85.604 ± 4.991**##71.456 ± 4.408 70.958 ± 2.664 T(nmol/L)28.973 ± 1.236**##35.734 ± 1.618 34.964 ± 1.013 cAMP(nmol/L)1.140 ± 0.067**##0.884 ± 0.060 0.876 ± 0.093 cGMP(nmol/L)0.817 ± 0.062 0.823 ± 0.074 0.821 ± 0.024 cAMP/cGMP 1.398 ± 0.038**##1.077 ± 0.075 1.065 ± 0.084
2.3 各组豚鼠造模前后屈光度及眼轴长度比较造模4 周后,模型组造模眼屈光度和两眼屈光度差值低于对照组;实验组造模眼屈光度和两眼屈光度差值低于模型组(P均<0.01)。模型组眼轴和两眼眼轴差值长于对照组;实验组左右眼眼轴短于模型组,左右眼眼轴差值高于模型组(P均<0.05)。详见表4。
表4 各组造模前后屈光度及眼轴长度比较(±s)

表4 各组造模前后屈光度及眼轴长度比较(±s)
注:与对照组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别实验组造模前造模后4周模型组造模前造模后4周对照组造模前造模后4周n 12 12 12屈光度(D)右眼4.500±1.672-5.979±1.938**##5.114±2.172-3.227±1.679**4.909±1.848 3.636±1.610左眼3.604±1.929 2.958±2.094 4.800±1.487 2.546±1.508 4.432±2.098 3.318±1.590两眼差值0.896±2.010-8.937±2.817**##0.318±2.098-5.773±1.591**0.477±2.084 0.318±2.044眼轴长度(mm)右眼8.001±0.076 8.501±0.059#8.035±0.064 8.593±0.095**8.005±0.070 8.463±0.105左眼7.997±0.072 8.427±0.057##8.035±0.063 8.534±0.090 8.007±0.069 8.483±0.114两眼差值0.004±0.012 0.074±0.020**#0.001±0.013 0.059±0.011**-0.003±0.018-0.020±0.061
2.4 各组豚鼠造模后后极部巩膜厚度及形态变化 对照组、模型组、实验组豚鼠的后极部巩膜厚度分 别 为(504.020 ± 8.594)、(442.593 ± 8.597)、(314.157±5.295)μm,三组依次变薄(P均<0.05)。对照组后极部巩膜厚度正常,胶原纤维排列规则紧密,纤维较粗,无断裂现象。模型组巩膜变薄,胶原纤维疏松变细,间隙变大,未见纤维断裂现象;实验组右眼的后极部巩膜最薄,胶原纤维最细、最稀疏,间隙最大,且部分纤维出现断裂。见图1。
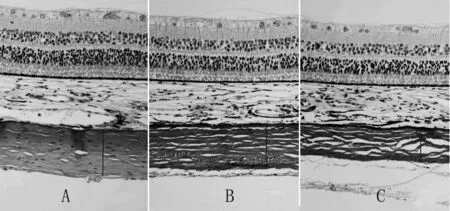
图1 各组豚鼠造模后后极部巩膜厚度及形态
3 讨论
甲状腺素钠过量会导致医源性甲亢,使机体物质代谢和骨骼肌能量代谢增强,能量消耗加剧,下丘脑—垂体—靶腺轴出现不同程度紊乱,常将cAMP/cGMP 比值上升作为甲亢造模成功的评判指标[8-10]。本研究中,豚鼠腹腔注射左旋甲状腺素钠水溶液后,出现活动频繁、易怒好斗、进食增多、体质量下降等症状,与甲亢临床表现相符。豚鼠体内甲状腺素水平升高,发挥生理作用的FT3、FT4明显上调,下丘脑—垂体—甲状腺轴亢进;血清中E2水平显著升高,T 水平降低,HPG 轴功能紊乱,此现象在甲状腺素造模的大鼠模型中也得到证实[11]。实验组参与调节不同生化代谢和生理功能的cAMP 水平升高、cAMP/cGMP 比值升高,表明本实验模型符合甲亢的临床体征,具有一定的可靠性。
本研究结果表明,左旋甲状腺素钠造模后,豚鼠体质量明显降低,肛温显著升高,这可能与机体代谢亢进有关。动物实验表明,甲亢模型大鼠能量代谢活跃,线粒体酶的数量与活性增强,线粒体内物质氧化分解作用加强,柠檬酸循环和氧化磷酸化加速,使机体静息代谢率增大[12-13]。本研究中实验组豚鼠血清cAMP 水平升高,原因是甲亢状态下甲状腺素通过三聚体GTP 结合调节蛋白与甲状腺细胞受体结合,刺激腺苷酸环化酶催化ATP 合成cAMP[14]。研究表明,肝脏中cAMP 含量升高,导致蛋白激酶A 介导的脂肪酸合成关键酶(乙酰辅酶A 羧化酶和丙酮酸脱氢酶)磷酸化,抑制脂肪生成[15]。同时,甲状腺素可诱导褐色脂肪细胞中参与甘油三酯降解过程的脂肪甘油三酯脂肪酶、激素敏感性脂肪酶等关键酶的表达;并可通过过氧化物酶体增殖物激活受体α等调节因子参与脂质动员和脂肪酸氧化基因表达,促进脂质代谢;此过程中产生游离脂肪酸,还可被褐色脂肪组织用作产热的燃料[16-17]。甲状腺素作用于外周和交感神经系统,激活褐色脂肪组织,刺激解偶联蛋白表达,通过解除ATP 合成的电子传输耦合来刺激产热[17]。
本研究结果显示,甲亢型负透镜诱导近视豚鼠的屈光度和左右眼屈光度差值降低、后极部巩膜变薄,左右眼的眼轴长度差值显著增加,说明左旋甲状腺素钠造模后会加重近视程度。有研究证实,E2和T 水平高低与等效球镜度变化呈负相关、E2水平与眼轴长度呈正相关[18]。E2可通过影响一氧化氮的产生,刺激眼轴增长;通过促进人巩膜基质金属蛋白酶的表达,参与巩膜重塑;还可调节角膜的生化特性和曲率,导致近视程度加重[19]。此外,E2通过GH/IGF-1轴发挥作用,减少IGF-1对GH 的反馈抑制,刺激GH分泌,进而导致IGF-1 分泌增加[3]。动物实验显示,形觉剥夺性近视豚鼠的巩膜组织中IGF-1 mRNA 表达升高,近视的加重与IGF-1 甲基化降低有关[20]。胶原蛋白是巩膜细胞外基质的主要成分,近视患者巩膜变薄伴随胶原蛋白(特别是Ⅰ型胶原蛋白)合成减少。研究表明,巩膜cAMP 含量升高使胶原蛋白降解增加,从而加重近视[21]。因此,甲状腺素异常增高可能通过增加血清中E2水平和cAMP含量,降低T水平来加重近视的发展,但具体机制还需进一步研究。
本研究发现,甲亢型近视豚鼠的眼轴长度短于模型组,这可能与豚鼠的生长发育受抑制有关。体内过多的甲状腺素使新陈代谢加快,能量消耗增加,导致营养不良和缺钙[22]。临床上,甲亢新生儿生长迟缓,儿童和青少年时期甲状腺素过多也会导致骨骼加速发育和快速生长,但骨形成加速和生长板过早闭合,会导致身材持续性矮小[23]。一项针对2 226例7~14岁儿童的研究表明,近视儿童眼轴长度与身高、体质量呈正相关[24]。本研究中实验组眼轴增长受抑制可能是由于甲状腺素增多影响豚鼠生长发育,进而影响了眼球的生长发育,这在动物模型[25]和人群中均得到证实。我们推测本实验甲亢模型出现的体质量减轻和眼轴增长受抑制是持续性现象,不会随着时间延长而改变。
结合上述研究结果,我们认为,甲状腺素联合负透镜诱导的甲亢型豚鼠近视程度加深,同时影响自身的生长发育。这提示处于生长发育期的近视患者在大量使用甲状腺素或出现体质量减轻、体温升高、烦躁不安等甲亢临床症状时,除了进行甲状腺相关检查外,还应定期监测生长发育状态和眼参数变化。此项研究的深入开展对儿童正常生长发育与近视发病机制研究有深远意义,为近视防治及探讨近视与甲状腺素的关系奠定了实验基础。

