circFAT1在非小细胞肺癌组织中表达及对细胞增殖和侵袭力的影响
徐至珺,王 炯,解明然,颜 宇,张 倩,周文勤
肺癌已成为我国发病率和死亡率位居首位的恶性肿瘤,其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)是其主要病理学类型,约占80%以上[1],由于该肿瘤早期症状不典型,多数患者确诊时已进展至中晚期,患者总体预后较差[2]。近年来,随着靶向药物治疗技术的推广应用,为攻克肺癌提供了新的契机[3]。因此,积极寻找NSCLC发生、进展中相关敏感基因,对NSCLC治疗意义重大。环状RNA(circular RNA,circRNA)作为广泛存在于真核生物体内的一类带有封闭共价环的非编码RNA,可稳定的存在于生物体,不易被RNA酶降解,且具有组织表达相对特异的特点,在调控机体发育、代谢及多种疾病发生进展中发挥重要作用[4],近来发现,circRNA参与了恶性肿瘤侵袭转移及多药耐药等过程[5]。circFAT1作为一种circRNA,已被发现在结直肠癌组织及细胞系中呈高表达[6],参与了骨肉瘤发生发展过程[7]。但其与NSCLC相关性鲜有报道。该研究分析NSCLC组织中circFAT1表达,并利用小分子干扰RNA(small interfering RNA,siRNA)技术沉默人NSCLC细胞系A549中circFAT1表达,评价其对细胞生物学功能的影响。
1 材料与方法
1.1 材料
1.1.1一般资料 选取2018年3月—2020年9月在安徽医科大学第一附属医院行手术切除治疗的NSCLC患者107例,其中,男65例,女42例,年龄35~74(55.85±11.37)岁;病理学类型:鳞状细胞癌38例,腺癌69例;TNM分期:Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期50例;分化程度:低分化43例,中高分化64例;发生淋巴结转移48例。术中留取NSCLC组织及距离肿瘤边缘>5 cm的正常癌旁组织,迅速置于液氮中,-70 ℃保存。纳入标准:① 术前未行任何治疗;② 术后病理学检查确诊为NSCLC。排除标准:① 肺部严重感染者;② 继发性肺癌及其他系统恶性肿瘤者;③ 心肝肾等重要脏器严重功能障碍者;④ 临床资料不全者。本研究通过医院伦理委员会批准,所有患者均行知情同意。
1.1.2主要试剂与设备 Trizol总RNA提取试剂和Lipofectamine 2000转染试剂购自美国Invitrogen公司,逆转录和扩增试剂盒购自大连宝生物工程有限公司,circFAT1及内参引物序列由上海捷瑞生物工程有限公司设计合成,UV1800紫外分光光度计购自上海奥析科学仪器有限公司,人NSCLC细胞系A549购自南京科佰生物科技有限公司,DMEM培养液、胎牛血清、青-链霉素和胰蛋白酶购自美国Gibco公司,CCK-8试剂购自天津迈基生物科技有限公司,Transwell小室购自美国Coring公司,基质胶购自美国BD公司,Q5实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1RT-qPCR检测NSCLC和癌旁组织中circFAT1表达 取NSCLC和癌旁组织,剪碎、超声匀浆,用Trizol总RNA提取试剂提取总RNA,使用紫外分光光度计检测其纯度及浓度。按逆转录试剂盒说明进行逆转录获得cDNA,使用Q5实时荧光定量PCR仪按扩增试剂盒说明对引物扩增,序列:circFAT1:上游5′-AACAGAAGAGAACTGGGGCG-3′,下游5′-GATCAGGGTGCCAATGGTGA-3′;GAPDH:上游5′-GATCAGGGTGCCAATGGTGA-3′,下游5′-TTTCTAGACGGCAGGTCAGG-3′。反应条件:94 ℃ 2 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,连续38个循环,使用2-ΔΔCt法获得circFAT1相对表达量。
1.2.2细胞培养与转染 用含10%胎牛血清的DMEM培养液(含1%青-链霉素)对A549细胞培养,条件:5% CO2、37 ℃。待细胞密度在70%以上时,胰酶消化,接种于6孔板,每孔2.5×106个细胞,细胞融合度在80%以上时,使用Lipofectamine 2000转染试剂分别对细胞转染siRNA-circFAT1(si-circFAT1组)、无关序列(si-control组),另外设未转染细胞作为空白组(blank组)。各组处理后继续培养48 h。
1.2.3RT-qPCR术检测细胞中circFAT1表达量 取各组转染后培养48 h细胞,滴加细胞裂解液,其余步骤同“1.2.1”项下方法。
1.2.4CCK-8检测细胞增殖情况 各组在转染24 h后,胰酶消化,收集细胞,接种在96孔板,每孔2×103个细胞,在培养箱中分别于培养0、24、48、72和96 h时,向各孔加入CCK-8试剂10 μl,恒温培养4 h,用酶标仪取450 nm波长处测定各孔光密度(optical density,OD)值。
1.2.5Transwell小室检测细胞迁移和侵袭情况 取各组转染后培养48 h细胞,胰酶消化,用无血清培养液对细胞重悬,密度调整为2.5×105个/ml,取细胞悬液200 μl加到Transwell小室上室,下室则加入正常培养液600 μl,用培养箱培养24 h,弃上室培养液,PBS冲洗,4%多聚甲醛固定,PBS再次冲洗,0.5%结晶紫染色15 min,显微镜下随机取5个视野计数染色细胞数,取均数作为迁移细胞数。在检测细胞侵袭情况时,将基质胶用培养液稀释后对Transwell小室进行包被,过夜风干,其余步骤同检测细胞迁移。
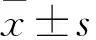
2 结果
2.1 NSCLC和癌旁组织中circFAT1表达量NSCLC组织中circFAT1相对表达量为(2.47±0.27),高于癌旁组织(1.02±0.15),差异有统计学意义(t=48.959,P<0.001)。
2.2 circFAT1在不同病理指标NSCLC组织中表达比较circFAT1在不同性别、年龄、病理学类型和肿瘤直径的NSCLC组织中相对表达量差异无统计学意义(P>0.05),与TNM分期Ⅰ~Ⅱ期、中高分化、未发生淋巴结转移比较,TNM分期Ⅲ~Ⅳ期、低分化和发生淋巴结转移的NSCLC组织中circFAT1相对表达量升高,差异有统计学意义(P<0.05),见表1。
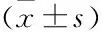
表1 circFAT1在不同病理指标NSCLC组织中表达比较
2.3 细胞中circFAT1表达量与si-control组和blank组比较,si-circFAT1组细胞中circFAT1相对表达量明显降低,差异有统计学意义(F=138.245,P<0.001),见图1。
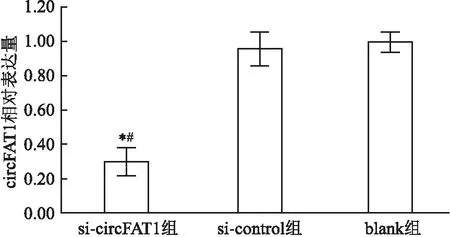
图1 三组细胞中circFAT1的相对表达量
2.4 沉默A549细胞中circFAT1表达对增殖活性的影响与si-control组和blank组比较,si-circFAT1组细胞24、48、72和96 h时OD值均降低,差异有统计学意义(P<0.05),提示沉默circFAT1表达抑制A549细胞增殖活性。见图2。
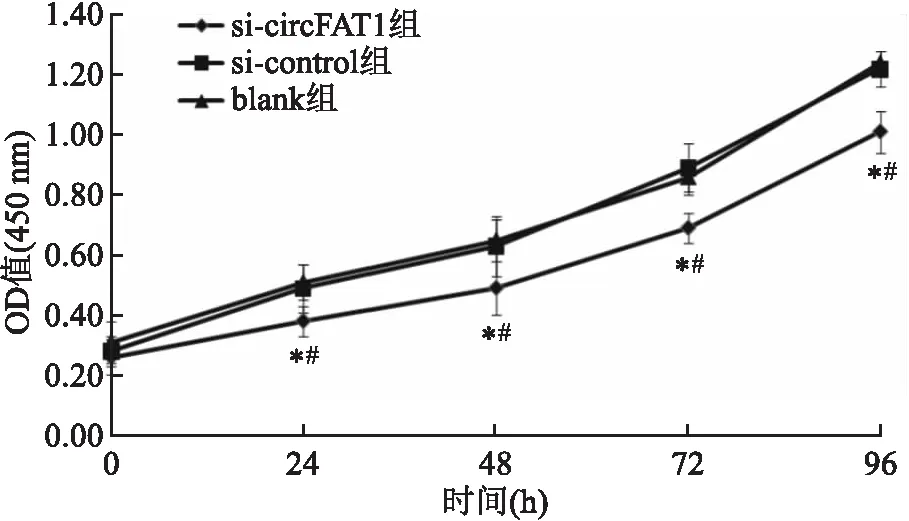
图2 沉默A549细胞中circFAT1表达对增殖活性的影响
2.5 沉默A549细胞中circFAT1表达对迁移和侵袭能力的影响与si-control组和blank组比较,si-circFAT1组迁移细胞数和侵袭细胞数减少,差异有统计学意义(P<0.05),提示沉默circFAT1表达可抑制A549细胞迁移和侵袭能力。见表2,图3、4。
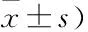
表2 三组细胞迁移和侵袭细胞数比较(个,
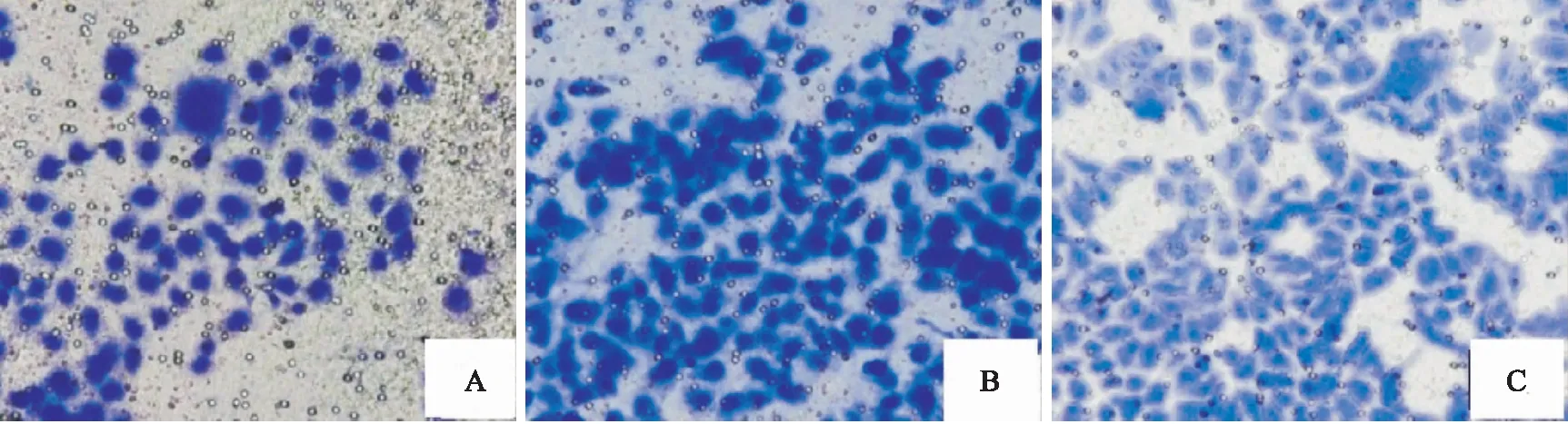
图3 Transwell法检测沉默A549细胞中circFAT1表达对迁移能力的影响 结晶紫染色×100
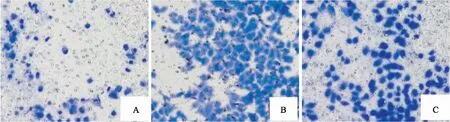
图4 Transwell法检测沉默A549细胞中circFAT1表达对侵袭能力的影响 结晶紫染色×100
3 讨论
研究[8]发现,高侵袭性和易转移是NSCLC细胞的主要特征,且是导致患者死亡的重要因素。因此,有必要针对NSCLC侵袭和转移的相关机制开展研究,以指导临床诊疗。circRNA是一类具有圆形结构且可稳定存在于细胞内的非编码RNA,参与调控了小RNA的吸附、转录和剪切,同时在核糖体RNA处理及蛋白质与蛋白质间相互作用中发挥重要作用[9]。目前,其在恶性肿瘤中的作用开始受到重视。circFAT1作为一种circRNA,研究[10]发现,其可作为结直肠癌肝转移的潜在预测指标。陈靖 等[11]报道,结直肠癌组织中circFAT1高表达且参与了癌细胞迁移和侵袭。亦有研究[12]发现,circFAT1促进了原发性肝癌进展。本研究显示,NSCLC组织中circFAT1相对表达量高于癌旁组织,提示circFAT1可能参与了肿瘤发生。本研究结果显示,TNM分期Ⅲ~Ⅳ期、低分化和发生淋巴结转移的NSCLC组织中circFAT1相对表达量较TNM分期Ⅰ~Ⅱ期、中高分化、未发生淋巴结转移明显升高,进一步说明随着NSCLC进展,circFAT1表达水平升高,提示circFAT1可能发挥癌基因功能参与了该肿瘤进展。
为进一步观察circFAT1在NSCLC发生、进展中的作用,本研究采用siRNA技术沉默A549细胞中circFAT1基因表达,结果显示,与si-control组和blank组比较,si-circFAT1组细胞中circFAT1相对表达量明显降低,表明成功构建circFAT1低表达的细胞。有研究[6]报道,circFAT1可影响结直肠癌细胞增殖、凋亡和糖酵解。Liu et al[13]报道,circFAT1参与了骨肉瘤细胞增殖、迁移和侵袭。亦有研究[14]指出,circFAT1可通过miR-873/ZEB1轴促进甲状腺癌增殖、迁移和侵袭。本研究结果显示,与si-control组和blank组比较,si-circFAT1组细胞24、48、72和96 h时OD值均降低,迁移细胞数和侵袭细胞数减少,表明沉默circFAT1可抑制A549细胞增殖、迁移和侵袭能力,提示circFAT1可能参与了A549细胞增殖、迁移和侵袭过程,

