东海外海金乌贼角质颚与内壳微结构特征及轮纹判读
方 舟,俞 骏,杨光明媚,韩霈武
东海外海金乌贼角质颚与内壳微结构特征及轮纹判读
方 舟1,2,3,4,5,俞 骏1,杨光明媚1,韩霈武1
( 1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发教育部重点实验室,上海 201306; 3.国家远洋渔业工程技术研究中心,上海 201306;4.农业农村部大洋渔业开发重点实验室,上海 201306;5.农业农村部大洋渔业资源环境科学观测实验站,上海 201306)
【目的】探究金乌贼()的日周期性,以及角质颚和内壳微结构在金乌贼年龄鉴定中的相关关系。【方法】根据2018年9月至2019年3月在东海外海海域(123°-127° E,28.0°-31.5° N)采集金乌贼132尾,对其角质颚、内壳微结构轮纹进行分析判读,并通过线性拟合、差异化比较等非分析角质颚、内壳微结构的轮纹特征,探讨两者轮纹数间及其与胴长的相关关系。【结果】金乌贼角质颚喙部切面生长纹主要分布在头盖区与侧壁区,对称分布于喙部截面纵轴的两侧,其喙部头盖区的背侧生长纹较为完整。角质颚生长纹中还存在标记轮、亚日轮以及其他特殊生长纹结构;金乌贼内壳微结构纵切面的生长纹,从顶端延续到底端,生长纹长度也随之递减。内壳与角质颚生长纹数目为56 ~ 137,二者线性相关系数= 0.947 1。内壳、角质颚轮纹数与对应样本胴长分别线性相关。【结论】金乌贼角质颚、内壳微结构与日龄线性相关,可作为年龄鉴定材料,但应根据实际情况进行选择。
金乌贼;角质颚;内壳;微结构;年龄鉴定
金乌贼()隶属于头足纲(Cephalopoda)乌贼目(Sepioidea)乌贼科(Sepiidae) 乌贼属(),主要生活在日本列岛、菲律宾群岛海域,俄罗斯远东地区,我国的南海、东海、黄渤海等海域,在乌贼科种类中,年产量位居世界第二,有生命周期较短、世代更新快、经济价值高等优点。金乌贼是北方海域经济价值较高的头足类之一,曾是黄海笼捕的重点捕捞对象以及拖网、定置网具的兼捕对象[1]。但自20世纪70年代后期起,由于过度捕捞、自然灾害频发、沿岸水环境污染等诸多因素,金乌贼卵和幼体资源被持续破坏,金乌贼资源严重匮乏,渔获量持续下降[2-4]。因此,该资源的合理开发与利用尤为重要。
探究物种群体的生长,年龄组成及结构对种群群落,生态学,资源保护、管理与利用有重要参考作用[5]。耳石是典型的沉积型硬组织,广泛应用于头足类鉴年龄鉴定[6]。但目前利用耳石进行年龄、生长研究主要是柔鱼科和枪乌贼科种类[7],它们的耳石均有同心圆结构的周期性轮纹,已用以确定头足类的准确年龄。而乌贼科耳石构造与上述种类有很大不同,耳石沉积规律不同于后者,因此,在研磨过程中难以发现耳石的核心位置,无法确定研磨平面,从而不能推算准确年龄[8]。作为耳石替代材料,角质颚已逐渐用于头足类的生长年龄鉴定,有良好的生活史信息、形态特征稳定[9],广泛应用于分类[10]、种群鉴定[11]、日龄鉴定[12]与资源评估[13]等研究。乌贼类内壳为石灰质,主要成分为碳酸钙,有类似于耳石的沉积规律,且有清晰的生长纹[14]。目前,对于乌贼年龄、生长研究较少,且选取材料相对单一,即仅用角质颚、内壳或耳石中的一种作为研究材料,往往无法相互佐证年龄正确性。
迄今,金乌贼的研究往往集中于生长特征[15]、增殖放流[16]等方面,而有关年龄生长规律等基础生物学内容,特别是对东海外海海域金乌贼的研究较少。本研究分别运用计数、差异化分析等方法分析东海外海金乌贼角质颚、内壳微结构的轮纹特征,比较二者生长纹的沉积规律,探讨角质颚微结构在乌贼科年龄估算上的可行性,为进一步了解该物种的基础生物学及渔业资源管理提供科学依据。
1 材料与方法
1.1 材料
实验用金乌贼样品132尾,于2018年9月至翌年3月,由“浙岭渔23860号”拖网渔船每月在我国东海外海海域(123°-127° E,27.5°-32° N)随机采样捕获。样品置于-20℃冷库冷冻保存,带回实验室进行分析。
1.2 方法
1.2.1 生物学测定与内壳、角质颚的提取 金乌贼样本解冻后,用电子秤称量样本体质量,精确至0.1 g。用皮尺测量胴长(mm),精确至1 mm。根据样本生殖系统特征判断金乌贼的性别[17]。
剖取完整内壳,清洗,装袋,编号,放入-20℃冰箱中保存。剖取口球中的角质颚(先取下颚,再取上颚),去除角质颚表面的其他有机成分,用纯水洗净,置于含体积分数70%乙醇溶液的50 mL离心管保存。
1.2.2 角质颚、内壳切片制作 生长纹分布在金乌贼角质颚喙部矢状切面。依据刘必林等[18]方法制备角质颚切片,包括切割、包埋、研磨和抛光。切割时仅保留与轮纹相关的角质颚喙部脊突、头盖区域,使被切平面尽量与喙部矢状切面平行。用镊子向长方形的塑料模具中放入切割的角质颚,并倒入体积比1∶1的冷埋树脂与固化剂混合液进行包埋,静置24 h,待混合液硬化。
内壳切片制备包括切割、研磨、抛光。切割时被切面与纵截面尽量保持平行,对内壳中心线及中心线右侧1 cm平行线进行标记,沿右侧标线切割。将包埋的角质颚、切割的内壳在Stuers研磨机上,从粗到细依次用120、600、1200、2400与4000型号的防水耐磨砂纸研磨,研磨过程中用电子光学显微镜观察,直至该平面显微镜下出现较为清晰轮纹结构,研磨另一面,当两面均磨至理想平面后,用0.05 μm氧化铝剂在绒布上加水混合,抛光。制备的角质颚、内壳微结构切片分别在鳞片袋中保存备用。
1.2.3 轮纹读取 对研磨至矢状切面的角质颚,利用连接有电荷耦合元件的Olympus光学显微镜拍照(100倍视野);研磨的内壳于解剖镜下,用连接有电荷耦合元件的Olympus光学显微镜拍照(1倍视野,将内壳切面每2 cm的前后标志拍入视野[19]),用Photoshop 7.0对所拍角质颚纵截面、内壳切片图片依次叠加处理,得到完整内壳、角质颚微结构照片。每张照片分别由两位不同观察者计数,当两者计数的日龄误差小于均值的10%时,该均值年龄为准确年龄,取4次计数的平均值作为其年龄[20]。
1.3 数据处理
用均值检验(-test) 法对金乌贼的上角质颚与内壳生长纹数目进行差异化分析与检验。用典型相关分析法分析金乌贼角质颚与内壳轮纹数之间的相关关系。
2 结果与分析
2.1 角质颚的微结构
图1可见,金乌贼角质颚喙部切面主要由头盖区、侧壁区及两区交汇的喙部截面纵轴组成,其中,生长纹明暗交替,主要分布在头盖区与侧壁区,位于喙部截面纵轴的两侧,呈对称分布,并由喙部顶端区域一直延伸至脊突和头盖的交汇处。此外,与鸢乌贼上角质颚色素沉着不同[21],金乌贼上角质颚中色素沉着较深的区域为头盖区与侧壁区,而在喙部截面纵轴附近沉着较浅(图1(a))。
<
(a) 上角质颚喙部矢状切面微结构;(b) 标记轮结构;(c) 亚日轮结构;(d) 异常结构
(a) the rostrum sagittal sections ofupper beak; (b) checks of upper beak microstructure; (c) sub-day increments of upper beak microstructure; (d) abnormal structure
图1 金乌贼上角质颚微结构
Fig.1 Upper beak microstructure of
越接近于角质颚喙部头盖区边缘,金乌贼生长纹越细,相邻两条生长纹间距越小。喙部纵向生长纹是角质颚喙部边缘的生长纹中平行于边缘、又细又密的轮纹;由于角质颚是摄食器官,在日常捕食中会出现角质颚腐蚀等情况,角质颚喙部前端生长纹易出现缺失、模糊等现象,无法对其进一步计数分析。金乌贼角质颚生长纹中还存在标记轮、亚日轮以及其他特殊生长纹结构:标记轮中,其暗带轮纹色素沉着相比于其他轮纹更深,或明带轮纹相比之下更浅(图1(b));亚日轮的暗带色素沉着与一般轮纹更浅(图1(c))。所取样本中还发现2尾雄性金乌贼角质颚中存在与其他喙部轮纹分布不同的特殊轮纹结构:喙部顶端出现不同于一般生长纹的扭曲现象(图1(d))。
2.2 内壳的微结构
图2可见,金乌贼内壳微结构的生长纹分布在纵切面上,从顶端延续到底端,生长纹长度也随之递减,并有明暗交替的轮纹结构(图2(a))。乌贼类石灰质内壳生长纹由一系列生长薄片叠加而成[22],且生长薄片在顶端至中部基本与其纵切面顶端平面平行,故在此范围其生长纹基本平行于顶端,而在底端及其边缘,由于内壳形状出现较大程度的弯曲,其生长薄片、生长纹随之出现弯曲(图2(b))。分析内壳纵切面生长纹发现,内壳在顶端及底端边缘生长薄片色素沉着较深,中部色素沉着较浅。此外,越接近金乌贼内壳顶端与底端边缘,其相邻生长薄片间距越小,生长纹越密(图2(c))。
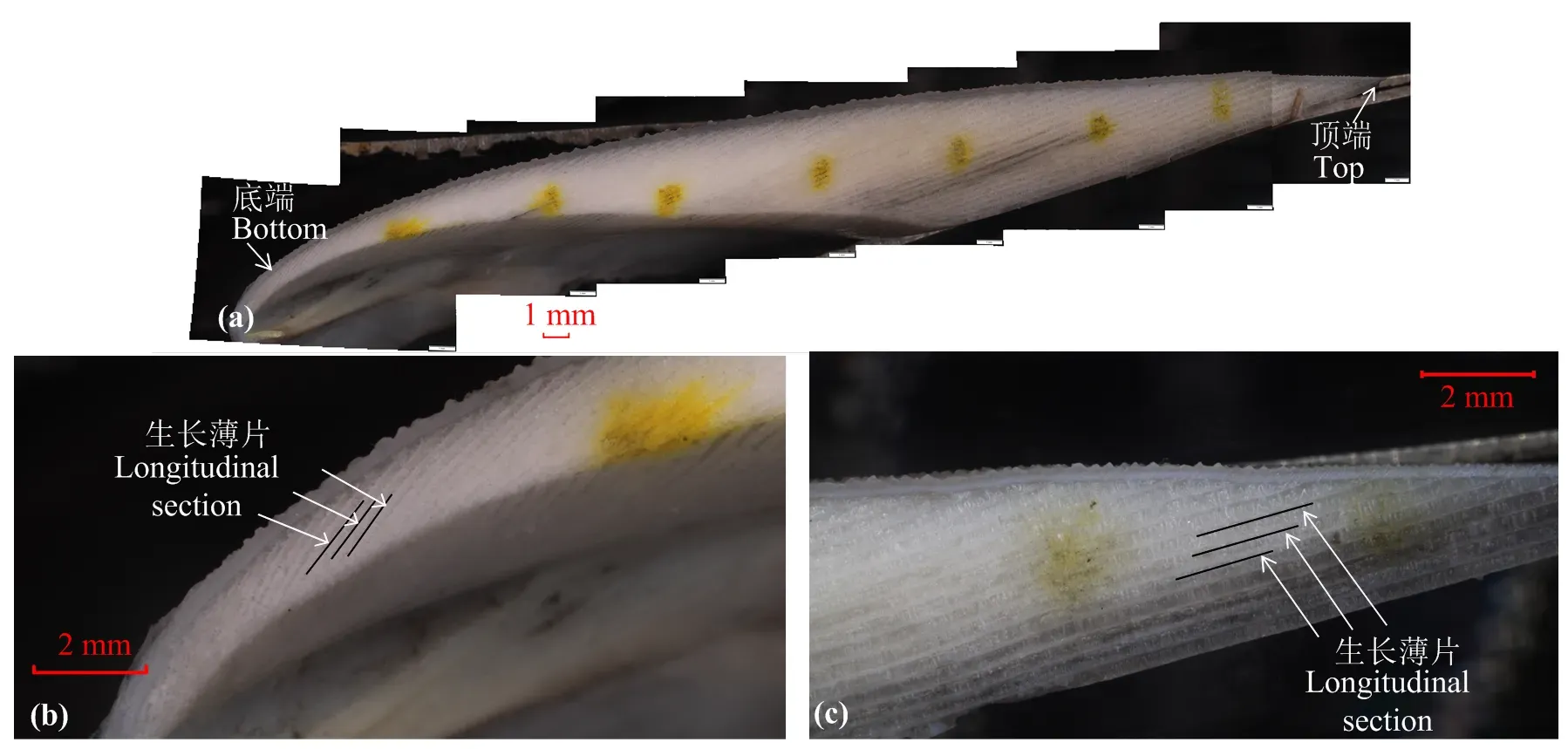
(a) 拼接内壳生长薄片纵截面;(b) 内壳顶端生长薄片纵截面;(c) 内壳底部生长薄片纵截面
2.3 内壳、角质颚微结构生长纹的比较
分析可知,132尾东海外海海域金乌贼胴长为64 ~ 162 mm,而内壳与角质颚生长纹数目为56 ~ 137。通过线性拟合发现,内壳轮纹数、角质颚轮纹数分别与对应样本胴长线性相关(图3)。对内壳、角质颚轮纹数关系进行典型相关分析、均值分析(-检验),结果表明,两者间线性相关关系= 0.947 1。通过对内壳与角质颚轮纹进行方程拟合,发现两者间线性斜率为0.979 2(图4)。

图3 金乌贼的胴长及其所对应的角质颚和内壳的轮纹数

图4 金乌贼角质颚和内壳轮纹数的关系
3 讨论
3.1 角质颚微结构
Clarke[23-24]较早提出头足类角质颚存在生长纹结构。近年来,越来越多关于乌贼类角质颚及微结构的研究。金乌贼主要生活在中下层海域,其角质颚切面翼部及侧壁的色素沉淀与其他头足类不同,色素沉着在角质颚喙部截面纵轴区域更深[25],生长纹较明显,研磨后易于观察计数。角质颚是头足类的摄食器官,在捕食等活动过程中,喙部常被外界腐蚀,由于头盖区边缘与角质颚第一生长纹的连接区域离喙部前端较近,研磨可能导致该区域生长纹丧失,不利于计数观察,但因为角质颚生长纹对称分布,通过对头盖区边缘生长纹观察计数,可消除喙部腐蚀的影响[26];喙部截面纵轴附近色素沉着较浅,研磨过程中可能出现切面偏差,导致轮纹间隔不清晰、交错重叠等,进而导致观察计数误差;侧壁区边缘轮纹由于色素沉着较深、研磨时受力不均等原因,常出现缺失,并不能清晰地观察出该区域的全部生长纹。因此,出现轮纹不清时还需通过对角质颚头盖区附近的生长纹观察计数得出。
本研究发现,金乌贼角质颚、内壳微结构普遍存在亚日轮、标记轮及特殊轮纹结构。亚日轮的形成主要由环境等因素的突变所致,并不具有日周期性、规律性的特征,故在观察时需将其与日轮加以区分。标记轮可能与温度突变、风暴等外界因素影响有关[27],因而可能会记录个体生活史信息[28]。本研究中,个别雄性金乌贼的喙部前端出现不同于一般轮纹的扭曲现象,可能是由生长过程中外界环境的改变,导致喙部前端的轮纹沉积异常所致。
3.2 内壳微结构
乌贼类内壳主要成分为石灰质,内部生长纹由诸多生长薄片叠加而成[22]。内壳纵切面呈锥状,生长纹在纵切面均匀分布,长度由顶端至底端依次递减。与角质颚相似,金乌贼内壳纵切面生长纹在顶端及底端边缘色素沉着较深,中间色素沉着较浅,加之研磨方式、研磨平面等不同,会出现内壳切面的中部生长纹不清晰的状况,对于内壳生长纹模糊区域,可由已有轮纹推算,通过顶端、底端周围较易观察的生长纹可估算该个体大致年龄,但估算易产生计数误差,影响最终结果[29]。Hermosilla等[30]研究发现,如研磨完成未及时拍照,内壳生长纹可能逐渐模糊并难以辨认,影响进一步计数、分析。
受金乌贼内壳本身形态结构的限制,顶端及周围生长薄片基本平行于该平面生长,底部生长薄片、生长纹则出现较大弯曲,越靠近底端,生长薄片弯曲程度越大。此外,受金乌贼生长、温度等环境因素的影响,越接近金乌贼内壳顶端、底端,相邻生长薄片间距越小。
3.3 角质颚、内壳微结构生长纹的比较
已证实乌贼属的科氏乌贼()[31]、西非乌贼()[14]等内壳可用作研究头足类年龄的材料,日周期性也基本得到证实。此外,Arkhipkin等[32]及Bizikov等[33]对比分析内壳与耳石生长纹后认为,内壳角质层生长纹和内壳腹面生长纹分别适用于鉴定贝乌贼()和科氏乌贼()的年龄。因此可认为,金乌贼内壳具有日周期性,可用来研究与鉴定年龄。
相比于内壳,角质颚有如下优点:处理过程相对便捷[34],形态学测量更为简单,对形态学方面的研究分析更加有利[35];受外界环境因素影响较小、生理作用对轮纹生长速率作用较小;角质颚喙部切面生长纹的产生受温度、盐度等因素的影响,可能富含该个体生活史信息[28];日周期性昼夜变化引起其有规律的生活模式也可能在角质颚上反映[36]。目前,对头足类角质颚微结构鉴定年龄与生长的研究较多[33],与内壳相比,角质颚更有利于下一步的分析。但由于捕食竞争、生境的突变等诸多因素影响,角质颚喙部前端生长纹可能缺失,产生计数误差[21];金乌贼生活在大洋中下层,导致其角质颚侧壁与翼部的色素沉着较深[25],矢状切面轮纹相较于其他头足类不明显;金乌贼角质颚中还存在亚日轮结构,观察者需对日轮与亚日轮仔细辨别,否则可能影响年龄估算的准确性[21],可通过内壳等其他年龄鉴定材料进行对比验证,使数据更加精确。内壳耐腐蚀、形态稳定,更易研磨[37]。相比于角质颚,其色素沉着影响相对较小,生长薄片更清晰易读,且已证实可通过估算等方式推算出生长纹不清晰区域的轮纹数[29]。此外,乌贼科内壳与其生活史密切相关[14];但其石灰质内壳易受生理、环境特别是温度影响,轮纹的生长速率可能改变[38],影响日周期性。此外,研磨后的内壳若不及时拍照,可能导致内壳轮纹模糊等现象,造成一定的计数误差[30]。
本研究通过典型相关性法、均值分析法(t-test)分析金乌贼内壳与角质颚轮纹数相关关系,发现二者间具有线性相关关系,相关系数2接近于1,并得出,金乌贼胴长与年龄有正相关关系,可通过胴长大小估算其年龄组成;通过角质颚、内壳微结构研究金乌贼的长发育,在本研究海域环境条件下,二者轮纹数差异不大,作为年龄生长鉴定材料均有可行性,且可相互佐证,通过对比,减少人为因素产生的计数误差。此外,本研究还认为,金乌贼角质颚轮纹沉积有日周期性。刘必林等[25]曾研究真蛸() 角质颚生长纹,结果表明实际日龄与角质颚微结构的生长纹差异不显著,证明头足类角质颚生长纹有日周期性。但由于角质颚、内壳在可获取性以及实验便捷性等方面各有优劣,在不同情况下选用乌贼科年龄鉴定材料时需考虑:在对海域温度变化较大、中下层海域的金乌贼进行研究时应优先选用内壳,对外界环境较为复杂、生活史及形态学研究时,应首选角质颚。目前,角质颚、内壳均未广泛应用于乌贼科的年龄鉴定,因此,应不断改进微结构在年龄、生活史研究中的估算、分析方法,通过轮纹分析及微化学等手段,使角质颚、内壳应用于分析乌贼科更多种类年龄及生长。
[1] 郝振林, 张秀梅, 张沛东.金乌贼的生物学特性及增殖技术[J].生态学杂志, 2007, 26(4): 601-606.
[2] 唐启升, 叶懋中.山东近海渔业资源开发与保护.北京: 农业出版社, 1990: 1-212.
[3] 王晓华.金乌贼角质颚、内壳与生长的关系及染色体研究[D].中国海洋大学, 2012.
[4] 朱志校.山东省日照市开展乌贼增殖见成效[J].中国水产, 2000(9): 51.
[5] GILLANDERS B M.Connectivity between juvenile and adult fish populations: do adults remain near their recruitment estuaries? [J].Marine Ecology Progress Series, 2002, 240: 215-223.
[6] 刘必林, 陈新军, 陆化杰, 等.头足类耳石[M].北京: 科学出版社, 2011: 23-160.
[7] 李楠, 俞骏, 方舟, 等.基于耳石日龄信息的东海海域剑尖枪乌贼日龄、生长及种群结构研究[J].水产学报, 2021, 45(6): 887-898.
[8] RAYA C P, FERNANDEZ-NUNEZ M, BALGUERIAS E, et al.Progress towards ageing cuttlefishfrom the northwestern African Coast using statoliths[J].Marine Ecology Progress Series, 1994, 114: 139-147.
[9] CLARKE M.The identification of cephalopod “beaks” and the relationship between beak size and total body weight[J].Bulletin of the British Museum (Natural History), Zoology, 1962, 8: 419-480.
[10] OGDEN R S, ALLCOCK A L, WATS P C, et al.The role of beak shape in octopodid taxonomy[J].South African Journal of Marine Science, 1998, 20(1): 29-36.
[11] BORGES T C.Discriminant analysis of geographic variation in hard structures offrom the North Atlantic[J].ICES Marine Science Symposia, 1995, 199: 433-440.
[12] RODRÍGUEZ-DOMÍNGUEZ A, ROSAS C, MÉNDEZ-LOEZA I, et al.Validation of growth increments in stylets, beaks and lenses as ageing tools in[J].Journal of Experimental Marine Biology and Ecology, 2013, 449: 194-199.
[13] JACKSON G D.The use of beaks as tools for biomass estimation in the deepwater squid(Cephalopoda: Onychoteuthidae) in New Zealand waters[J].Polar Biology, 1995, 15(1): 9-14.
[14] 瞿俊跃, 周敏华, 韩霈武, 等.基于内壳的西非乌贼日龄与生长特性[J].应用生态学报, 2021, 32(5): 1873-1880.
[15] 费云乐.日照市岚山头近海金乌贼生长特征初步研究[J].水产养殖, 2020, 41(3): 35-38.
[16] 李战军, 李伟亚, 王四杰, 等.山东省金乌贼增殖放流现状与资源养护对策[J].水产学杂志, 2019, 32(6): 64-68.
[17] GABR H R, HANLON R T, HANAFY M H, et al.Maturation, fecundity and seasonality of reproduction of two commercially valuable cuttlefish,and, in the Suez Canal[J].Fisheries Research, 1998, 36(2/3): 99-115.
[18] 刘必林, 林静远, 方舟, 等.头足类角质颚稳定同位素研究进展[J].海洋渔业, 2018, 40(2): 242-248.
[19] YATSU A, MIDORIKAWA S, SHIMADA T, et al.Age and growth of theflying squid,, in the North Pacific Ocean[J].Fisheries Research, 1997, 29(3): 257-270.
[20] CHEN X J, LU H J, LIU B L, et al.Age, growth and population structure of jumbo flying squid,, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters[J].Journal of the Marine Biological Association of the United Kingdom, 2011, 91(1): 229-235.
[21] 胡贯宇, 陈新军, 刘必林, 等.茎柔鱼耳石和角质颚微结构及轮纹判读[J].水产学报, 2015, 39(3): 361-370.
[22] LE GOFF R, GAUVRIT E, DU SEL G P, et al.Age group determination by analysis of the cuttlebone of the cuttlefishL.in reproduction in the bay of Biscay[J].Journal of Molluscan Studies, 1998, 64(2): 183-193.
[23] CLARKE M R.The identification of cephalopod beaks and the relationship between beak size and total body weight[J].Bulletin of British Museum Natural History (Zoöl), 1962, 8(10): 419-480.
[24] CLARKE M R.“Growth rings” in the beaks of the squid(Oegopsida: Onychoteuthidae)[J].Malacologia, 1965, 3: 287-307.
[25] 刘必林, 陈新军.头足类角质颚的研究进展[J].水产学报, 2009, 33(1): 157-164.
[26] PERALES-RAYA C, BARTOLOMÉ A, GARCÍA-SANTAMARÍA M T, et al.Age estimation obtained from analysis of(Cuvier, 1797) beaks: Improvements and comparisons[J].Fisheries Research, 2010, 106(2): 171-176.
[27] ARKHIPKIN A I.Statoliths as ‘black boxes’ (life recorders) in squid[J].Marine and Freshwater Research, 2005, 56(5): 573.
[28] PERALES-RAYA C, ALMANSA E, BARTOLOMÉ A, et al.Age validation inBeaks across the full ontogenetic range: beaks as recorders of life events in octopuses[J].Journal of Shellfish Research, 2014, 33(2): 481-493.
[29] DOUBLEDAY Z, SEMMENS J M, PECL G, et al.Assessing the validity of stylets as ageing tools in[J].Journal of Experimental Marine Biology and Ecology, 2006, 338(1): 35-42.
[30] HERMOSILLA C A, ROCHA F, FIORITO G, et al.Age validation in commonusing stylet increment analysis[J].ICES Journal of Marine Science, 2010, 67(7): 1458-1463.
[31] ARKHIPKIN A I.Age of the micronektonic squid(Cephalopoda: Pyroteuthidae) from the central-east Atlantic based on statolith growth increments[J].Journal of Molluscan Studies, 1997, 63(2): 287-290.
[32] ARKHIPKIN A I, SHCHERBICH Z N.Thirty years' progress in age determination of squid using statoliths[J].Journal of the Marine Biological Association of the United Kingdom, 2012, 92(6): 1389-1398.
[33] BIZIKOV V A, JEREB P, RAGONESE S, et al.Squid age determination using statoliths: Proceedings of the international workshop held in the istituto di della pescae del pescato[J].Fisheries Science, 1991, 1: 39-51.
[34] 韩霈武, 王岩, 方舟, 等.基于硬组织微化学技术的头足类洄游特征研究进展[J].广东海洋大学学报, 2021, 41(4): 142-152.
[35] 梁佳伟, 彭苗苗, 陈新军, 等.北太平洋2种鱿鱼类角质颚生长特性及其种类判别[J].上海海洋大学学报, 2021, 30(3): 546-554.
[36] 刘必林, 陈新军, 方舟, 等.利用角质颚研究头足类的年龄与生长[J].上海海洋大学学报, 2014, 23(6): 930-936.
[37] CHOE S.Daily age markings on the shell of cuttlefishes[J].Nature, 1963, 197(4864): 306-307.
[38] 刘必林, 陈新军, 李建华.内壳在头足类年龄与生长研究中的应用进展[J].海洋渔业, 2015, 37(1): 68-76.
Microstructure of Beak and Cuttlebone and Determination of Growth Increments foroff Coast of East China Sea
FANG Zhou1,2,3,4,5, YU Jun1, YANG Guang-ming-mei1, HAN Pei-wu1
(1.201306,; 2.,,,201306,; 3,,201306,; 4.,,201306,; 5,,201306,)
【Objective】To explore the correlation between the diurnal periodicity and the microstructure of upper beaks and cuttlebones in determining the age of.【Method】132 upper beaks and cuttlebones were extracted based on of the data from fishing vessels in the East China Sea (123°–127° E, 28°–31.5° N) from September 2018 to March 2019.Byembedding and grinding methods, the growth increments was determined.The differences were also studied by stimulation of mathematical model and differentiation comparison.【Result】The growth increments ofwere mainly distributed in lateral wall and hood region of upper beaks, which were symmetric distribution in the internal rostral axis.The increments in the dorsal region of the beak’s hood were more complete.Besides, checks, sub-day increments and other abnormal structures could be found.The increments of cuttlebones occurred from bottom to top, with the length decreasing.The amount of growth increments on the upper beaks and cuttlebones ranged from 56 to 137.In addition, values ofequaled 0.947 (or use 0.95).Number of beak and cuttlebone increments are linearly correlated with the mantle length .【Conclusion】The upper beak had the diurnal periodicity, there was a linear correlation between the cuttlebone and upper beak when referring to the number of growth increments.Based on the results, the upper beaks and cuttlebones are better determining materials that can be used to determinethe age and growth.of
; beak; cuttlebone; microstructure; age determining
Q954.5;Q959.216+.1
A
1673-9159(2022)02-0046-07
10.3969/j.issn.1673-9159.2022.02.006
2021-09-16
国家重点研发计划(2019YFD0901404);国家自然基金面上项目(NSFC41876141);农业部外海渔业开发重点实验室开放课题 (LOF 2021-01)
方舟(1988―),男,博士,讲师,研究方向为头足类渔业生物学。E-mail: zfang@shou.edu.cn
方舟,俞骏,杨光明媚,等.东海外海金乌贼角质颚与内壳微结构特征及轮纹判读[J].广东海洋大学学报,2022,42(2):46-52.
(责任编辑:刘庆颖)

