镉污染条件下水稻对假单胞菌TCd-1微生物修复的生理响应
文欢欢,郑新宇,2,肖清铁,2,汪敦飞,律其鑫,韩博伦,王玉洁,樊荣荣,游 武,郭尤睿,钱 鑫,林瑞余,2,*
1 福建省农业生态过程与安全监控重点实验室,福建农林大学生命科学学院, 福州 350002 2 作物生态与分子生理学福建省高校重点实验室,福建农林大学, 福州 350002
镉(Cd)是一种人体非必需的元素,具有潜在的“致癌、致畸、致突变”效应,极易通过食物链进入人体并富集,从而危害人体健康[1]。据《全国土壤污染状况调查公报》显示,我国耕地土壤重金属污染点位超标率高达15.5%,其中镉的点位超标率约为7%,居重金属首位[2]。此外,水稻是我国主要粮食作物之一,但有研究表明,部分地区市售大米近10%存在镉超标,已引起人们的高度关注[3]。稻米镉超标与我国农田土壤镉污染比较突出密切相关,利用物理、化学、生物及其复合技术修复镉污染土壤,降低稻米镉含量,将为建立安全的水稻生产系统奠定基础。

1 材料与方法
1.1 试验材料
供试菌株为镉耐性的假单胞菌(Pseudomonassp.)TCd-1(专利号:CN103952333A)[18],是课题组前期从水稻品种“PI312777”的根际土壤筛选得到,保藏于武汉大学中国典型培养物保藏中心(保存号:CCTCC M2013649)。菌悬液培养条件:牛肉膏0.5%,酵母粉1.0%,氯化镁0.5%,pH 6.3,温度33℃,接菌量1.25%,转速160 rpm,培养24 h后用于接种。接种前取菌悬液100 mL分次在4℃、12000 rpm下离心15 min,去上清液,菌株沉淀物用无菌水稀释至100 mL,稀释后的菌液浓度测定为(5.33±0.24)×1010个/mL。
镉高耐性水稻“特优671”和镉低耐性水稻“百香139”是课题组前期从238份近年我国主栽的水稻品种中筛选得到。供试水稻的种子用2.0%的次氯酸钠溶液浸泡消毒30 min后,置于30℃恒温培养箱培养至种子露白(期间定期补水),然后均匀播于沙盘中,待水稻长至3叶1心期时,选取长势一致水稻用于盆栽试验,每盆移栽水稻秧苗1株。
盆栽土壤取自福建农林大学水稻实验田,土壤镉含量为0.18 mg/kg,土壤经自然风干、研磨,过筛2 mm后,分装于(直径18 cm,高15 cm)的深色塑料盆钵中,每盆2.5 kg,施入氮肥(以纯N计)150 mg/kg、磷肥(以P2O5计)100 mg/kg、钾肥(以K2O计)100 mg/kg,并在盆栽前进行10 mg/kg镉添加处理,土壤混匀,保持水深2—3 cm,每日搅动1次,陈化4周后用于水稻栽培。
1.2 盆栽管理与采样
盆栽试验于2019年3月至8月在福建农林大学生命科学学院玻璃房进行,设置4种处理:(1)CK:不加镉、不接种假单胞菌TCd-1(2)Cd10:添加10 mg/kg镉;(3)CKB:未加镉,接种假单胞菌TCd-1;(4)Cd10B:添加10 mg/kg镉,接种假单胞菌TCd-1。各处理5次重复。在移栽水稻返青后,进行接种,接种量20 mL/kg(即2%)。盆栽期间定期浇水,保持桶里水量高于土面2—3 cm,以保证水稻正常生长。在分蘖期、抽穗期、成熟期分别测定水稻的株高、净光合速率;在抽穗期测定水稻根系活力、叶绿素含量、叶片抗氧化酶活性与抗氧化物质含量、MDA与超氧阴离子含量;在成熟期测定水稻各部位的镉含量。
1.3 测定方法
1.3.1水稻株高、生物量及净光合速率的测定
在水稻分蘖期、抽穗期、成熟期,采用精度0.1 cm的直尺测定水稻株高;在成熟期将水稻全株取出后,用去离子水洗净根部,再用吸水纸吸干,将样品分为根、茎和叶三部分,置于烘箱105℃杀青0.5 h后,转至72℃烘至恒重,测定其干重,生物量为根、茎、叶干重之和,3次重复。净光合速率(Net photosynthetic rate,Pn)采用LI—6400便携式光合测定仪(LI—COR公司,美国)测定,5次重复。
1.3.2根系活力和叶绿素含量测定
根系活力采用四氮唑(TTC)染色法测定[19],结果以TTC还原量(mg h-1g-1FW)表示,测定3次重复。叶绿素含量采用分光光度法测定[20]。
1.3.3抗氧化酶活性测定


1.3.4类黄酮和总酚含量测定
类黄酮含量测定采用甲醇提取和分光光度法[26]。准确称取新鲜去中脉水稻叶片0.5 g,加5 mL含1% HCl的甲醇溶液(甲醇∶水∶盐酸=79∶20∶1),反应30 min后,4℃提取24 h,取0.5 mL提取液,稀释、定容至25 mL,在325 nm处比色测定吸光度(OD)值;总酚含量测定以没食子酸标准曲线,再由280 nm处的OD值计算求得。总酚、类黄酮含量均以鲜重表示。
1.3.5水稻镉含量的测定
镉含量测定利用原子火焰分光光度法进行[27]。在成熟期,将水稻整株取出后,先用自来水冲洗根部土壤,再用去离子水洗净,用吸水纸吸干后,将样品分为根、茎、叶、糙米4个部位,装入信封,置于烘干箱105℃杀青1 h后,72℃烘干48 h,样品用玛瑙研钵研碎,过100目筛,待测。
1.4 数据处理与统计分析
采用Excel 2010和SPSS 22.0软件对数据进行统计分析。采用单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较(P=0.05)。图表中数据为平均值±标准差。
2 结果与分析
2.1 假单胞菌TCd- 1对镉污染水稻各器官镉含量的影响
结果表明,不同处理“特优671”各部位的镉含量高低为:根>茎>叶>糙米,不加镉处理“百香139”表现为:叶>茎>根>糙米,加镉处理的为:茎>根>叶>糙米;水稻不同部位的镉含量在不同处理间均表现为:Cd10>Cd10B>CKB≈CK(表1)。在镉处理下,“特优671”根、茎、叶、糙米的镉含量分别为35.72、9.69、4.34、0.84 mg/kg,接种菌株后依次下降了30.5%、39.1%、40.7%、29.2%(P<0.05);“百香139”的分别为13.18、31.26、6.57、1.33 mg/kg;接种菌株后,依次下降了52.2%、51.7%、18.4%、38.8%(P<0.05)。可见,假单胞菌TCd-1处理后能够显著降低Cd10处理水稻中各器官的镉含量(P<0.05)。

表1 不同处理水稻的镉含量
2.2 假单胞菌TCd-1对镉污染水稻株高和生物量的影响
如图1所示,在分蘖期,CKB处理“特优671”、“百香139”的株高分别为58.70、48.70 cm依次比CK处理提高了7.1%、20.3%;Cd10B处理的株高分别为41.33、35.66 cm,依次比Cd10处理提高了10.6%、17.1%。在抽穗期,CKB处理“特优671”、“百香139”的株高分别为94.19、88.33 cm,依次比CK处理提高了8.4%、15.0%,Cd10B处理的株高分别为88.59、81.89 cm,依次比Cd10处理高10.2%、4.8%。在成熟期,CKB处理“特优671”、“百香139”的株高分别为101.77、98.40 cm,依次比CK处理提高了11.9%、7.5%,Cd10B处理的株高分别为92.18、95.23 cm,依次比Cd10处理高6.7%、12.3%。加菌处理后“特优671”的生物量无显著性差异;CKB、Cd10B处理“百香139”的生物量分别显著增加了29.72%,29.90%(图1)。可见,镉污染抑制了不同镉耐性水稻株高的生长,降低其生物量,接种菌株可显著缓解镉污染的抑制作用。
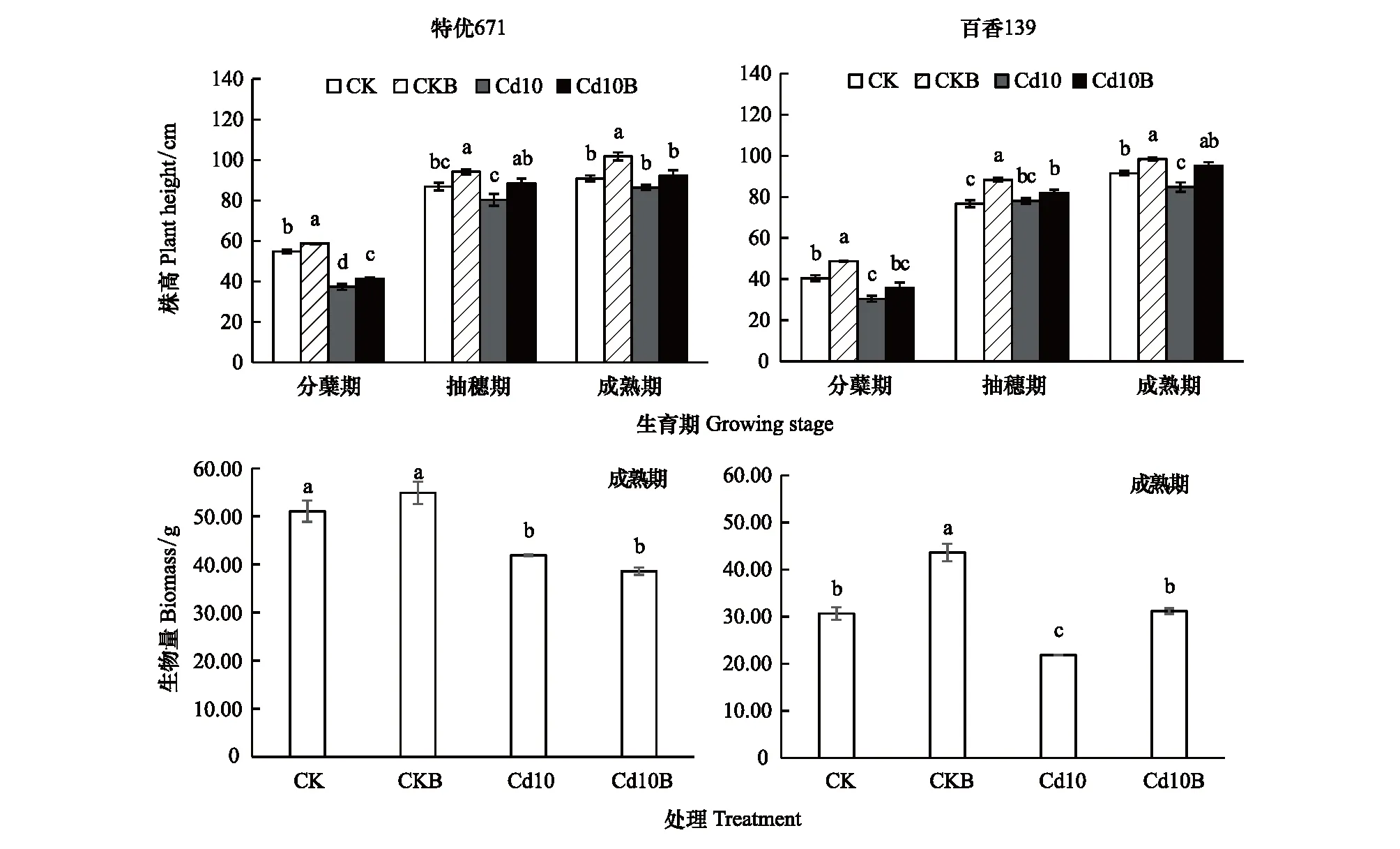
图1 不同处理水稻“特优671”、“百香139”的株高和生物量
2.3 假单胞菌TCd-1对镉污染水稻根系活力和叶片净光合速率(Pn)的影响
CKB处理“特优671”和“百香139”的根系活力分别为0.874、1.196 μg g-1h-1,依次比CK处理提高了9.3%、8.8%;Cd10B处理的根系活力分别为0.779、1.015 μg g-1h-1,依次比Cd10处理提高了3.5%、20.3%(图2)。CKB处理“特优671”和“百香139”的Pn分别为23.1、23.7 μmol m-2s-1,依次比CK处理提高了7.9%、33.1%;Cd10B处理的Pn分别为22.8、17.0 μg g-1h-1,依次比Cd10处理提高了53.0%、63.5%(图2)。可见,镉污染降低了水稻的根系活力和Pn,接种菌株显著提高镉污染水稻的根系活力和光合作用能力。

图2 不同处理水稻的根系活力和净光合速率
2.4 假单胞菌TCd-1对镉污染水稻叶片叶绿素含量的影响
如图3所示,CKB处理“特优671”的叶绿素a(Chlorophyll a,Chla)、叶绿素b(Chlorophyll b,Chlb)含量及叶绿素a/叶绿素b(Chlorophyll a/Chlorophyll a,Chla/Chlb)分别为2.26 mg/g、3.57 mg/g、0.64,依次比CK处理高48.2%、37.0%和8.2%;Cd10B处理“特优671”的Chla、Chlb含量及Chla/Chlb分别为2.23 mg/g、3.34 mg/g、0.67,依次比CK处理高262.1%、224.8%和11.6%。CKB处理“百香139”的Chla、Chlb含量及Chla/Chlb分别为1.53 mg/g、2.79 mg/g、0.55,依次比CK处理高出21.2%、28.6%和-6.2%;Cd10B处理“百香139”的Chla、Chlb含量及Chla/Chlb分别为1.22 mg/g、2.14 mg/g、0.57,依次比CK处理高34.3%、31.8%和2.3%。可见,接种菌株能够显著提高水稻的Chla、Chlb含量并调节Chla/Chlb,缓解镉污染对叶片叶绿素的伤害。

图3 不同处理水稻抽穗期叶绿素a含量、叶绿素b含量、叶绿素a/叶绿素b
2.5 假单胞菌TCd-1对镉污染水稻叶片抗氧化酶系统的影响
“特优671”和“百香139”叶片的MDA含量均以Cd10处理最高,分别为1.58、1.95 μmol/g,CdB10处理的分别为0.97、1.39 μmol/g,依次比Cd10处理降低了38.5%、28.9%,CKB处理与CK处理间无显著差异(图4)。Cd10B处理“特优671”叶片的SOD、POD、CAT活性分别比Cd10处理高出7.3%、82.0%、58.8%,CKB处理的POD、CAT活性比CK处理提高了53.8%、36.8%;Cd10B处理“百香139”叶片的SOD、POD、CAT活性分别比Cd10处理高出138.5%、106.2%、172.7%,CKB处理SOD、POD、CAT活性依次比CK处理高出17.8%、12.5%、29.4%(图4)。可见,Cd10处理显著降低了水稻叶片的抗氧化能力,增强了膜质的过氧化作用,接种菌株表现出显著的缓解镉胁迫效应。
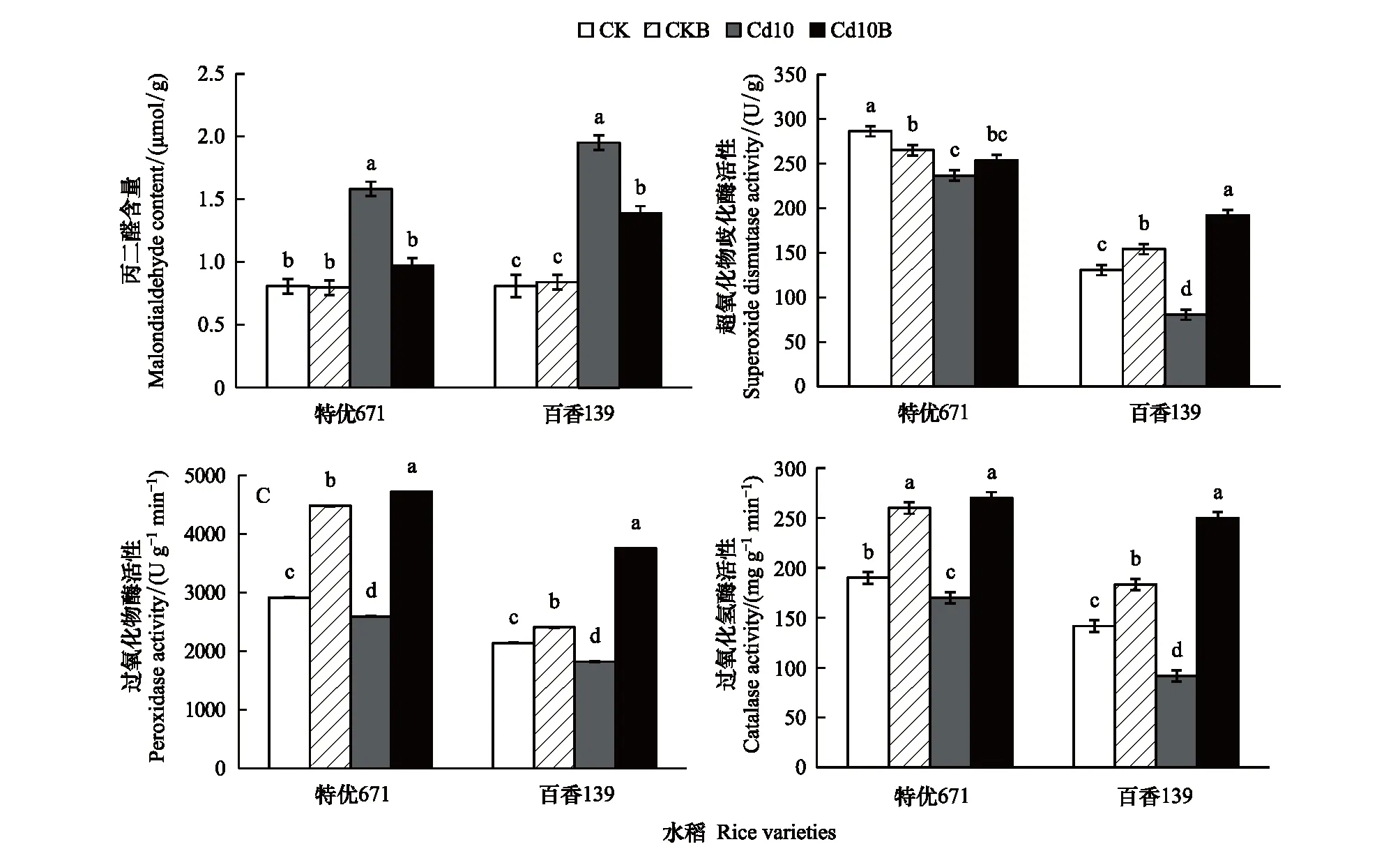
图4 不同处理水稻叶片MDA含量、SOD活性、POD活性、CAT活性
2.6 假单胞菌TCd-1对抽穗期水稻叶片类黄酮、总酚和含量的影响


图5 不同处理水稻抽穗期类黄酮含量、总酚含量含量
3 讨论
3.1 假单胞菌TCd- 1降低了成熟期水稻的镉含量
已有研究表明,一些耐重金属的细菌可通过细胞壁吸附、胞外沉淀和螯合、胞内累积和转化、以及抗氧化系统等作用,缓解重金属污染对植物的毒害作用[5]。刘悦畅等[28]在农田土壤中添加沼泽红假单胞菌(Rhodopseudanonaspalustris)和枯草芽孢杆菌(Bacillussubtilis)菌液,发现添加的微生物能够促进小白菜的生长,其主要作用途径为添加的菌液降低了土壤中镉的生物有效性,小白菜对镉的吸收减少,减轻了镉毒害;李晴晴等[29]发现施用解淀粉芽孢杆菌(Bacillusamyloliquefaciens)FH-1菌剂可显著促进大田种植水稻的生长;陆仲烟等[30]发现伯克氏菌(Burkholderiasp.D54)能显著提高10 mg/L镉处理水稻根的鲜重。赵树民等[31]发现巨大芽孢杆菌(Bacillusmegaterum)LY02对镉和铜污染土壤修复具有作用,能够显著促进黑麦草的生长。本研究发现假单胞菌TCd-1可显著减少不同镉耐性水稻对镉的吸收,这与其分离自水稻根际土壤,能够成功在水稻根际,并且具有极强的镉耐性及镉富集能力有关。同时它是一种具有较强的根际集群能力的植物根际促生菌[17],还可能代谢产生铁载体、分泌植物抗病物质及生长调节物质等,从而调解了水稻的生长[14,32—33]。
3.2 假单胞菌TCd-1通过提高水稻根系活力和光合作用促进镉胁迫水稻的生长
研究表明,镉污染可破坏叶绿素等光合色素的合成,改变Chla/Chlb,造成PSI、PSⅡ和捕光色素—蛋白质复合体的解体或抑制其光合作用蛋白的形成,从而影响光合作用能量传递链上的电子传递等过程[13]。Cd2+进入植物细胞后还能取代叶绿体中存在的Fe2+、Zn2+、Mg2+等二价阳离子,并与叶绿体中相应的蛋白结合,如含—SH的蛋白,导致叶绿体结构破坏,抑制叶绿素前体复合物合成,促进叶绿素降解,降低植物叶绿素含量和光合作用[14]。同时,已有研究表明假单胞菌属的菌株可分泌铁载体与重金属Cd2+、Pb2+和Zn2+等结合形成稳定的复合物,降低土壤中重金属的浓度,缓减重金属对植物根系的毒害作用,促进植株生长[15]。李文华等[34]研究发现,卡伍尔链霉菌TJ430(StrptomycescavourensisTJ430)和荧光假单胞菌P32(PseudomonasfluorescensP32)能显著提高分蘖期水稻的叶绿素含量,降低水稻的镉含量,有利于水稻生长。本研究表明,接种菌株显著提高了在镉污染水稻“特优671”和“百香139”的根系活力、Pn、Chla以及Chlb含量,有效地缓解了镉污染对不同镉耐性水稻的光合抑制作用。这与菌株能够改变根际土壤镉的生物有效性,抑制水稻对镉的吸收、降低根际土壤的镉毒性,减少镉自根系向地上部迁移,进而减轻镉对叶绿体的破坏,提高叶绿素含量,增强了光合作用有关。也可能与菌株通过增强次生代谢物(如植物生长素、解毒物质等)直接或间接促进根系生长、增强根系活力,促进了叶绿素合成,诱导水稻镉抗性增强有关。
3.3 假单胞菌TCd-1通过提高水稻抗氧化系统能力及抗氧物质含量,增强了水稻镉耐性


