人工栽培和野生羊肚菌游离氨基酸主成分分析及综合评价
范婷婷,赵晓燕,李晓贝,张艳梅,李健英,周昌艳
(上海市农业科学院农产品质量标准与检测技术研究所,农业农村部食用菌产品质量监督检验测试中心(上海),上海 201403)
羊肚菌(Morchella esculenta)是一种珍稀名贵的食、药两用真菌,由于其菌盖表面有不规则多面凹陷皱褶,状如羊肚,故名羊肚菌[1]。羊肚菌风味独特、味道鲜美且营养丰富,富含多糖、呈味氨基酸、微量元素、黄酮类等功能成分,具有抗氧化[2-3]、调节机体免疫力[4-5]、抗肿瘤[6]、缓解应急性疲劳[7-8]等功效,在保健品开发方面具有广阔的应用前景。
近年来,培育技术的不断突破基本实现了羊肚菌的大面积室外栽培和商业化生产,一定程度上缓解了因产量低、采集困难而导致的野生羊肚菌市场价格昂贵的现状。随着羊肚菌产量的突破,其滋味品质成为关注重点。游离氨基酸(free amino acids,FAAs)占总氨基酸的25%~35%,是一类重要的味觉活性成分,各种FAAs都有其独特的滋味,如鲜味、甜味、苦味及无味等,其含量会直接影响食物的鲜美程度[9-10]。FAAs中谷氨酸是重要的鲜味氨基酸,对羊肚菌的呈鲜作用贡献较大[11]。刘兴勇等[12]仅对云南省羊肚菌的FAAs含量进行测定,发现云南省不同产地间的人工栽培羊肚菌FAAs含量无显著差异,野生较人工栽培羊肚菌鲜味突出。
主成分分析(principal component analysis,PCA)是用较少的变量反映原始数据的多元统计方法[13]。目前PCA已广泛用于食用菌品质的综合评价,Sun Liping等[14]通过PCA对13 种野生食用菌FAAs进行综合评价,发现野生食用菌特征性FAAs的含量高低对食用菌的风味具有直接的影响。Dong Meng等[15]采用PCA发现10 个不同产地、季节和品种的干香菇中FAAs和5′-核苷酸的含量存在显著差异,这为香菇品种和产地的快速鉴别和质量评估提供参考。段静怡等[16]通过PCA达到了对4 种食用菌和4 种果蔬的显著区分和快速鉴别。
目前羊肚菌在我国云南、四川、甘肃、河南、吉林、辽宁等多地实现人工栽培,但受不同海拔、温湿度、光照、土壤环境和外源营养等因素影响,常表现为地域差异大,出菇稳定性差、产量低等特点[17-18],而这些环境因素对羊肚菌滋味成分也会产生影响[19]。本实验拟通过对云南、四川、吉林、甘肃的人工栽培和野生羊肚菌FAAs组成及含量进行分析,并对呈味氨基酸的滋味活性值(taste active value,TAV)进行比较,采用PCA法和聚类分析法进行综合评价,旨在为人工栽培和野生羊肚菌的地域间差异、营养价值及滋味比对提供参考。
1 材料与方法
1.1 材料与试剂
人工栽培羊肚菌每个省份3 份,共12 份,均为黑羊肚菌支系的六妹羊肚菌(Morchella sextelata),由各省份的野生羊肚菌培育驯化后栽培,样品信息见表1。野生羊肚菌每个省份3 份,共12 份,样品信息见表2。
氨基酸混合标准溶液、茚三酮显色液(均为色谱纯)日本Wako公司;氨基酸自动分析仪所用缓冲液(色谱纯) 日本Mitsubishi公司;盐酸、氢氧化钠(均为优级纯) 国药集团化学试剂有限公司;磺基水杨酸(优级纯) 西格玛奥德里奇(上海)贸易有限公司。
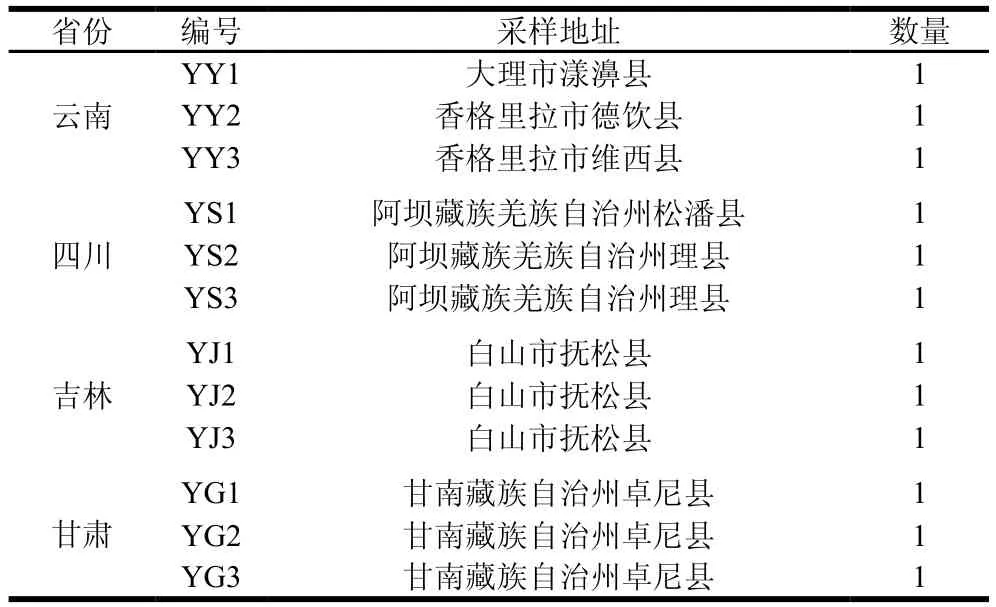
表2 不同省份野生羊肚菌样品信息Table 2 Sample information of wild Morchella collected from different provinces
1.2 仪器与设备
L-8900氨基酸自动分析仪 日本Hitachi公司;N-EVAP112氮吹仪 美国Organomation公司;5424R高速冷冻离心机 德国Eppendorf公司;YCQ-300超声波清洗机 上海凯波超声设备有限公司;AL204-IC电子天平梅特勒-托利多仪器(上海)有限公司;FD5-3T冻干机金西盟(北京)仪器有限公司。
1.3 方法
1.3.1 FAAs含量测定
羊肚菌在-50 ℃冷冻干燥24 h,冻干后打成粉末,密封保存。准确称取样品0.3 g(精确至0.000 1 g),加入30 mL 0.1 mol/L盐酸溶液(优级纯),40 ℃超声30 min,冷却至室温后于10 000 r/min离心5 min。取上清液1 mL,以1∶1的比例加入5%磺基水杨酸溶液混合,混合液4 ℃放置30 min后,4 ℃、12 000 r/min离心30 min。取上清液加1 滴10 mol/L氢氧化钠溶液调节pH值至2.0左右,过0.22 μm水系微孔滤膜,由氨基酸自动分析仪测定FAAs含量。
1.3.2 仪器检测条件
采用离子交换色谱-茚三酮柱后衍生法测定样品中FAAs。阳离子交换柱(4.6 mm×60 mm);柱温57 ℃,检测器温度135 ℃;缓冲溶液流速0.40 mL/min,茚三酮流速0.35 mL/min;检测波长:第1通道波长570 nm,测定17 种氨基酸,第2通道波长440 nm,测定脯氨酸;进样量20 μL,每个样品分析时间约30 min。
1.4 数据分析
1.4.1 数据统计
采用Excel 2016软件计算FAAs数据的平均值、标准差及雷达图。采用SPSS Statistics 19软件通过单因素方差分析(analysis of variance,ANOVA)进行显著性分析,分析方法为Duncan多重范围检验,P<0.05,差异显著。
1.4.2 TAV分析
TAV是样品中呈味物质的测定值与其滋味阈值之比,按下式计算[20]:
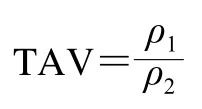
式中:ρ1为呈味氨基酸含量/(mg/g);ρ2为该氨基酸滋味阈值/(mg/g)。
TAV可反映单一化合物对整体滋味的贡献,当TAV>1时,认为该物质对呈味有贡献,而TAV<1时,认为该物质对呈味贡献较小,由此确定羊肚菌主要的呈味氨基酸[21]。
1.4.3 适应性检验
采用SPSS Statistics 19软件中Pearson分析法进行相关系数矩阵直接检验,根据相关系数矩阵中相关系数反映的原始变量之间的线性相关程度进行适用性检验。
1.4.4 PCA及综合评价
采用SIMCA 13.0软件进行PCA,比较不同省份人工栽培和野生羊肚菌FAAs的差异,得到原始数据相关系数矩阵的特征值、方差贡献率、成分矩阵及成分得分系数矩阵等,抽取特征值大于1.00的因子作为PC。利用PC信息对不同省份人工栽培和野生羊肚菌进行综合评价,以每个PC对应特征值的方差贡献率βi(i=1,2,…,k)为权数,乘以各PC得分Fi,加和得到综合评价模型:F=β1F1+β2F2+…+βkFk[22-23]。
1.4.5 聚类分析
根据8 类不同省份人工栽培和野生羊肚菌中FAAs组成及含量测定结果,采用SPSS Statistics 19软件进行聚类分析。
2 结果与分析
2.1 人工栽培和野生羊肚菌FAAs含量差异
对于人工栽培羊肚菌,云南和四川的出菇时间为2—4月,以大田轮作的方式种植玉米、水稻等经济作物,而吉林和甘肃的出菇时间稍晚,为4—5月,以大棚独立栽培为主。野生羊肚菌的生长期受气候条件影响,与其生长地区降雨时间的早晚、降雨量和气温密切相关,一般在高湿、低温条件下易萌发子实体,因此野生羊肚菌子实体的生长季节一般在每年3—6月[24]。
本实验对来自云南、四川、吉林和甘肃的人工栽培和野生羊肚菌FAAs组成及含量进行比较,野生羊肚菌检测到18 种FAAs,但人工栽培羊肚菌中Trp和Pro未检出,结果见表3。由表3可知,人工栽培和野生羊肚菌在不同氨基酸存在差异,野生羊肚菌中Met、Phe、Asp、Glu、Tyr、His的含量均大于人工栽培羊肚菌,只有Lys、Arg的含量均小于人工栽培羊肚菌。来自不同省份的人工栽培羊肚菌FAAs总量差异较大,吉林省的含量最高,为43.07 mg/g,四川省的含量最低,为20.77 mg/g。同省份间野生羊肚菌FAAs总量差异相对小,在29.04~35.48 mg/g之间,其中甘肃省的含量最高,吉林省的含量最低。同一省份人工栽培和野生羊肚菌进行对比,吉林省羊肚菌FAAs总量相差最大,且人工栽培>野生,其余省均为野生大于人工栽培。相关研究表明,栽培料配方、土壤环境等因素对羊肚菌品质影响较大[25-27],但是否引起人工栽培和野生羊肚菌氨基酸差异的主要因素有待进一步研究。
2.2 人工栽培和野生羊肚菌FAAs滋味评价
FAAs是食品中的主要呈味基础物质之一,根据FAAs滋味特征,可将其分为鲜味氨基酸(Glu、Asp、Lys)、甜味氨基酸(Ala、Thr、Ser、Gly、Pro、His)、苦味氨基酸(Arg、Val、Met、Ile、Leu、Trp)和芳香族氨基酸(Phe、Tyr、Cys)四大类[28]。食用菌的鲜美滋味是由不同呈味FAAs之间的平衡及相互影响决定,对食用菌风味具有重要作用。

表3 不同省份人工栽培和野生羊肚菌FAAs组成及含量比较Table 3 Comparison of composition and content of free amino acids between cultivated and wild Morchella from different provinces mg/g
对来自云南、四川、吉林和甘肃的人工栽培和野生羊肚菌FAAs的TAV进行评价,结果见表4,并通过雷达图对呈味FAAs的含量进行比对,见图1。从呈味氨基酸比较看,甜味氨基酸和苦味氨基酸含量较高,鲜味氨基酸其次,芳香族氨基酸最少。吉林人工栽培羊肚菌的甜味氨基酸、苦味氨基酸和芳香族氨基酸的总含量均最高,云南野生羊肚菌的鲜味氨基酸含量最高。由表4和图1可知,野生羊肚菌的鲜味氨基酸TAV显著高于人工栽培羊肚菌,其中Glu的TAV最高,野生羊肚菌TAV在13.75~17.79之间,人工栽培羊肚菌TAV在5.28~11.02之间。Yamaguchi等[30]研究发现Glu和Asp是鲜味的基本组成成分,Glu的鲜味最强,呈味阈值为0.3 mg/mL,它是味精中的主要成分,能呈现出较强的鲜味。甜味氨基酸中除了吉林省,其余省份的野生羊肚菌的甜味氨基酸总含量都大于人工栽培羊肚菌,其中Ala的TAV最高且在人工栽培和野生羊肚菌之间差别较大。甜味氨基酸不仅能掩盖苦涩味,同时能与鲜味氨基酸协同作用,起到增香增鲜的效果[31]。苦味氨基酸中Arg的TAV最高,其呈味作用均为野生小于人工栽培。芳香族氨基酸中Phe和Tyr的呈味作用均为野生大于人工栽培。野生羊肚菌鲜味氨基酸+甜味氨基酸的相对含量大于人工栽培羊肚菌并大于50%。通过FAAs的呈味作用,发现野生比人工栽培羊肚菌味道鲜美,相关研究结果与之相吻合[12]。

表4 不同省份人工栽培和野生羊肚菌FAAs的TAVTable 4 TAVs of free amino acids in cultivated and wild Morchella from different provinces
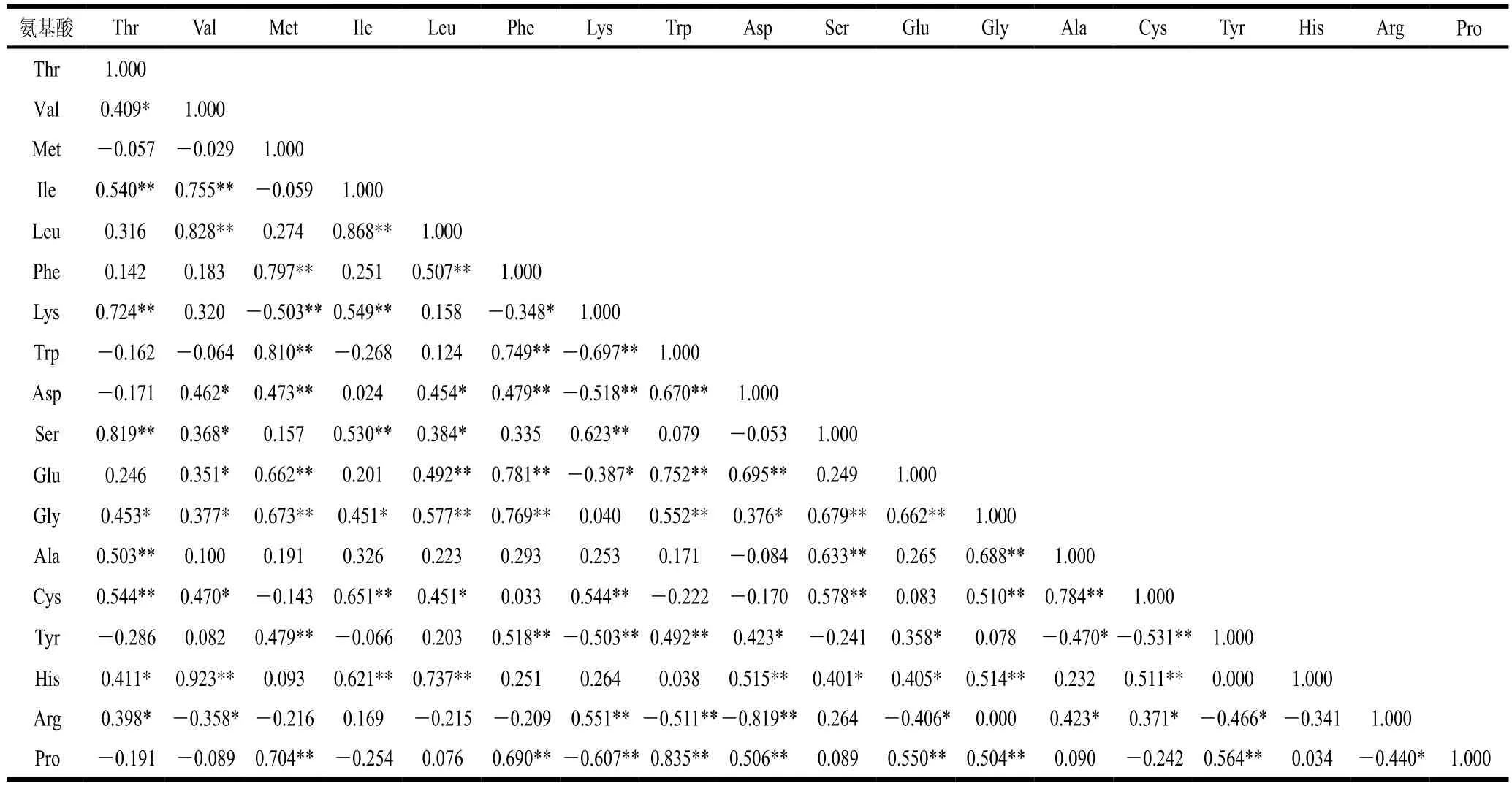
表5 FAAs指标间相关性分析Table 5 Correlation analysis between free amino acids in cultivated and wild Morchella from different provinces
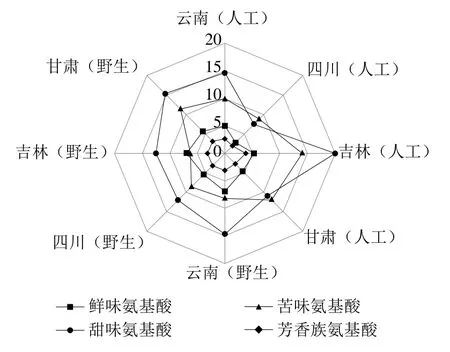
图1 不同省份人工栽培和野生羊肚菌FAAs呈味特性雷达图Fig. 1 Radar chart of TAVs of free amino acids in cultivated and wild Morchella from different provinces
2.3 人工栽培和野生羊肚菌FAAs相关性分析
如表5所示,各氨基酸之间存在正相关也存在负相关,且绝大部分呈显著正相关(P<0.05),Lys、Asp、Glu、Gly、Cys等氨基酸之间相关性达较高水平,Leu、His与Val,Ser与Thr,Trp与Met,Leu与Ile,Pro与Trp之间相关系数在0.8以上呈正相关,Arg与Asp之间相关系数在0.8以上呈负相关,这表明羊肚菌FAAs间相关性较强,可通过PCA对不同省份的人工栽培和野生羊肚菌进行综合评价。
2.4 人工栽培和野生羊肚菌FAAs的PC差异
由表6可知,由于前4 个PC对应特征值均大于1,累计方差贡献率为87.125%,基本反映了所有变量的初始信息,故选取前4 个PC,反映不同省份羊肚菌FAAs的大部分信息。

表6 PC的特征值和贡献率Table 6 Eigenvalues of principal components and their contribution rates to total variance
表7显示了FAAs PCA矩阵中主要氨基酸在各PC矩阵中的权重系数,载荷上的数值反映原始变量对因子影响的大小,正负代表变化的方向。PC1的方差贡献率为35.676%,主要反映Gly、Glu、Phe、Leu、Met、Asp、Trp、His、Pro的变异信息。PC2的方差贡献率为31.521%,主要反映Lys、Cys、Thr、Ile、Ser、Tyr的变异信息。PC1和PC2反映了FAAs的大部信息,包括5 种甜味氨基酸、4 种苦味氨基酸和全部的鲜味、芳香族氨基酸。PC3方差贡献率为13.977%,其载荷绝对值最大的前2 位是Val(苦)、Ala(甜)。PC4的方差贡献率为5.951%,其载荷绝对值最大的前2 位是Tyr(芳香)、Ala(甜)。

表7 PC的特征向量与载荷矩阵Table 7 Principal component eigenvectors and loading matrix
由图2可知,不同省份羊肚菌样品的区分效果较好,12 个人工栽培和12 个野生羊肚菌的数据点均位于95%置信区间内。野生羊肚菌基本分布于PC1的正半轴和PC2的负半轴,聚集较好,说明不同省份野生羊肚菌FAAs组成及含量相近,而人工栽培羊肚菌分别分布在不同象限,说明不同省份人工栽培羊肚菌FAAs组成及含量差异较大。
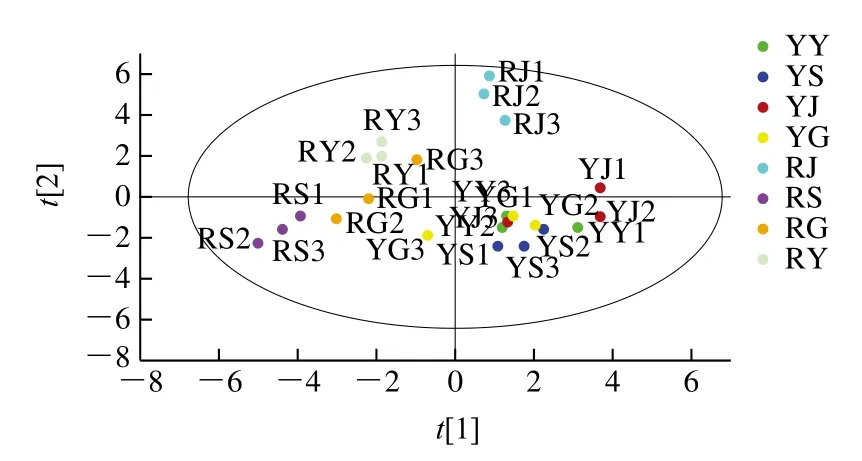
图2 不同省份人工栽培和野生羊肚菌的PCA得分图Fig. 2 PCA score plot of cultivated and wild Morchella from different provinces
2.5 人工栽培和野生羊肚菌FAAs的综合评价
由于PCA中前4 个PC反映了羊肚菌样品中24 种FAAs信息的87.125%,因此利用前4 个PC进行不同省份人工栽培和野生羊肚菌FAAs的综合评价可行。利用PCA得到F1、F2、F3、F4的4 个新的综合指标代替原来24 个指标对羊肚菌中FAAs进行分析,得到前4 个PC线性关系:
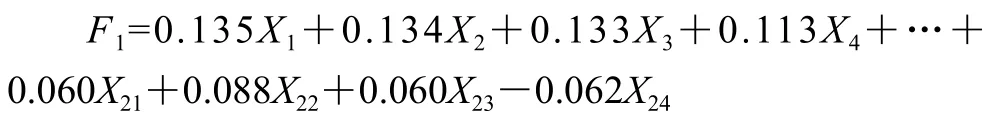
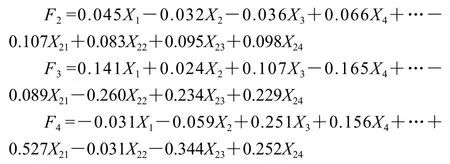
4 个PC从不同方面反映不同省份人工栽培和野生羊肚菌FAAs的总体水平,单独使用某一个PC并不能对其质量作出综合性评价,因此以每个PC对应的方差相对贡献率作为权重,对4 个PC得分进行权重加和,建立综合评价函数F=0.409F1+0.362F2+0.160F3+0.068F4,计算各品种的综合得分,分数高低可反映不同省份及种类中FAAs综合品质高低。由表8可知,4 个PC综合得分前3的是RJ,得分最低的3 个为RS,排名4~10的羊肚菌中6 个为野生羊肚菌、1 个为人工栽培羊肚菌。整体来看,RJ羊肚菌氨基酸营养品质最高,RS羊肚菌品质相对较差。
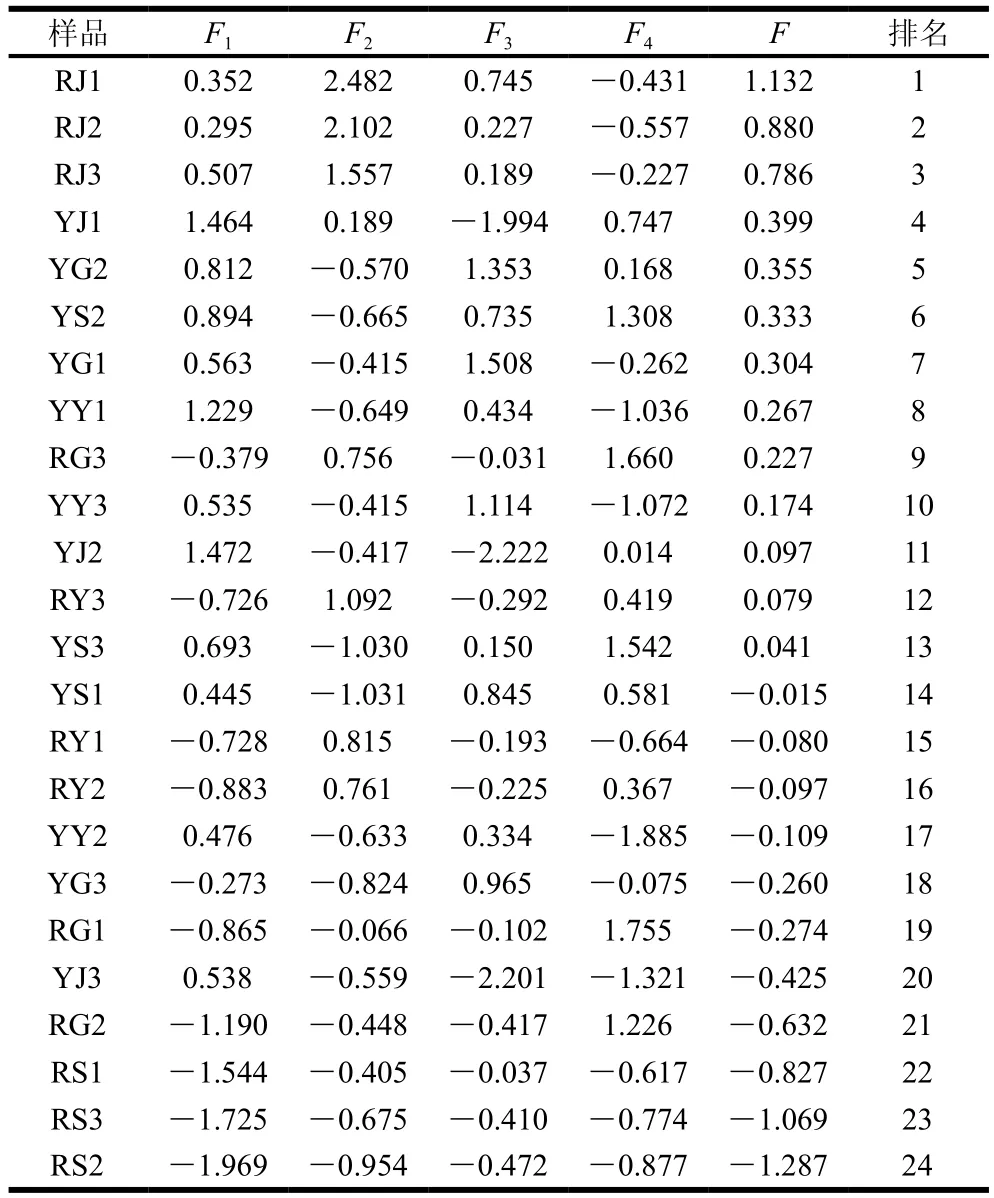
表8 不同省份人工栽培和野生羊肚菌的成分得分和综合评价Table 8 Principal component scores and comprehensive assessment of cultivated and wild Morchella from different provinces
2.6 聚类分析
采用SPSS Statistics 19软件对8 类不同省份人工栽培和野生羊肚菌中FAAs品质进行聚类分析,采用Euclidean距离和Ward最小方差法进行系统聚类。如图3所示,左侧树状为不同省份人工栽培和野生羊肚菌间的聚类,上侧树状为FAAs的聚类,中部填充颜色深浅,表示各类羊肚菌中氨基酸含量的高低,其中白色为未检出,红、蓝系颜色越深则含量越高。从左侧聚类看,8 个类别的羊肚菌可分为4大类:第1类为RJ,品质最好,Lys、Cys、Ser、His和Val含量较高,甜味氨基酸占优势;第2类为YY、RY、YG,品质较好,甜味氨基酸中的Thr、Ser、His含量较高;第3类为RG、YS、YJ,品质相对差,YJ中Arg的含量明显低;第4类为RS,品质相对较差,其鲜味化合物Glu和甜味化合物Thr、Ser的含量最低。FAAs的聚类可分为3大类,Arg单独作为一类,含量较高且与其他氨基酸相似性较弱。Glu、Ala和Thr作为一类,含量较高,作为鲜、甜味氨基酸的代表。其余氨基酸作为一类,含量相对低,以红色和白色为主,各氨基酸间具有相似性。
羊肚菌中氨基酸品质的差异受区域、土壤、温湿度及栽培料等因素的影响,该聚类分析与PCA结果相近,可较好地体现不同省份人工栽培和野生羊肚菌的差异性。这也为羊肚菌的栽培模式、氨基酸营养品质的评价及味觉感知等提供一定参考。
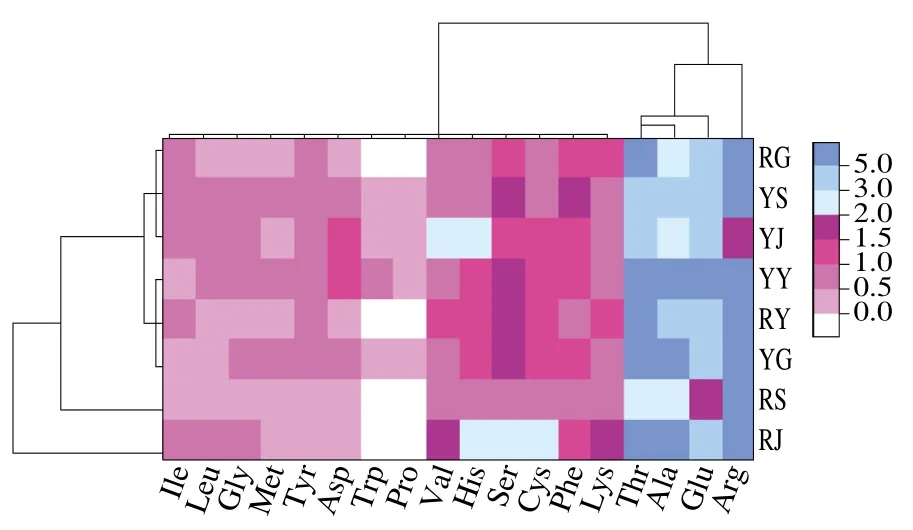
图3 不同省份人工栽培和野生羊肚菌聚类分析图Fig. 3 Dendrogram from cluster analysis of cultivated and wild Morchella from different provinces
3 结 论
羊肚菌营养丰富,滋味独特,开展不同省份人工栽培和野生羊肚菌FAAs营养品质分析和综合评价,筛选其主要的滋味活性,建立综合评价模型,为羊肚菌种植区域的选取及野生资源的保护等提供理论依据和评价方法。
本实验分析云南、四川、吉林、甘肃人工栽培和野生羊肚菌FAAs的组成及含量,人工栽培羊肚菌检测到16 种FAAs(Trp和Pro未检出),含量为20.77~43.07 mg/g,野生羊肚菌检测到18 种FAAs,含量为29.04~35.48 mg/g。除了吉林省,其余省均为野生羊肚菌FAAs含量大于人工栽培羊肚菌。从各呈味氨基酸组成看,吉林省人工栽培羊肚菌的甜味、苦味及芳香族氨基酸含量均最高。Glu对羊肚菌的鲜味影响最大,野生羊肚菌TAV在13.75~17.79之间,人工栽培羊肚菌TAV在5.28~11.02之间,野生羊肚菌的鲜味明显高于人工栽培羊肚菌,云南省野生羊肚菌鲜味最突出。苦味氨基酸中Arg的TAV最高,野生羊肚菌的苦味氨基酸含量小于人工栽培羊肚菌。PCA从18 种FAAs中提取4 个PC,累计方差贡献率为87.125%,较好地反映羊肚菌FAAs品质的综合信息,并建立综合评价模型:F=0.409F1+0.362F2+0.160F3+0.068F4,得分越高反映不同省份及种类间FAAs的综合品质越好,人工栽培羊肚菌FAAs差异较大,RJ品质最好,RS品质相对较差。聚类分析将8 类不同省份人工栽培和野生羊肚菌分成4 类,结果与PCA相似,较好地反映不同省份间羊肚菌的差异性。
综上所述,人工栽培羊肚菌受土壤、营养袋、种植模式及栽培技术等因素影响,使其FAAs品质间差异较大。野生羊肚菌在氨基酸组成及鲜美的滋味上有其独特的优势,但对鲜味等成分的影响机理尚不清楚,人工栽培与野生羊肚菌氨基酸差异的主要因素有待进一步研究。

