炮制法对三叶木通果皮果胶提取及理化性质的影响
周宏炫, 谭书明, 陈 萍, 黄 颖, 陈小敏, 宋长军
(贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
三叶木通 Akebia trifoliata(Thunb.)Koidz.是 木通科木通属落叶木质藤本植物,其成熟果实称为预知子,全果均可入药。 预知子性味苦、寒,归肝、胆、胃、膀胱四经。 野生果树主要分布于我国长江流域,湖南湘西和贵州铜仁有大规模种植[1-3]。 2015 年版《中国药典》中共收录木通、三叶木通、白木通3 个品种,富含齐墩果酸、皂甙、氨基酸等成分,药用价值高,具有促进血液循环、提高机体免疫力、提高人体肝肾功能、抗菌抗炎、抗癌等功效[4-8]。 人们有取其果皮切丝晒干,泡茶饮用的做法,可清心活血、清除毒素、淡化皮肤褐斑等[9-11]。其果皮厚,辛苦,无毒,鲜果皮占果实总质量的40%~69%, 干果皮中果胶质量分数在15%以上[2,12],可用于提取天然果胶和加工入药,该果胶具有护肤、抗菌、抗氧化等功效。 目前,果胶提取方法包括酸法、酶解法、超声或微波辅助提取法等[13],其中酸法因成本低、易于产业化而被广泛应用,其提取剂主要为盐酸、硫酸、柠檬酸等,已经取得较好的研究结果[14-19]。
炮制是我国古代处理中药材的一种传统方法,指中药材应用于临床治疗前或制备成各种剂型前需要进行的加工过程,有助于降低甚至消除药物的烈性、毒性和不良反应,增强药效作用[20]。 中药炮制时由于湿热作用,能使植物体内水分蒸发、温度升高,内含物质发生一系列的物理化学变化。 果胶类成分在炮制过程中受热力作用,组织软化、细胞H+浓度增大,原果胶部分水解转化为可溶性果胶[21]。炮制法可能改善果胶的提取率和理化特性[22-23],然而目前鲜见炮制方法在果胶提取中的报道。
因此,作者研究不同炮制方法对三叶木通果皮果胶提取及理化特征的影响,并与未经处理的果胶生粉进行对比,所得果胶采用红外光谱图、扫描电子显微镜图、X 射线衍射谱表征, 考察其提取率、半乳糖醛酸质量分数、酯化度、黏度、乳化活性、乳化稳定性以及抗氧化性, 筛选出最佳炮制提取方法。以期为三叶木通果皮果胶提取及生产提供参考。
1 材料与方法
1.1 材料与试剂
三叶木通果皮,去除杂质后晾干:由贵州柯康俐生物科技股份有限公司提供,并经贵州大学药学院鉴定教研室专家鉴定为木通科木通属三叶木通Akebia trifoliata(Thunb.)Koidz.干燥果实。 半乳糖醛酸(纯度≥98%)、DPPH 试剂(纯度≥98%):阿拉丁试剂(上海)有限公司产品;硫酸、柠檬酸、咔唑、甲醇等其他试剂均为分析纯:重庆川东化工(集团)有限公司产品。
FD-1A-50 冷冻干燥机: 上海豫明仪器有限公司产品;WP-RO-40B 超纯水机:四川沃特尔水处理设备有限公司产品;SpectraMax190 全波长酶标仪:美国 Molecular Devices 公司产品;ART Photonics 红外光谱仪: 德国A.R.T. Photonics 股份有限公司产品;Hitachi S-570S 场发射扫描电镜(SEM):日本日立公司产品;UItima-IVX 射线多晶衍射仪(XRD):日本理学株式会社产品。
1.2 方法
1.2.1 炮制方法 将适量果皮粉微波灭菌45 s,粉碎至40 目放于1 000 mL 烧杯中,加20 倍超纯水浸泡1 h,重复洗涤5~6 次,直至滤液无色并在Molish反应中显示无糖为止,60 ℃下烘干得果皮生粉,研磨均匀备用。 参考陈皓等炮制方法[20],稍做修改,具体炮制工艺如下。
1)炒制 将上述预处理的100 g 果皮生粉置于锅内,文火炒至有大量果香气逸出后,果粉呈棕黄色,略有焦味时,取出冷却至室温。
2)砂制 将200 g 直径为4 mm 河砂置于锅内,加入上述预处理的100 g 果皮生粉拌匀, 文火炒至有大量果香气逸出后,果粉呈棕黄色,略有焦味时,取出冷却至室温。
3)醋制 取上述预处理的果皮生粉100 g,用50 mL 质量分数为60%醋酸溶液拌匀, 密封腌制2 h,在通风柜中, 置于锅内文火炒制大量醋酸味逸出,果皮粉变为棕色且略有焦味时,取出冷却至室温。
4)酒制 取上述预处理的果皮生粉100 g,50 mL 53°高粱酒拌匀,密封腌制2 h,置于锅内文火炒至有果香气逸出后, 果皮粉变为棕黄色且略有焦味时,取出冷却至室温。
1.2.2 提取工艺 称取上述预处理的果皮生粉和上述4 种炮制工艺处理的三叶木通果皮粉10.0 g,加入0.02 mol/L 柠檬酸与0.5 mol/L 硫酸调节成pH为1.5 的混合酸300 mL,90 ℃水浴搅拌提取2 h,趁热过滤;其他条件相同,滤渣以料液比1 g∶20 mL 重复提取一次。 收集滤液浓缩至200 mL, 每100 mL提取液加入0.8 g 活性炭颗粒, 在65 ℃水浴中,电动搅拌进行脱色反应30 min,加入0.5 mol/L NaOH溶液调节pH 至3.5,过滤,滤液中加入2 倍体积的95%(体积分数)乙醇溶液搅拌混匀,密封静置,醇沉过夜, 用120 目筛网滤出粗果胶, 无水乙醇洗涤3次,冷冻干燥12 h,分别得到生粉、炒制、砂制、醋制和酒制5 种三叶木通果皮果胶粉末样品。
1.2.3 三叶木通果皮果胶提取率 果皮果胶提取率的测定采用质量法[18],以提取得到的果胶与果皮粉的质量之比为提取率,用公式(1)计算提取率。
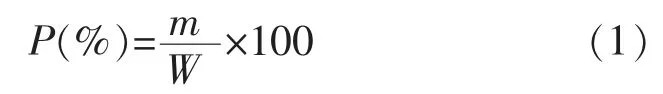
式中:P 为果胶提取率,%;m 为果胶的质量,g;W 为三叶木通果皮粉的质量,g。
1.2.4 半乳糖醛酸质量分数 测定采用咔唑-硫酸法[16],首先建立半乳糖醛酸标准曲线方程为:A=1.611 1c+0.019 8,R2=0.999 4, 测定果胶溶液吸光度,用公式(2)计算半乳糖醛酸质量分数。

式中:W 为半乳糖醛酸质量分数,%;C 为待测果胶液半乳糖醛酸质量浓度,g/mL;V 为待测果胶液体积,mL;M 为待测果胶质量,g。
1.2.5 酯化度测定 采用滴定法[14],取5 mL 均匀的果胶溶液,加 100 mL 水、3 滴酚酞。 用 0.02 mol/L的NaOH 滴定,记录消耗的体积V1,加入0.5 mol/L NaOH 溶液 20 mL,搅拌 15 min 后,再加 0.5 mol/L盐酸标准溶液20 mL, 搅拌15 min 至粉红色消失后,再滴入酚酞,然后用0.02 mol/L NaOH 标准溶液滴定至粉红色,记录滴定的体积V2,计算酯化度。

式中:DE 为酯化度,%;V1为样品初始滴定所用NaOH 体积,mL;V2为第二次皂化滴定所用NaOH体积,mL。
1.2.6 乳化活性和稳定性 测定在20 g 果胶溶液(0.01 g/mL)中加入15 g 精制大豆油,均质得到果胶乳化液。 在0 min 和 10 min 时分别从底部吸取1 mL 乳化液于 250 mL 锥形瓶中, 用质量分数为0.1%的SDS 溶液稀释90 倍, 以质量分数 0.1%的SDS 溶液为空白, 在 500 nm 处分别测定 0 min 和10 min 时吸光度。 分别按公式(4)、(5)计算果胶乳化活性及稳定性[17-18]。

式中:EA 为乳化活性,m2/g;ES 为乳化稳定性,min;A0为 0 min 时乳化液的吸光度;A10为 10 min 时乳化液的吸光度;V 为稀释倍数,90;L 为比色皿宽度,1 cm;φ 为乳化液中油的体积分数,42.86%;C 为果胶溶液质量浓度,0.01 g/mL;△T 为时间间隔,10 min。
1.2.7 DPPH 自由基清除率测定 参考文献 [24-25], 依次向酶标仪多孔板中加入0.01 g/mL 果胶溶液 100 μL、0.5 mol/L DPPH 工作液 100 μL, 混匀,避光孵育 30 min,于波长 517 nm 处测吸光度(As),平行测定3 次。 无水甲醇代替果胶样品作空白组,测其吸光度(A0);无水甲醇代替DPPH 工作液作对照组,测其吸光度(Ac)。 DPPH 自由基清除率按公式(6)计算。
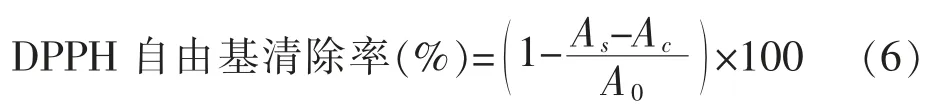
1.2.8 黏均相对分子质量测定 将不同炮制法得到的果胶样品在超纯水中搅拌溶解,配制成质量浓度为0.01 g/mL 的果胶溶液。 采用稀释法测定其特性黏度,在25 ℃恒温条件下,记录不同质量浓度果胶样品溶液流出乌式黏度计毛细管的时间,实验操作重复3 次。 计算出相对黏度、增比黏度,根据各样品溶液的特性黏度与质量浓度C 的经验公式(7)、(8),分别以 lnηr/C、ηsp/C 对 C 作直线图,两线相交在纵轴的截距为特性黏度[η]。
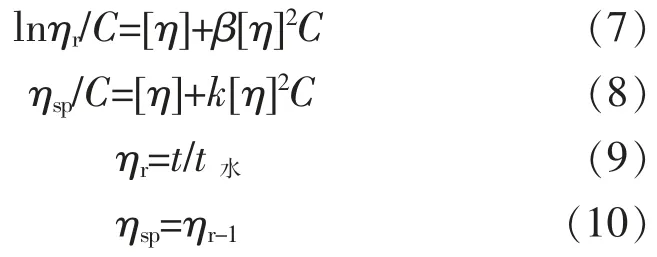
式中:[η]为特性黏度,mL/g;ηr为相对黏度,ηsp为增比黏度, 均为无因次量;t 为果胶溶液流出时间,min;t水为溶剂超纯水流出时间,min;C 为果胶溶液质量浓度,g/mL;β、k 均为比例系数。然后,根据聚合物的特性黏度[η]与相对分子质量的关系,即马克-豪温(Mark-Houwink)方程(11),K 和 α 为经验常数,可求出该果胶的黏均相对分子质量[26]。

1.3 结构表征
使用ART Photonics 红外光谱仪对果胶粉末进行红外光谱测试,波数范围为4 000~400 cm-1,扫描次数32 次;采用Hitachi S-570S 型场发射扫描电镜(SEM)、UItima-IV 型 X 射线多晶衍射(XRD)表征果胶外观形貌与结构特征。
1.4 统计分析
数据表示形式为平均值±标准差。 使用统计分析软件IBM SPSS Statistics 26 进行单因素方差分析,运用Duncan 法进行显著性分析,P<0.05 表示有显著性差异。
2 结果与分析
2.1 三叶木通果皮果胶提取率、半乳糖醛酸质量分数及酯化度分析
果胶提取率、半乳糖醛酸质量分数及酯化度是天然果胶提取工艺中极为重要的理化指标。 实验发现不同炮制方法的果胶指标与生粉果胶相比,在提取率、半乳糖醛酸质量分数及酯化度上均差异显著(P<0.05), 果胶提取率和半乳糖醛酸质量分数从高到低依次为醋制>酒制>砂制>炒制>生粉;醋制和酒制果胶提取率较高,分别达19.53%和17.42%;醋制和酒制果胶的半乳糖醛酸质量分数也较高,分别达83.51%和81.48%;这可能是醋和酒的腌制作用和高温的加热过程,使得果皮中原果胶大分子链易脱离果皮细胞组织,同时发生一定程度的断裂,使其易溶出。 醋制样品酯化度 (82.26%) 与生粉果胶(82.51%)相近,酯化度依次为生粉>醋制>炒制>砂制>酒制,而酒制果胶最低为71.42%。这是醋制过程分子链发生断裂, 但对侧链酯基影响较小的缘故,而酒制过程在酒精作用下,侧链酯基可能发生了变化或断裂。 高酯果胶溶液具有较高的黏度,在适宜条件下可形成凝胶,但在强酸或强碱作用下,果胶分子易降解,从长链变为短链[27],故醋制和其他炮制方法,可使果胶酯化度有所下降,但仍然保持在高酯范围(大于50%),见表1。

表1 不同炮制方法对三叶木通果皮果胶提取率、半乳糖醛酸质量分数、酯化度的影响Table 1 Effects of different processing methods on extraction yield, galacturonic acid content and esterification degree of pectin from Akebia trifoliata peel
2.2 三叶木通果皮果胶EA 和ES 分析
果胶是一种天然的具有乳化能力的物质,其结构中具有乙酰基能够有效降低表面张力,较低质量浓度的果胶溶液就能得到比较稳定的乳液[18]。 图1是不同炮制方法所得果胶乳液EA 和ES 变化图。
从图1 可见, 醋制果胶的EA 达到89.23 m2/g,非常接近于生粉果胶的EA(91.31 m2/g)。 几种炮制方法所得果胶差异显著(P<0.05),这可能是醋制果胶分子链虽然有断裂,但大小比较均匀,对果胶中性糖侧链破坏小,所以仍然表现出高的活性,得到的果胶稳定性高[17-18,28]。 从 ES 分析,所有果胶溶液ES 均大于100 min,具有良好的稳定性,其中醋制果胶ES 与生粉果胶相近, 在实际生产应用中采用醋制果胶能满足提取率高和性能较好的需求。 不同果胶EA 和ES 从高到低依次为生粉>醋制>酒制>砂制>炒制,这可能是醋制、酒制、砂制、炒制过程中,果皮粉受到温度不断增加的影响所致。

图1 不同炮制方法对三叶木通果皮果胶乳化活性和乳化稳定性的影响Fig. 1 Effects of different processing methods on emulsifying activity and emulsifying stability of pectin from Akebia trifoliata peel
2.3 三叶木通果皮果胶抗氧化性分析
图2 为不同炮制方法所得果胶抗氧化性的情况。 生粉、炒制、砂制、醋制及酒制果胶都有较高的DPPH 自由基清除能力, 但不同炮制方法之间差异显著 (P<0.05), 其中酒制果胶抗氧化能力较差,为75.04%;醋制果胶最高,达到82.95%。依据前面的分析,可能是由于醋制果胶由原果胶分子链断裂分解而来,但分子断裂位置或程度较为规范,保持或增加了活性基团酯基、羟基等数量,从后续其SEM 图中比较均匀的棒状结构可得到证实。 清除能力大小依次为醋制>生粉>炒制>砂制>酒制。几种炮制果胶DPPH 自由基清除能力与前人[11-12,24-26]研究报道(59.46%~82.84%)相比有所提高。
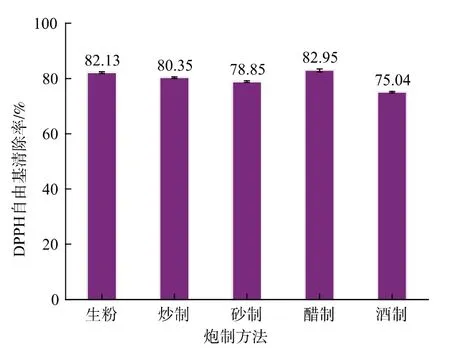
图2 不同炮制方法对三叶木通果皮果胶DPPH 自由基清除率的影响Fig. 2 Effects of different processing methods on DPPH radical scavenging rate of pectin from Akebia trifoliata peel
2.4 三叶木通果皮果胶黏均相对分子质量分析
图3 是不同炮制方法所得果胶的黏均相对分子质量。 其中,生粉、炒制、砂制、醋制、酒制炮制方法所得果胶的黏均相对分子质量为2.36×103、2.23×103、1.96×103、2.07×103、1.85×103, 其大小顺序为生粉>炒制>醋制>砂制>酒制,生粉果胶最高是因为生粉果胶在提取过程中其分子链受到外力的影响较小,断裂较少;酒制果胶则相反,这是因为在提取过程中其分子链受到外力的影响最大,断裂最多且不规范[17,27];醋制果胶分子链受到外力的影响也较大,但断裂规范、分布较为均一,结构也为较为均匀的棒状,导致其黏均相对分子质量在砂制与酒制果胶之上。

图3 不同炮制方法对果胶黏均相对分子质量的影响Fig. 3 Effect of different processing methods on viscosityaverage molecular weight of pectin from Akebia trifoliata peel
2.5 三叶木通果皮果胶结构分析
图4 为不同炮制法所得果胶的红外光谱图。 在3 500~3 300 cm-1内呈现出O—H 的强烈伸缩振动曲线, 在O—H 的伸缩振动频率区可能有多个吸收峰出现, 这些吸收重叠在一起形成较宽的吸附带,醋制、酒制果胶虽然分子主链有断裂,但对侧链影响较少,保存较多的 O—H 键,所以峰强度高[17,27]。另外,在1 725 cm-1处的吸收峰(酯化基团中C=O 键的伸缩振动)和1 600 cm-1处的吸收峰(游离羧基中C=O 键的非对称伸缩振动),均为果胶类多糖的特征峰[24],1 440 cm-1处的吸收峰为羧基的COO—键的对称伸缩振动。 1 000~500 cm-1为果胶分子的指纹区,1 080 cm-1为糖苷键 C—O—C 的弯曲振动峰, 在500~4 000 cm-1区域均出现果胶类多糖的特征峰, 说明炮制后果胶与生粉的化学结构相似,且与前人研究的果胶谱图基本吻合[24]。

图4 不同炮制方法所得果胶红外光谱图Fig. 4 Infrared spectra of pectin from Akebia trifoliata peel extracted by different processing methods
2.6 三叶木通果皮果胶微观结构分析
图5 为不同炮制法所得果胶的扫描电镜图。 从图5 可知,生粉果胶呈颗粒或块状,且颗粒大小相差较大。 未经炮制处理的果皮果胶较好地保持果皮中原果胶的结构,提取率不高,这种大分子结构果胶的存在使其黏性、乳化性、酯化性能相对较高。 而炒制和砂制果胶均呈片状结构, 片状大小相差较大,可能是在高温炒制过程中,原果胶结构受到一定破坏,大分子发生一定程度的断裂[17,27],提取率提高;其黏性、乳化性、酯化性能相对降低。 醋制和酒制均呈现棒状结构,其中,醋制结构最为均匀,在醋制的作用下原果胶从果皮中溶出的分子结构大小较为均匀,相对分子质量范围更为狭窄,提取率也更高,但由于其大分子结构发生了断裂,其酯化度有所降低,但仍然保持在较高的范围,属于高酯果胶,这些现象与结果均与前面表1、图3 的分析一致。

图5 不同炮制方法所得果胶电镜图(1 μm,50 000×)Fig. 5 Electron microscopy of pectin from Akebia trifoliata peel extracted by different processing methods (1 μm, 50 000×)
2.7 三叶木通果皮果胶X 射线衍射谱图分析
图6 为不同炮制法所得果胶的X 射线衍射谱图。生粉果胶的谱线在20.70°附近出现较强的尖峰,这与吴丽等的描述相似[30]。 另外在 11.62°、29.10°处也出现了2 个较强的尖峰,这表明该果胶具有一定的结晶性,与其为颗粒或块状晶体的结构相符。 炒制、砂制的果胶谱线相近,在 5.98°、13.20°、17.36°、22.86°等处有较弱尖峰出现, 这和其片状结晶的结构一致。 醋制果胶的谱线在 9.66°、16.22°、26.32°、33.10°等处均有较强尖峰出现,说明其结晶性很好,这与其为棒状晶体的结构一致。 酒制果胶的谱线在12.12°、20.78°、29.20°、32.46°等处均有较强尖峰出现,说明其结晶性也较好,这与其为棒状晶体的结构相符。

图6 不同炮制方法所得果胶X 射线衍射谱图Fig. 6 X-ray diffraction spectra of pectin from Akebia trifoliata peel extracted by different processing methods
3 结 语
采用炒制、砂制、醋制和酒制4 种炮制方法对三叶木通果皮进行预处理, 果胶提取率为16.07%~19.53%、 半乳糖醛酸质量分数为77.10%~83.51%,相较生粉及前人研究总体有较大提升,炮制方法可提高果胶产量。
醋制和酒制法均有助于三叶木通果皮中的果胶溶出,其中醋酸溶出能力更强,其果胶提取率最高,且果胶纯度高。 酯化度、乳化性、抗氧化性等理化特征与前人报道一致。 表明采用炮制方法处理可保持果胶理化性能和品质。
三叶木通果皮的炮制以醋制方法提取能有效提高果胶提取率和保持其产品质量,为以三叶木通果皮为原料提取果胶的工艺提供数据参考,为以果胶作为乳化剂和其他助剂[31]的推广应用奠定基础。

