HPTS 结合Nisin 对枯草杆菌芽孢的杀灭机理
尚彬玲, 申 瑾, 陈 翔, 陈 乐, 章 中
(宁夏大学 食品与葡萄酒学院,宁夏 银川750021)
细菌芽孢是在极端恶劣环境下产生的休眠体,其特殊的多层结构使其自身具有高度抗逆性[1],甚至在高温条件下依然能够存活。 枯草杆菌(Bacillus subtilis)芽孢作为食品中常见的污染菌,不仅耐热而且耐压[2],这使得其难以被常规的食品杀菌工艺杀灭[3],进而容易导致食品产生腐败现象,甚至引起食源性疾病[4-5]。 因此,亟待寻求一种能够有效将其杀灭的技术,为食品加工技术的发展提供指导。
HPTS 作为一项很有前景的高压加工技术,不仅能对食品中的细菌芽孢起到很好的杀灭效果,而且能够更好地保持食品的色香味以及营养成分[6-7],被认为是杀灭细菌芽孢的一种有效方法。 而抗菌化合物能够提高高压处理对芽孢的灭活效果,天然的抗菌物质受到人们的关注。 Nisin 作为一种含34 个氨基酸残基的天然防腐剂[8],通过与脂质结合在细胞膜表面形成通透孔道的方式实现灭菌目的[9],对人体无害并且能够被人体消化吸收,已被广泛应用于食品工业的实际生产[10-11]。 曾庆梅等对枯草杆菌芽孢进行HPTS 处理后, 采用透射电镜观察其超微结构, 发现经过处理后产生了芽孢外壳被破坏,内含物质完全泄漏,芽孢大量被杀灭的现象[12]。章中等研究表明,HPTS 会对芽孢内膜水分子的通透屏障产生损伤[13-14]。
综观学者对杀菌技术的研究成果,主要是关注超高压结合Nisin 对枯草杆菌芽孢的杀菌效果[15],但有关HPTS 结合Nisin 杀菌效果及机理的研究鲜有报道。作者以枯草杆菌芽孢为对象,研究HPTS 结合Nisin 对其灭活效果、内膜通透性和核酸蛋白质的影响,探讨HPTS 结合Nisin 的杀菌效果和机理,以期为HPTS 与Nisin 的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
枯草杆菌(Bacillus subtilis):来自中国普通微生物菌种保藏管理中心 (CGMCC), 编号 As 1.433;Nisin (分析纯): 天津市天力化学试剂有限公司产品;碘化丙啶(PI):北京索莱宝科技有限公司产品。
1.2 仪器与设备
UV-9000S 型双光束紫外可见分光光度计:上海元析仪器有限公司产品;Spectrum Two 型傅里叶变换红外光谱仪: 美国 PerkinElmer 公司产品;CyFlow Cube 8 流式细胞仪:日本SYSMEX(希森美康)株式会社产品;5L HPP 超高压设备:包头科发高压科技有限公司产品。
1.3 实验方法
1.3.1 枯草杆菌芽孢悬浮液的制备 芽孢的制备参照文献[16]的方法,将菌种接入锰盐培养基,37 ℃下划线培养7 d,重复3 次。 将收集到的芽孢离心洗涤(9 000 r/min 条件下 15 min)3 次。 洗涤后的芽孢重悬在无菌水中,调整后的菌悬液浓度约为1.5×109CFU/mL,4 ℃保存,使用前在 80 ℃下水浴 15 min。
1.3.2 枯草杆菌芽孢悬浮液的HPTS 处理 取10 mL 芽孢悬浮液于无菌的聚乙烯真空包装袋中,菌悬液中 Nisin 调整为 100、500 mg/L, 真空包装后置于超高压加压釜中, 压力为 200、550 MPa, 温度为25、65、75 ℃,处理 20 min 后卸压,样品计数前在 4℃下保存6 h。
1.3.3 枯草杆菌芽孢平板计数方法 对处理前后的芽孢悬浮液进行梯度稀释, 平板中加入1 mL 稀释菌液和培养基混匀后在37 ℃下倒置培养,24~48 h 后进行计数。
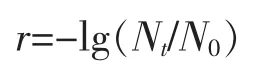
式中:r 为芽孢处理前后降低的对数值;N0为HPTS处理前初始枯草杆菌芽孢活菌数,CFU/mL;Nt为HPTS 处理后枯草杆菌芽孢残存活菌数,CFU/mL。
1.3.4 枯草杆菌芽孢内容物泄漏量的测定 将处理前后的芽孢悬浮液在4 ℃下以9 000 r/min 离心15 min,以上清液为测定组,未处理的菌悬液为对照组,无菌水为空白对照,在260 nm 和280 nm 下测定吸光度。
1.3.5 流式细胞仪检测枯草杆菌芽孢内膜通透性 将处理前后的芽孢悬浮液浓度稀释到1×106~1×107CFU/mL。 加入PI 染色剂后用流式细胞仪检测前向散射光(FSC)、侧向散射光(SSC)、荧光通道 FL2 和FL3[17]。 采用 488 nm 激发光,PI 标记细胞在 615 nm处发红色荧光(FL3)。
1.3.6 ATR-FTIR 检测 将处理前后的枯草杆菌芽孢悬浮液进行真空冷冻干燥,将干燥好的样品进行检测,分辨率为4 cm-1,波长扫描范围为400~4 000 cm-1,扫描64 次。 得到的光谱数据用Origin 软件进行分析。
1.4 数据处理及统计分析
所有实验至少重复3 次, 数据通过SPSS 26 进行显著性分析,采用Origin 2018 软件绘图,结果以均值±标准误差表示, 图表中不同字母表示其相关数据差异显著(P<0.05)。
2 结果与分析
2.1 HPTS 结合Nisin 处理对枯草杆菌芽孢的杀灭效果
图1 表示HPTS 结合不同质量浓度Nisin 对枯草杆菌芽孢的杀灭效果。 可以看出,Nisin 为100 mg/L时, 在 200 MPa 结合 25、65、75 ℃条件下 r 分别为0.40、2.65、4.70,550 MPa 结合 25、65、75 ℃条件下 r分 别 为 0.53、2.70、5.77;Nisin 为 500 mg/L 时 ,200 MPa 结合 25、65、75℃条件下 r 分别为 0.45、3.15、5.04,550 MPa 结合 25、65、75 ℃条件下 r 分别为0.56、3.20、6.30。 这说明 HPTS 结合 Nisin 后的杀菌效果显著高于HPTS 单独处理(P<0.05)的效果,同时发现Nisin 质量浓度越高, 其对芽孢的杀灭作用越强。 前期实验结果表明[18],单独采用80 ℃或Nisin无法杀灭芽孢, 而80 ℃结合500 mg/L 的Nisin 后,芽孢的存活率下降了约1.4 lg (CFU/mL)。 这是因为HPTS 能够对芽孢内膜产生一定影响[13-14],并且Nisin也能够作用于芽孢内膜,使得HPTS 结合Nisin 对芽孢内膜产生协同作用, 增加了芽孢内膜的通透性,使水分子进入导致其耐热性下降,继而产生了更好的杀菌效果。

图1 HPTS 结合Nisin 处理枯草杆菌芽孢的灭活效果Fig. 1 Inactivation of Bacillus subtilis spores treated with Nisin combined with HPTS
2.2 HPTS 结合Nisin 处理对枯草杆菌芽孢紫外吸收物质泄漏量的影响
由于细胞内紫外吸收物质(主要为核酸和蛋白质)泄漏量的变化可以反映芽孢内膜的受损程度[19],HPTS 结合不同质量浓度Nisin 对枯草杆菌芽孢紫外吸收物质泄漏量的影响见图2。HPTS 结合不同质量浓度Nisin 处理后, 芽孢的核酸和蛋白质泄漏量均显著增加(P<0.05);在相同温度和压力处理条件下,Nisin 为500 mg/L 时芽孢内核酸和蛋白质的泄漏量都显著高于100 mg/L, 说明提高Nisin 的质量浓度能够使芽孢内核酸和蛋白质的泄漏量增加。 这是因为芽孢内膜受到了更大程度的破坏,膜通透性也随之增大。 另外, 同质量浓度的Nisin 处理条件下,随着温度升高,芽孢的紫外吸收物质泄漏量呈现逐渐上升的趋势。 因此,HPTS 结合不同质量浓度Nisin 会增大芽孢内膜的受损程度,使芽孢内更多的核酸和蛋白质流出。

图2 HPTS 结合不同质量浓度Nisin 对枯草杆菌芽孢紫外吸收物质泄漏量的影响Fig. 2 Effect of HPTS combined with Nisin at different mass concentrations on the leakage of UV absorbing substances from Bacillus subtilis spores
2.3 HPTS 结合Nisin 处理对枯草杆菌芽孢细胞膜损伤的影响
大分子荧光染料PI 能够在芽孢细胞膜通透性增大到一定程度时透过细胞膜并嵌入双链DNA,产生红色的荧光,故芽孢内膜通透性的变化可以通过流式细胞仪来反映[20]。 图3 为样品经PI 染色后的直方图,直方图分为M1 和M2 两个区域,其中M1 区域为阴性区域。 可以直观地看出,HPTS 结合不同质量浓度Nisin 处理后,荧光分布都明显向M2 区域移动,说明芽孢受到一定程度的损伤,芽孢内膜通透性增加, 其与紫外吸收物质泄漏量的研究结果一致。同时,与单独HPTS 处理相比,HPTS 结合不同质量浓度Nisin 处理后移向M2 区域的比例增加,表明HPTS 结合不同质量浓度的Nisin 比相同条件下单独HPTS 处理对芽孢内膜的破坏作用更强, 使芽孢内膜的通透性增加。

2.4 红外光谱分析
近年来,傅里叶变换红外光谱技术应用范围很广,由于其能够综合检测细菌生理状态,被作为细菌经过处理后检测细菌物质变化的一项技术[21]。 这种检测方法能够对不同的红外吸收峰进行分析,进而得到细菌在经过一些处理后其物质的变化情况[22]。 从图 4 可以直观地看出,Nisin 与 HPTS 结合处理后,枯草杆菌芽孢红外光谱的峰形、峰高等基本相似,从这种微小的改变很难分辨出特征峰位的变化情况。

图4 HPTS 结合Nisin 处理前后枯草杆菌芽孢的红外光谱图Fig. 4 Infrared of Bacillus subtilis spores before and after the treatment of HPTS combined with Nisin
为了更加清楚地分辨处理前后枯草杆菌芽孢红外光谱图中特征峰的变化,有必要对原谱图数据进行处理,可以通过二阶导数的方法对原谱图进行数据分析(见图5)[22],这种方法可以将原谱图中难以清晰观察到的细小变化分辨开来,从而根据官能团的位移及峰的形状具体分析不同处理条件对细菌芽孢灭活作用的影响。 从图5 可知,3 000~2 800 cm-1和1 700~900 cm-1波段的范围有显著峰位变化,其中包括脂质、蛋白质、多糖区域,这说明细菌芽孢的灭活与芽孢内膜脂质、核酸和肽聚糖的结构有关。

图5 HPTS 结合Nisin 处理前后枯草杆菌芽孢的二阶导数光谱图Fig. 5 Secondary-derivative of Bacillus subtilis spores before and after the treatment of HPTS combined with Nisin
2.5 二阶导图谱分析
图6 为HPTS 与Nisin 处理前后枯草杆菌芽孢在3 000~2 800 cm-1的二阶导数红外光谱图。 可以看出,不同处理条件下红外光谱有一些共同的特征峰变化(3 000~2 800 cm-1区域主要代表膜脂质,2 855 cm-1和 2 925 cm-1处分别能够反映—CH3和—CH2对称和反对称伸缩振动的变化情况[23],—CH2的位移可以反映膜脂质性质[24]),前人研究显示,如果脂肪酰基链被“融化”而达到高度构象紊乱,则峰移至更高的波数[22]。因此,该结果表明HPTS与Nisin 结合处理后引起了细胞膜脂肪酰基链的变化; 同时,HPTS 与 Nisin 共同处理后,2 852 cm-1波段的峰位向高波数段移动, 并且与未处理组相比,2 929 cm-1波段的峰位移向低波数段, 表明不同质量浓度Nisin 结合HPTS 处理能够使枯草杆菌芽孢的细胞膜磷脂分子的疏水尾链混乱度增大。
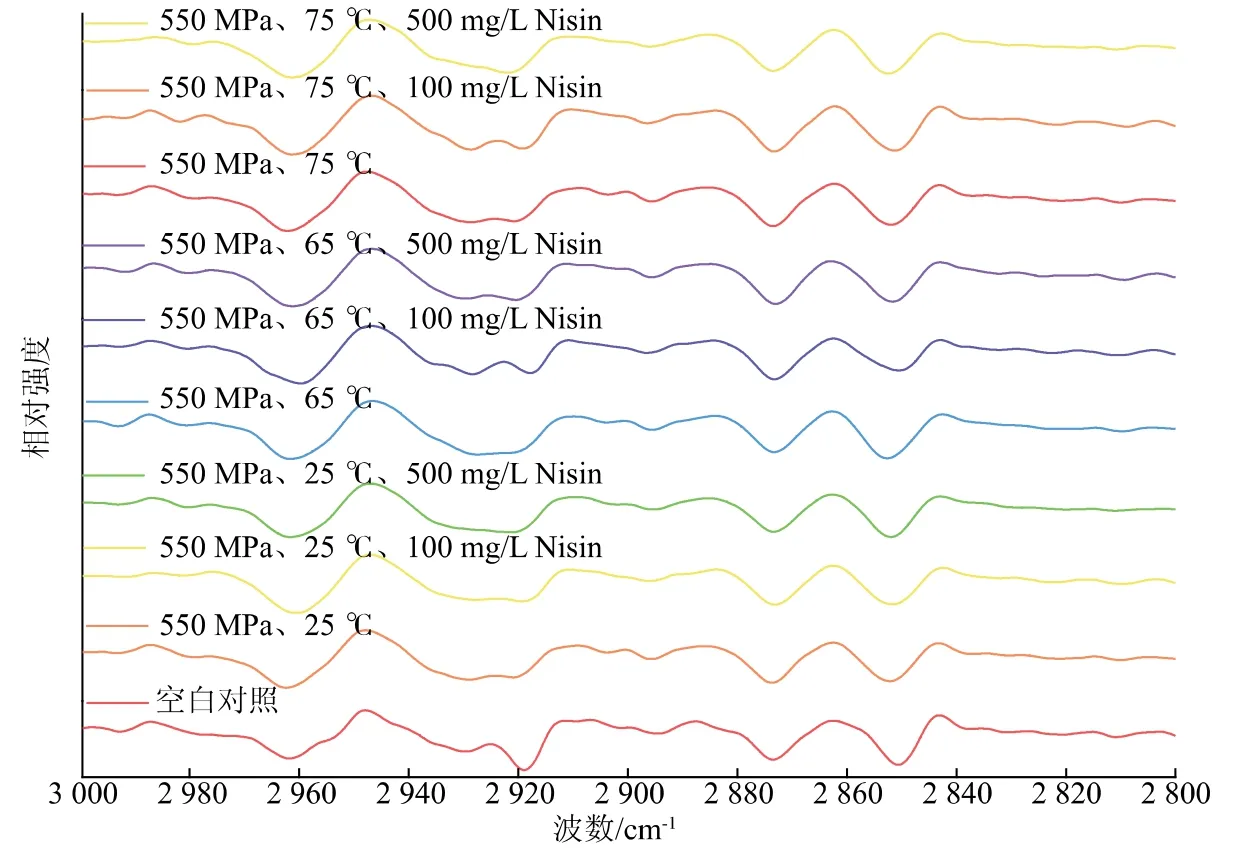
图6 HPTS 结合Nisin 处理前后枯草杆菌芽孢在3 000~2 800 cm-1 的二阶导数红外光谱图Fig. 6 Secondary-derivative FT-IR spectra of Bacillus subtilis spore nucleic acid treated by HPTS combined with Nisin at 3 000~2 800 cm-1
HPTS 结合 Nisin 处理前后枯草杆菌芽孢1 300~900 cm-1处的二阶导数红外光谱图见图7。其中波段1 300~900 cm-1主要代表细胞核酸, 能够表征细胞壁成分的振动特征,1 232 cm-1和 1 082 cm-1吸收峰对应的官能团分别是核酸磷酸二酯主链的反对称伸缩和对称伸缩振动,与核酸变性相关[21-22]。可以看出,1 232 cm-1与 1 080 cm-1处的吸收峰发生了明显变化,这是因为HPTS 结合Nisin 能够导致细菌芽孢内核酸物质的变性。 1 080 cm-1和1 232 cm-1特征峰都向低波数段移动,说明细胞内核酸分子中的PO42-基团氢键化程度发生了改变[25],使氢键减弱,峰位向低波数段移动。
研究表明, 肽聚糖是芽孢细胞壁的主要成分,也是使芽孢具有耐压性的关键结构,1 200~900 cm-1区域内的吸收峰主要是C—O—C 伸缩振动引起的,可以从吸收峰的变化观察肽聚糖层在处理前后的变化[25]。 从图 7 可见,在 HPTS 结合 Nisin 处理前后芽孢的肽聚糖层发生了明显的变化,肽聚糖层结构的改变可能引起了细胞壁结构的改变进而导致菌体死亡。

图7 HPTS 结合Nisin 处理前后枯草杆菌芽孢1 300~900 cm-1 处的二阶导数红外光谱图Fig. 7 Secondary-derivative FT-IR spectra of Bacillus subtilis spore nucleic acid treated by HPTS combined with Nisin at 1 300~900 cm-1
3 结 语
通过对细菌芽孢内膜损伤程度、 内膜通透性、芽孢成分等指标进行检测,探讨了HPTS 结合不同质量浓度Nisin 对细菌芽孢的灭活效果及机理, 发现HPTS 与Nisin 有协同杀菌的作用, 杀菌效果优于单独的HPTS 处理。 综合采用紫外吸收法、流式细胞术及红外光谱方法对HPTS 结合Nisin 后的共同作用机理进行了研究,发现Nisin 加入后,枯草杆菌芽孢紫外吸收物质的泄露量显著增大,对芽孢内膜的损伤程度更大,内膜通透性增加,两者共同作用后能够导致核酸物质发生变性,进而影响芽孢的生理代谢,最终导致枯草杆菌芽孢的死亡。

