脓毒症肺内感染与肺外感染ARDS肺部微生态的异同*
张鹏, 刘升明, 刘宝仪, 张爽, 张鑫, 黄炎明
江门市中心医院 1重症医学科, 3医学研究中心, 4呼吸与危重医学科(广东江门 529030); 2暨南大学附属第一医院呼吸与危重医学科(广东广州 510630)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是因肺内外多种病因导致的肺毛细血管损伤后以急性进行性缺氧性呼吸衰竭为主要表现的综合征[1]。由于多种病因均可导致ARDS,脓毒症是最常见的病因。根据起始感染部位不同分为肺内感染导致的ARDS(acute respiratory distress syndrome of pulmonary,ARDSp)及肺外感染导致的ARDS(acute respiratory distress syndrome of extrapulmonary,ARDSexp)。目前肺部微生态的研究还处于初级阶段,微生态的变化与ARDS的关系如何,能否影响疾病的发生、发展值得我们深入探讨。本研究将筛选肺内感染ARDS与肺外感染ARDS及对照组(非ARDS)患者进行比较,分析不同病因的ARDS患者肺部微生态的差异,寻找脓毒症导致的肺内感染与肺外感染ARDS肺部微生物态的变化规律。
1 资料与方法
1.1 一般资料 本研究采用的方案获得江门市中心医院伦理审查委员会审查批准(No:2019-15)。在使用纤支镜进行支气管肺泡灌洗收集支气管肺泡灌洗液(BALF)样本之前,已获得患者或其法定代表人的书面知情同意书。
本研究回顾性分析2018年1月至2020年4月在江门市中心医院ICU收治的18岁及以上由脓毒症引起的ARDS,且获得知情同意的病例共106例。
纳入标准:(1)ARDS诊断符合2012年柏林定义[2];(2)ARDS的病因由脓毒症引起;(3)年龄>18岁,临床资料完整。
排除标准:(1)ARDS由非感染因素引起;(2)年龄<18岁,临床资料不完整。ARDS根据起始感染部位分为ARDSp组81例和ARDSexp组25例。收集在同时期收治ICU存在轻症肺部感染非ARDS的患者作为对照组,共25例。
所有患者都在ICU气管插管、机械通气治疗,均采用纤维支气管镜获取BALF标本送检[3]。收集标本时间:ARDS患者在诊断ARDS 24 h以内、对照组患者在进入ICU 24 h以内,均在当天使用抗生素前留取基线样本,送检验科进行病原学培养。同时剩余标本送中心实验室进行离心,保存在-20℃冰箱留作科研用途。最后标本统一送检mNGS进行DNA基因测序,包括:核酸提取、文库构建、高通量测序、生物信息学分析、病原数据判读[4]。
1.2 ARDS患者的临床治疗 所有脓毒症患者按照脓毒症指南[5]治疗,结合临床感染指标及影像学信息,采用经验性抗感染治疗。ARDS患者按照ARDS通气指南进行机械通气治疗[6-7],抗感染方案综合患者炎症指标、影像学资料、微生物检测结果作出调整。
1.3 病例信息的收集和分析 患者资料包括年龄、性别、基础疾病、起始感染部位。通过比较ARDSp组、ARDSexp组及对照组患者BALF的宏基因组测序结果,分析不同组别之间肺内微生物组的异同。本研究测序共测出2 127种微生物,由于病原微生物占据大部分的测序信息,背景菌占比少且与病原微生物RPM数量差别太大,因此将病原微生物和背景菌群分别分析。根据2019年Chinet监测数据[8]及测序实验室检测常见的病原微生物,提取常见院内感染病原微生物,包括常见细菌、真菌、病毒及特殊病原体,共57种(表1)。其余的微生物考虑为背景微生物,整合以属的水平共700种,分析背景菌群的变化。由于背景的真菌及病毒数较少,暂不分析。

表1 常见的病原微生物
1.4 统计学方法 应用GraphPad 5.0或R3.4.4软件进行分析,使用2检验对每个菌群测序结果的阳性率进行比较:将RPM值≥1的病原微生物的定义为阳性,RPM<1定义为阴性;分析背景菌时,将RPM值>0定义为阳性,RPM=0定义为阴性。再进行2检验或Fisher检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者的基本特征 本研究筛选出脓毒症导致的ARDS患者106例,其中ARDSp组81例,ARDSexp组25例。对照组25例。比较ARDS组与对照组一般信息,年龄与性别比例差异无统计学意义(P>0.05),见表2。ARDS组中分ARDSp组与ARDSexp组比较:两组基础特征及诊断ARDS前的使用抗生素时间对比差异无统计学意义(P>0.05),见表3。

表2 ARDS组与对照组一般信息比较 例(%)
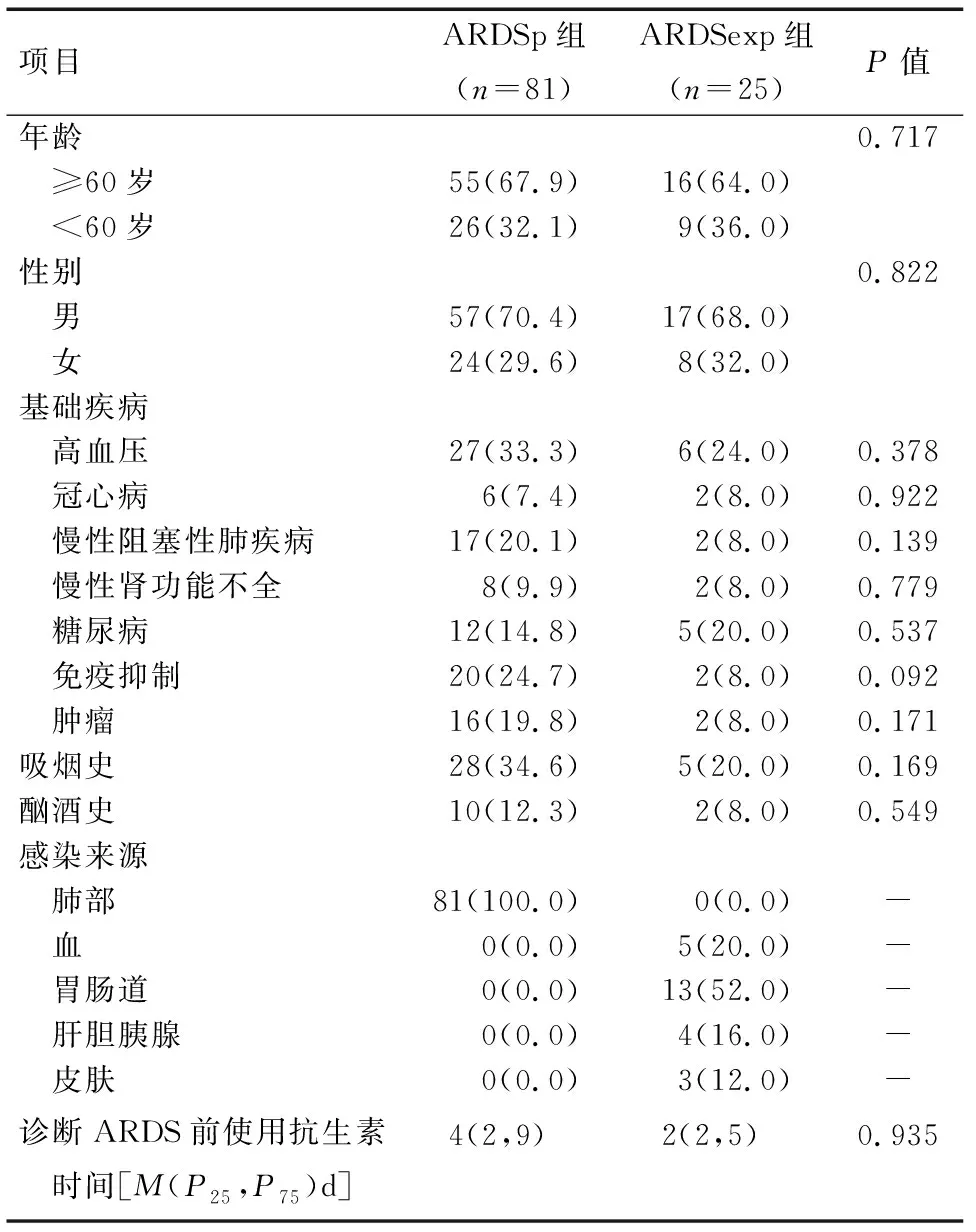
表3 ARDSp组与ARDSexp组患者基础特征及诊断ARDS前的使用抗生素时间的比较 例(%)
2.2 ARDSp组、ARDSexp组与对照组病原微生物的差异
2.2.1 ARDSp组与对照组病原微生物的差异 与对照组比较,ARDSp组检测出溶血葡萄球菌、真菌、白色念珠菌、病毒等阳性率更高,差异有统计学意义(P<0.05)。特殊病原体及其他病原微生物对比差异无统计学意义(P>0.05)。见图1。

图1 ARDSp组与对照组病原微生物阳性率的差异
2.2.2 ARDSexp组与对组病原微生物的差异 与对照组比较,ARDSexp组检测出大肠埃希菌的阳性率更高,差异有统计学意义(P=0.023)。见图2。

图2 ARDSexp组与对照组病原微生物阳性率的差异
2.2.3 ARDSp组与ARDSexp组病原微生物的差异 与ARDSexp组比较,ARDSp组检测出病毒的阳性率更高(P=0.006);而ARDSexp组对比ARDSp组检测出鲍曼不动杆菌、醋酸钙不动杆菌的阳性率更高,差异有统计学意义(P<0.05)。其他病原微生物对比差异无统计学意义(P>0.05)。见图3。

图3 ARDSexp组与ARDSp组病原微生物阳性率的差异
2.3 ARDSp组、ARDSexp组与对照组背景菌群的差异
2.3.1 ARDSp组与对组背景菌群的差异 与对照组比较,ARDSp组检测出鞘氨醇单胞菌属(Sphingomonas)、氢化杆菌属(Hydrobacter)、Curvibacter、Pelomonas、不动杆菌(Acinetobacter)、代尔夫特菌属(Delftia)、红球菌属(Rhodococcus)、短波单胞菌属(Brevundimonas)、甲基杆菌属(Methylobacterium)、假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、莫拉菌属(Moraxella)、鞘脂菌属(Sphingobium)、微杆菌属(Microbacterium)、假交替单胞菌属(Pseudoalteromonas)、哈夫尼菌属(Hafnia)、Mogibacterium、假黄单胞菌属(Pseudoxanthomonas)、Mitsuaria等阳性率减少,差异有统计学意义(P<0.05)。见图4。
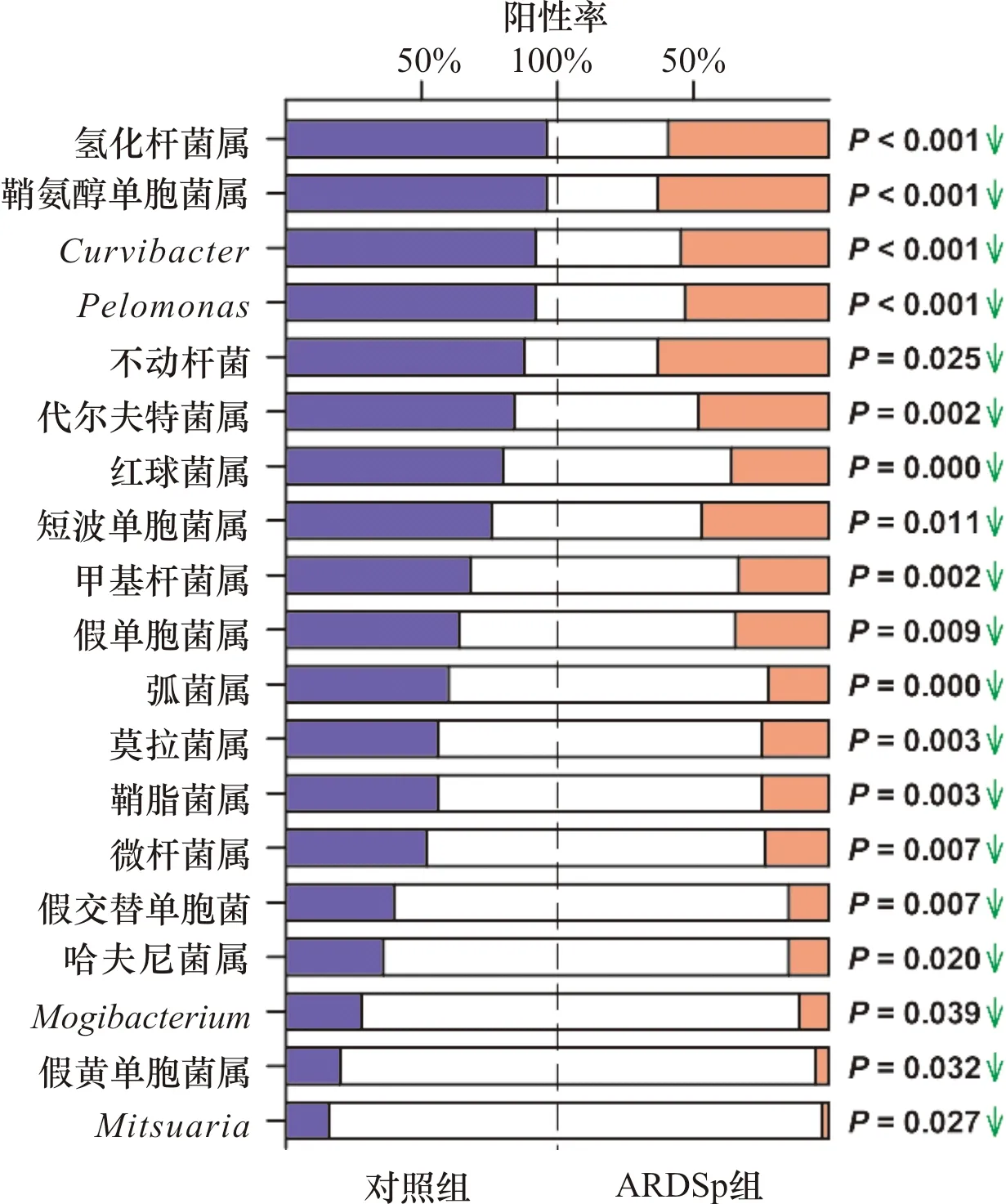
图4 ARDSp组与对照组背景菌群阳性率的差异
2.3.2 ARDSexp组与对照组背景菌群的差异 与对照组比较,ARDSexp组检测出放线菌(Actinomyces)、孪生球菌属(Gemella)、梭形杆菌属(Fusobacterium)、卟啉菌属(Porphyromonas)、葡萄球菌属(Staphylococcus)、奇异菌属(Atopobium)、克吕沃尔氏菌属(Kluyvera)、瘤胃球菌(Ruminococcus)、Bibersteinia、蓝绿藻菌属(Lachnoclostridium)、毛螺旋菌属(Lachnospiraceae)、梭菌属(Clostridium)、欧文菌属(Erwinia)、Odoribacter、亚特兰蒂斯菌(Atlantibacter)、耶尔森菌(Yersinia)等阳性率增加,差异有统计学意义(P<0.05)。见图5。

图5 ARDSexp组与对照组背景菌群阳性率的差异
2.3.3 ARDSexp组与ARDSp组背景菌群的差异 与ARDSp组比较,ARDSexp组检测出缓生根瘤菌(Bradyrhizobium)、类分枝杆菌(Mycobacteroides)、孪生球菌属、红球菌属、Cutibacterium、放线菌属(Actinomyces)、甲基杆菌属、梭形杆菌属、颗粒链菌属(Granulicatella)、Schaalia、卟啉菌属、罗斯氏菌属(Rothia)、嗜血杆菌属(Haemophilus)、鞘脂菌属、弧菌属、密螺旋体属(Treponema)、细小单胞菌(Parvimonas)、消化链球菌属(Peptostreptococcus)、纤毛菌属(Leptotrichia)、劳特罗普氏菌属(Lautropia)、假交替单胞菌、Trueperella、小杆菌属(Dialister)、双歧杆菌属(Bifidobacterium)、Scardovia、伯克霍尔德氏菌属(Burkholderia)、普罗威登斯菌属(Providencia)、毛螺旋菌属、Mogibacterium、Bibersteinia、欧文菌属、Blautia、梭菌属、蓝绿藻菌属、真杆菌属(Eubacterium)、短杆菌属(Brevibacterium)、亚特兰蒂斯菌、瘤胃球菌、短状杆菌属(Brachybacterium)、Tyzzerella、Odoribacter、阿克曼氏菌(Akkermansia)、Centipeda、Mediterranea、Basfia、Collinsella、加德纳菌属(Gardnerella)、皮杆菌属(Dermabacter)、库特氏菌属(Kurthia)、醋弧菌属(Acetivibrio)、Flavonifractor、Absiella、氨基酸球菌属(Acidaminococcus)、丁酸弧菌属(Butyrivibrio)、梭状芽胞杆菌(Clostridiales)、Gordonibacter、Hungatella、磁螺菌属(Magnetospirillum)、动弯杆菌属(Mobiluncus)、Paraglaciecola、Phocea、Prevotellamassilia、Ruthenibacterium、Sneathia、Turicimonas等阳性率增加,差异有统计学意义(P<0.05)。见图6。
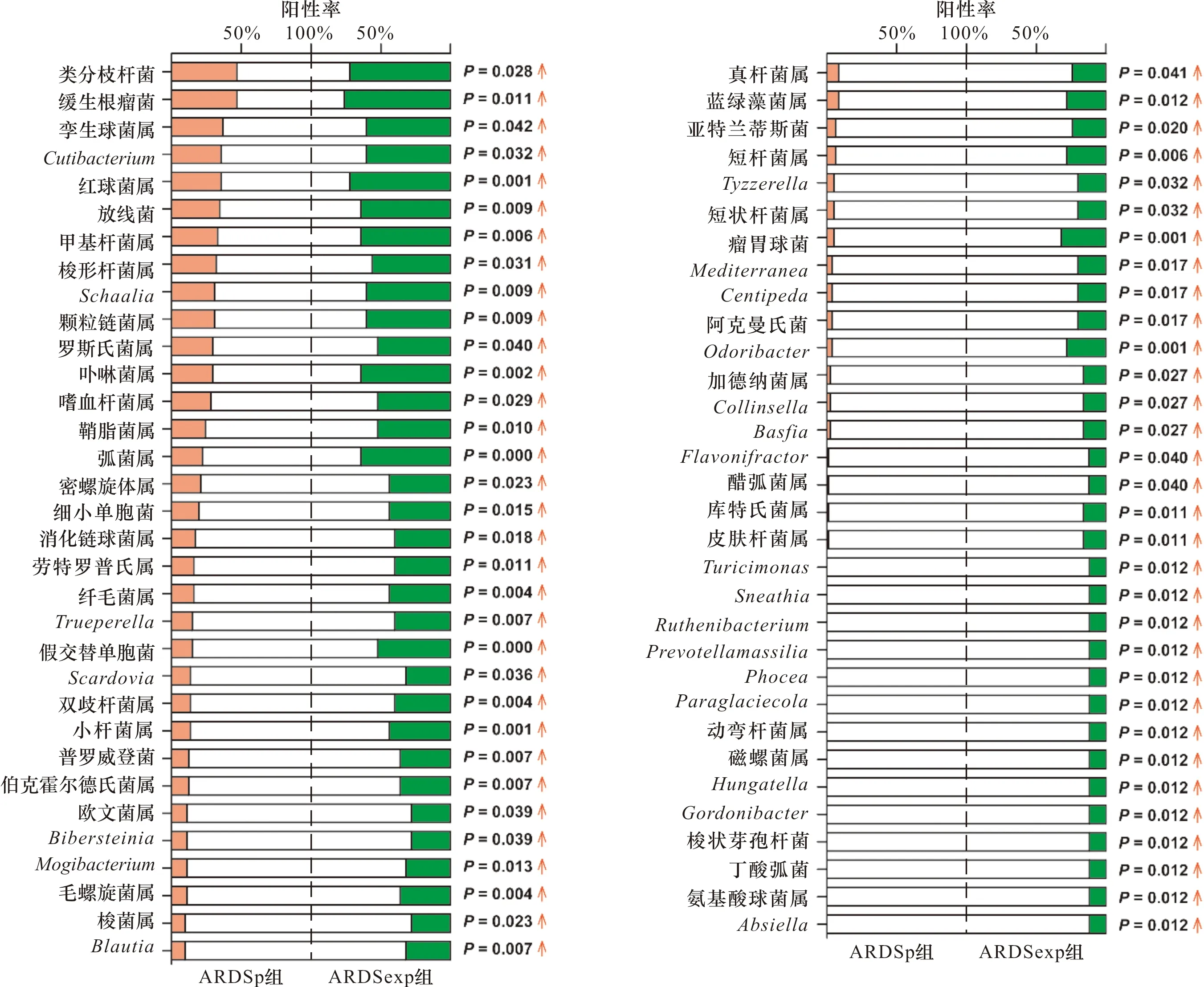
图6 ARDSexp组与ARDSp组背景菌群阳性率的差异
3 讨论
ARDS是临床常见的危重急症,随着人们对ARDS病理生理认识和研究的不断深入,治疗方法和策略取得了巨大的进步,然而病死率居高不下。不同病因导致的ARDS具有明显异质性,既往研究[9]已报道无论从发病机制、病理生理、机械通气策略、预后等方面,肺内源性与肺外源性ARDS都有一定的区别。因此需要从不同病因充分认识ARDS疾病的异质性,从而选择个体化治疗策略。
本研究利用宏基因组二代测序技术通过比较ARDSp组和ARDSexp组基线水平的微生态情况,发现两组之间有明显区别。在病原微生物方面,因本研究ARDSp组起始感染是肺内感染导致的,病原微生物并不局限于细菌,真菌、病毒、特殊病原体也是常见病原体。研究结果显示ARDSp组比对照组检测出溶血葡萄球菌、真菌、白色念珠菌、病毒的阳性率更高(P<0.05),特殊病原体及其他病原微生物对比差异无统计学意义(P>0.05)。ARDSexp组虽然起始感染部位在肺外,但其肺部由于肠道菌群的移位和条件致病菌的生长等原因也可以检测出大量的病原微生物,如ARDSexp组比对照组检测出大肠埃希菌的阳性率更高,ARDSexp组比ARDSp组鲍曼不动杆菌、醋酸钙不动杆菌的阳性率更高。
在背景菌群方面,ARDSp组、ARDSexp组与对照组之间差异有统计学意义(P<0.05)。首先在菌群多样性上,同时与对照组对比,发现ARDSp组的菌群多样性明显减少,而ARDSexp组菌群多样性明显增加。其主要原因考虑是ARDSp组起始感染在肺部,病原微生物的增加,抑制了正常呼吸道菌群的生长。同时严重感染导致肺泡上皮细胞破坏,肺泡塌陷、肺内实变。由于生长环境受到严重破坏,正常的呼吸道菌群数量下降,最终菌群多样性减少。虽然ARDSexp组由于严重脓毒症引起肺血管通透性增加,肺间质水肿,但上皮和内皮层保持完整,呼吸道菌群生长的环境并未破坏。此外,血管通透性的增加可导致蛋白外渗,为细菌生长提供了丰富、必需的营养物质,所以正常的呼吸道菌群并未减少,而且随着肠道菌群移位和条件致病菌的生长,菌群多样性明显增加。Kyo等[10]分析ARDS患者BALF的肺微生物组发现,肺细菌负担(16S rRNA基因拷贝数)趋于增加,香农指数提示α多样性明显降低,但结果并未区分肺内源性和肺外源性,其主要致病原因为肺炎,约占65%,与本研究肺内源性的结果相仿。另外,Dickson等[11]发现在盲肠结扎和穿刺致腹部脓毒症的小鼠肺损伤实验模型中,肺微生物组富含肠道细菌,且细菌多样性增多。这与本研究肺外源性的结果一致。
进一步分析发现,ARDSp组比对照组阳性率减少的背景菌有氢化杆菌属、鞘氨醇单胞菌属、红球菌属、短波单胞菌属、甲基杆菌属、微杆菌属、弧菌属。多项研究表明[12-13],鞘氨醇单胞菌属、红球菌属、短波单胞菌属、甲基杆菌属等属于肺部菌群,是肺部的条件致病菌。本团队前期研究发现氢化杆菌属可能是ARDS肺部的“益生菌”[14]。因此也证实了本研究的研究结果,ARDSp的微生态特点为病原微生物的丰度增加,其他肺部呼吸道“正常”菌群的减少。再者,ARDSexp组比对照组阳性率增多了很多不同的背景菌群,这些菌群广泛存在于自然界,有孪生球菌属、梭形杆菌属、卟啉菌属、葡萄球菌属等口腔、呼吸道来源[15-16],也有属于肠杆菌目的克吕沃尔氏菌属、欧文菌属、耶尔森菌等肠道菌群[18-20]。因此,ARDSexp的微生态特点为细菌负荷量增加、菌群多样性增加、出现肺部条件致病菌和肠道菌群的增加。
本研究存在一定的局限性与不足:首先,本研究受临床众多因素影响,抗生素的使用可能影响呼吸道微生物群的变化;然而既往研究在创伤性ARDS患者中,抗生素的使用与肺部群落组成没有显着相关性[21]。而且本研究纳入标准全是脓毒症的ICU患者,在ICU按照脓毒症指南标准化治疗,因此抗生素的影响是最小的。本研究分析了ARDSp与ARDSexp组在诊断前使用抗生素时间差异无统计学意义(P>0.05),而且回顾两组均有使用抗肠道菌群的抗菌药物。因此考虑ARDS出现肠道菌群的检出率增加与抗感染方案选择关系不大,日后肠道菌群的检出率增加有可能成为诊断ARDS的一个新型标志物。其次,ARDSexp组与对照组患者的数量有限,对照组并不是完全没有呼吸系统疾病的患者,但考虑难以在正常人进行有创的纤维支气管镜留取支气管肺泡灌洗液,因此这些因素可能对本研究结果有一定的偏倚。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:张鹏:论文撰写、收集标本、分析数据;刘升明、黄炎明:课题设计;刘宝仪、张鑫:数据分析,张爽:收集标本、整理临床数据。

