术苦芩总多糖对湿热泄泻仔猪肠道菌群和免疫功能的影响
陶未来,刘 佳,刘琼丹,郝永峰,胡 宇,朱兆荣,刘 娟,2,3*
(1.西南大学动物医学院,重庆 402460;2.重庆市高校兽医科学工程研究中心中兽药创新研发实验室,重庆 402460;3.西南大学医学研究院免疫研究中心,重庆 402460)
仔猪腹泻是仔猪断奶后最为常见的胃肠道疾病之一,每年给全球养猪业造成了巨大的损失[1]。在湿热等多种复杂环境下,断奶仔猪肠道致病菌大量增生,有益菌的生长受到抑制,肠道黏膜免疫遭到破坏,易致断奶仔猪发生腹泻[2]。中兽医学认为,湿热等外邪侵入机体,郁结于脾,致脾胃受纳运化失常,湿热郁蒸,气滞血阻,脏腑传化失常而发生泄泻[3]。抗生素成为治疗腹泻类疾病最为成功的方法之一,但持续地使用抗生素会改变肠道微生物的新陈代谢,增加肠道对病原体的敏感性[4],抑制免疫细胞的活性[5],从而降低药物的治疗效果。在此背景下,寻找替代药物来维护仔猪在断奶期的健康尤为重要。
肠道菌群由数万亿微生物组成,被认作新的虚拟代谢器官[6],密切影响着疾病的发展和口服药物的治疗功效,其在肠道共生有助于营养物质的利用以及对致病菌的抵抗作用,在腹泻类疾病的治疗中发挥着重要作用,但菌群的某些组成部分也可能产生不利影响,如大肠杆菌、沙门菌等病原菌在肠道产生内毒素等物质,破环肠道屏障及稳态,从而引起腹泻等病症[7-8]。口服中药可以与肠道菌群相互作用,直接或间接影响肠道菌群的组成和代谢,微生物菌群如拟杆菌也可对中药多糖等成分进行分解代谢,产生更适合机体吸收并具有药理活性的成分,已有很多学者认为肠道菌群或是中药治疗的机制[9-10]。肠道微生物菌群的组成会影响肠道对病原体的免疫反应及易感性[11],常驻肠道菌群亦可以与肠道细胞协同作用,影响肠道免疫平衡[12],有研究显示,微生物菌群发生改变时,会诱导Th1型和Th2型细胞因子之间免疫平衡紊乱,从而导致异常的炎症反应[13],小肠上皮细胞通过分泌免疫活性物质改善肠腔内微生物组成[14]。肠道菌群与肠道黏膜免疫相互协调,共同在肠道疾病发展中起着重要作用[15],已有研究表明,中草药多糖可以通过调节机体免疫反应来治疗腹泻类疾病[16]。
传统中草药多糖具有重要生物活性,在医学应用中发挥重要作用,已成为中药材的热门研究领域[17]。前期研究表明,术苦芩总多糖具有修复小肠黏膜损伤的作用,对仔猪湿热泄泻具有较好的治疗效果[18]。本试验通过研究术苦芩总多糖体外抑菌作用,结合肠道菌群16S rDNA测序分析及免疫相关细胞因子水平变化,以期为临床应用提供理论基础。
1 材料与方法
1.1 试验材料
术苦芩总多糖(polysaccharides from Zhukuqin,简称ZKQPs,由西南大学动物医学院中药创新研究室制备。白头翁散(Pulsatilla powder,PP)购自重庆市天龙牧业科技有限公司,批号:20170425。恩诺沙星购自重庆市布尔药业有限公司,批号:DK031802065。葡萄糖标准品(含量99.9%)购自中国食品药品检定研究院;甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖(纯度均≥98%)均购自上海宝曼生物;1-苯基-3-甲基-5-吡唑啉酮(PMP)购自上海麦克林生化科技有限公司;麦康凯培养基购自北京奥博生物技术有限公司,批号:02-00A。MRS培养基购自青岛高科技工业园海博生物技术公司,批号:HB0384-1。MH培养基和SS培养基均购自北京奥博生物技术有限公司。LB 液体培养基购自生工生物工程(上海)股份有限公司,批号:A5070020250。粪便总 DNA 提取试剂盒:Stool DNA Kit,批号:D4015;UNIQ-10柱式Trizol总RNA抽提试剂盒购自上海生物工程有限公司,货号:B511321。反转录试剂盒购自Promega公司,货号:A5000。Premix Ex-TaqTMⅡ荧光定量试剂盒购自宝生物工程有限公司,货号:RR820A。
大肠杆菌 CVCC210、沙门菌 CVCC2084、猪源产气荚膜梭菌 CVCC43菌株均来自于中国兽医药品监察所。
断奶仔猪,60只25~30日龄的健康三元(荣昌)仔猪,雌雄各半,体重10.0 kg±0.3 kg。
1.2 试验仪器
高效液相色谱仪(日本岛津),SPD20A紫外检测器(日本岛津),Shim-pack VP-ODS C18色谱柱(日本岛津),TU-1950双光束紫外可见分光光度计(北京普析通用仪器有限公司),JS-power 300琼脂糖水平电泳仪(上海培清科技),JS-860B自动凝胶图像分析仪(上海培清科技),SMA5000超微量核酸蛋白分析仪(Merinton),Qubit 2.0荧光计(Invitrogen),LightCycler 96荧光定量PCR仪器(Roche公司)等实验室仪器设备。
1.3 试验方法
1.3.1 高效液相测定术芩总多糖单糖组成 参考文献[19],称取术苦芩总多糖并利用三氟乙酸溶液进行水解,水解产物加入PMP溶液进行衍生化反应,0.22 μm滤膜过滤,利用高效液相色谱检测术苦芩总多糖组成的单糖。
高效液相色谱条件:岛津C18色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,流动相为乙腈∶PBS=(17∶83),流速 1 mL·min-1,紫外检测器,检测波长245 nm,进样体积10 μL,采集时间60 min。
1.3.2 津杯法检测 ZKQPs 溶液的体外抗菌能力 取1 mL浓度为1×105CFU·mL-1的菌悬液加入到LB琼脂培养基,均匀涂布,夹取牛津杯置于平板上,分别加入3种浓度(200、100、50 mg·mL-1)的ZKQPs溶液各200 μL,阴性对照为无菌水,阳性对照为恩诺沙星溶液(2.58 mg·mL-1),重复3次。37 ℃恒温培养24 h,测抑菌圈直径并判定抑菌活性[20]。
1.3.3 MIC值的测定 用微量肉汤稀释法测定大肠杆菌、沙门菌、猪源产气荚膜梭菌对200、100、50、25、12.5、6.25、3.125、1.563 mg·mL-1浓度梯度ZKQPs溶液的MIC。
1.3.4 生长曲线的绘制 试验分为药物组、阴性对照组、空白对照组。药物组用MH培养基将ZKQPs溶液稀释至1/2 MIC和1/4 MIC的药液,阴性对照组只加菌液不加药,空白对照组为无菌液的MH培养基。将菌液按照2%接种量加入各离心管中,37 ℃ 150 r·min-1恒温振荡培养,每2 h间隔读取600 nm处的吸光度值,绘制细菌生长曲线。
1.3.5 仔猪湿热泄泻模型建立及分组处理 60头健康仔猪随机分为空白对照组(Control)、模型组(Model, 造模后不作处理)、阳性药物组[白头翁散,50 mg·(kg·次)-1]、ZKQPs 25 mg·kg-1、ZKQPs 50 mg·kg-1、ZKQPs 75 mg·kg-1,每组10只。空白对照组仔猪饲养于适宜环境中(温度25~27 ℃,湿度65%~75%),饲喂正常饲料,自由饮水;其余各组饲养于35~38 ℃,相对湿度90%~95%的圈舍中,并饲喂高脂高糖饲料(猪油18%+蔗糖1%+酒糟5%,隔天加入1%番泻叶提取液),连续10 d,当仔猪出现精神沉郁(喜卧, 不愿走动)、采食下降、口渴喜饮、排便次数增加、排稀粪或水样便、肛门红肿、肛周污秽、尿黄短赤、身体消瘦、被毛粗乱等症状时可判定模型建立成功[18]。造模成功后,各治疗组灌服给药2次·d-1,模型组与空白对照组,灌以等量生理盐水,连续给药5 d,正常饲喂,自由饮水。采用猪场常规免疫程序,每天清扫圈舍,定期消毒。在治疗结束后,采取电击放血法屠宰,取小肠各段液氮速冻,-80 ℃冰箱保存,分离结扎盲肠肠段,消毒结扎后置于无菌容器中,取仔猪盲肠内容物装入无菌无酶的EP管中,液氮保存。
1.3.6 盲肠的活菌计数 参考文献[21],取仔猪盲肠内容物进行分级稀释,分别滴种于麦康凯培养基和MRS培养基,37 ℃恒温培养,进行计数,重复3次,并根据菌落形态、革兰染色镜检及生化试验对其进行鉴定。
每克内容物所含细菌数=菌落数均值×稀释倍数×每次稀释取样体积/(接种用样品体积×样品质量),菌落计数表示为每克内容物中细菌数的对数lg(CFU·g-1)。
1.3.7 16S rDNA扩增V4-V5区和高通量测序 根据制造商的说明使用Stool DNA Kit D4015提取仔猪盲肠内容物总基因组DNA,使用1%琼脂糖浆电泳检测DNA浓度和纯度。通过以下步骤验证最终的DNA文库:使用 Qbuit2.0 核酸检测仪上对文库进行定量。定量之后,将每个样品进行等量混合,漩涡均匀形成均一的混合物。纯化后的混合 DNA 样本由合肥晟起生物技术有限公司进行测序。
使用 UPARSE软件,按照以 97%的相似性进行操作分类单元(OTUs)聚类,同时选取 OTUs的代表性序列,筛选出 OTUs 中出现频率次数最高的序列作为代表序列。基于OTU聚类的代表序列,采用RDP注释软件比对SILVA(http://www.arb-silva.d e/)数据库对每一条16S rDNA的基因序列进行分类学分析(设定阈值为 0.8~1.0),获得分类学信息,并分别在各个分类学水平统计各样本的群落组成。结果用R软件分析。
1.3.8 仔猪肠道细胞因子mRNA表达量测定 取50 mg肠道组织样本,在液氮中充分研磨,参照B511321-UNIQ-10柱式Trizol总RNA抽提试剂盒说明书进行肠道组织总RNA提取,按照promega 反转录试剂盒说明书将提取的总RNA反转录为cDNA, 进行后续qPCR反应。
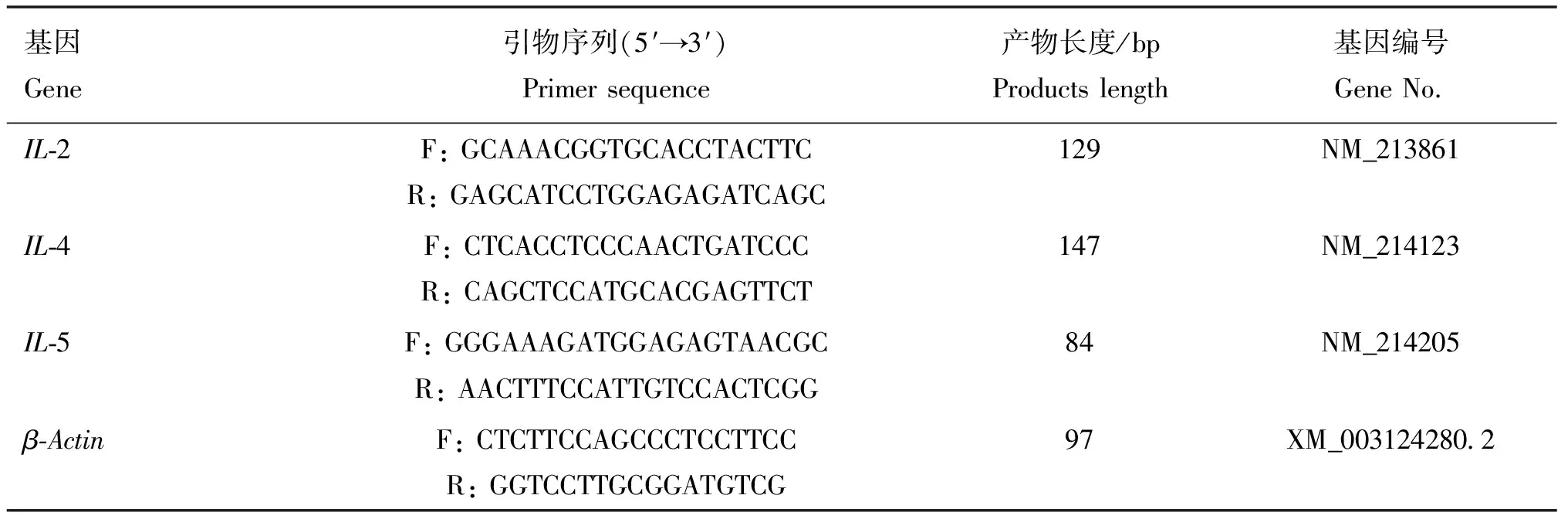
表1 荧光定量PCR引物
按照SYBR Green qPCR试剂盒说明书配制20 μL反应体系:2×Top Green qPCR SuperMix 10 μL,QF(10 μmol·L-1)和QR(10 μmol·L-1)各0.5 μL,模板cDNA 2 μL,RNase Free dH2O 7 μL。反应条件:94 ℃预变性30 s;94 ℃变性5 s,61 ℃退火35 s,循环40次;熔解程序:97 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。采用2-△△Ct法计算各检测样本中目的基因的相对表达量。
2 结 果
2.1 ZKQPs单糖组成
术苦芩总多糖水解后的PMP-衍生化产物高效液相图谱与标准品PMP-衍生化产物图谱对比,可以判断出术芩总多糖由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖等单糖组成,质量比为7.38∶1.57∶11.85∶3.98∶329.42∶19.02∶40.07∶2.64,其主要单糖为鼠李糖、葡萄糖、半乳糖、木糖,物质的量比为7.22∶182.85∶10.56∶26.69。

A.8种单糖混合标准品PMP-衍生化产物HPLC色谱图;B.术芩总多糖水解产物PMP-衍生化产物HPLC色谱图。各峰对应单糖情况:1.甘露糖,2.核糖,3.鼠李糖,4.葡萄糖醛酸,5.葡萄糖,6.半乳糖,7.木糖,8.阿拉伯糖
2.2 ZKQPs的抑菌活性
由图2可知,大肠杆菌(Escherichiacoli)对50、100、200 mg·mL-1ZKQPs高度敏感;沙门菌(Salmonella)、猪源产气荚膜梭菌(Clostridiumwischii)对100、200 mg·mL-1ZKQPs高度敏感,对50 mg·mL-1ZKQPs 中度敏感。ZKQPs对大肠杆菌、沙门菌、猪源产气荚膜梭菌的MIC值分别为3.125、6.250、12.500 mg·mL-1。随着ZKQPs浓度上升3种致病菌的生长活性逐渐下降,其中大肠杆菌最为敏感,猪源产气荚膜梭菌敏感度较低,ZKQPs暴露的致病菌生长期平缓,对致病菌生长的抑制作用具有浓度依耐性。

A.牛津杯法测术苦芩总多糖对试验菌株的抑菌活性;B.术苦芩总多糖对试验菌种的MIC; C~E.术苦芩总多糖对大肠杆菌(C)、沙门菌(D)、猪源产气荚膜梭菌(E)生长曲线的影响。ns.P≥0.05; *.P<0.05; **.P<0.01, 下同
2.3 ZKQPs对湿热泄泻仔猪回肠、盲肠乳酸杆菌和大肠杆菌数量的影响
分别通过麦康凯培养基和MRS培养基对大肠杆菌和乳酸杆菌进行选择培养,使用革兰染色及生化反应对菌种进行鉴定,对回肠、盲肠内容物进行菌数计数。如图3所示,湿热环境下腹泻仔猪肠道大肠杆菌数量显著上升(P<0.01),乳酸杆菌数量降低(P<0.05),乳酸杆菌与大肠杆菌比值下降(P<0.01)。ZKQPs对肠道乳酸杆菌的生长具有促进作用,同时抑制致病菌大肠杆菌的定植,其中ZKQPs 75 mg·kg-1效果最为明显,极显著增加了乳酸杆菌与大肠杆菌的比值(vs模型组,P<0.01)。

A.乳酸杆菌数量;B.大肠杆菌数量; C.乳酸杆菌和大肠杆菌比值
2.4 ZKQPs肠道菌群Alpha多样性的影响
图4表明,腹泻仔猪盲肠乳酸杆菌和大肠杆菌计数结果表明PP(50 mg·kg-1)组菌群变化不明显,其余各组菌群结构均发生明显变化,因此,试验通过16S rDNA进一步分析菌群结构。与空白组相比,模型组仔猪盲肠菌群OTU数目、Shannon、Chao1和ACE指数有降低的趋势(P>0.05)。与模型组相比,75 mg·kg-1ZKQPs 治疗仔猪盲肠菌群OTU数目有升高的趋势(P>0.05),Chao1、ACE指数明显升高(P<0.01),Shannon指数升高(P<0.05);25和50 mg·kg-1ZKQPs治疗仔猪盲肠菌群 OTU 数目、Chao1、Shannon、ACE指数显著升高(P<0.01)。
2.5 ZKQPs处理后肠道菌群结构的改变
由图5可知,各试验组组内样品分布较为聚集,说明组内差异较小,各组间散点完全分开,5组样本之间肠道菌群结构存在一定的差异。

对照组.样本1~3;模型组.样本4~6;ZKQPs 75 mg·kg-1组.样本7~9;ZKQPs 50 mg·kg-1组.样本10~12;ZKQPs 25 mg·kg-1组.样本13~15
2.6 ZKQPs处理对肠道菌群关键表型的影响
图6表明,腹泻和ZKQPs治疗对仔猪肠道微生物在门、纲、属水平上均表现出一定影响。在门水平上拟杆菌门(Bateroidetes, 2.01%)、厚壁菌门(Firmicutes, 92.42%)和变形菌门(Proteobacteria, 3.45%)为优势菌门,但在腹泻及ZKQPs治疗中变化不显著。仔猪腹泻时,盲肠内芽胞杆菌纲(Bacilli)相对丰度降低,拟杆菌纲(Bacteroidia)和乳酸杆菌属(Lactobacillus)相对丰度显著下降(P<0.01),梭菌纲(Clostridia)相对丰度显著上升(P<0.01),ZKQPs治疗后芽胞杆菌纲、乳酸杆菌属相对丰度均显著上升且高于正常值,梭菌纲相对丰度极显著下降(vs模型组,P<0.01),显著改善了腹泻仔猪肠道菌群结构。

A.门;B.纲; C.属
2.7 术苦芩总多糖对湿热泄泻仔猪各段小肠IL-2 mRNA表达量的影响
与空白组相比,湿热泄泻仔猪小肠各段IL-2 mRNA表达显著上升(P<0.01),治疗后不同浓度术苦芩总多糖均有降低小肠IL-2 mRNA表达的作用,且在小肠各段抑制作用不同,其中25和50 mg·kg-1ZKQPs 治疗后IL-2 mRNA表达极显著降低(P<0.01,图7)。

图7 各组仔猪十二指肠(A)、空肠(B)和回肠(C)IL-2 mRNA表达量
2.8 术苦芩总多糖对湿热泄泻仔猪各段小肠IL-4 mRNA表达的影响
腹泻仔猪小肠各段IL-4 mRNA表达降低,术苦芩总多糖治疗可促进腹泻仔猪小肠IL-4 mRNA表达,对十二指肠IL-4 mRNA表达影响最为显著(P<0.01),50 mg·kg-1ZKQPs 显著促进了腹泻仔猪小肠各段IL-4 mRNA表达(P<0.01,图8)。

图8 各组仔猪十二指肠(A)、空肠(B)和回肠(C)IL-4 mRNA表达量
2.9 术苦芩总多糖对湿热泄泻仔猪各段小肠IL-5 mRNA表达量的影响
腹泻仔猪IL-5 mRNA在小肠不同部位表达有较大差异,空肠和回肠较为敏感,仔猪腹泻时IL-5 mRNA水平极显著下降(P<0.01),ZKQPs 50和75 mg·kg-1可以较为稳定地提高各段小肠IL-5 mRNA表达量(P<0.01,图9)。
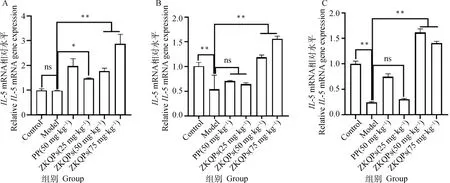
图9 各组仔猪十二指肠(A)、空肠(B)和回肠(C)IL-5 mRNA表达量
3 讨 论
近年,中草药多糖因其重要的生物活性及低廉的价格而被广泛关注与开发。多糖的生物活性与分子结构密切相关[22],多糖结构比DNA和蛋白质复杂,一级结构(单糖构成、构型、连接序列、糖苷键等)是较高级结构的基础[17],多糖可能因葡萄糖、甘露糖等单糖组成而与机体免疫细胞上高度特异性受体结合,从而诱导体液或细胞免疫,发挥免疫活性[23]。术苦芩总多糖是术苦芩复方的主要活性成分,本研究通过高效液相对术苦芩总多糖一级结构进行初步解析,显示其主要单糖构成为鼠李糖、葡萄糖、半乳糖、木糖,但对术苦芩多糖结构及结构与生物活性的关系仍需进一步探究。
高温高湿环境下,湿邪内蕴,热邪侵入机体,从而出现仔猪湿热泄泻[3]。肠道菌群和机体免疫功能紊乱与仔猪腹泻有很强的相关性[24]。本研究首先探究了术苦芩总多糖在体外对常见肠道有害菌的影响,同时建立了由环境及饮食造成的仔猪湿热泄泻模型,发现腹泻仔猪肠道菌群结构及炎症相关细胞因子水平发生改变,ZKQPs给药可以减轻湿热环境下仔猪的腹泻症状,这可能是ZKQPs通过调节肠道菌群结构及增强肠道免疫改善了肠道健康。
中药主要提取物多糖具有抑制致病菌生长的作用,是近来代替抗生素作为抗菌剂的优质新型天然产物[25]。大肠杆菌、沙门菌和产气荚膜梭菌是引起仔猪腹泻常见的致病菌[26],本研究评估了术苦芩总多糖对大肠杆菌、沙门菌、猪源产气荚膜梭菌的体外抗菌活性。结果表明,革兰阳性菌猪源产气荚膜梭菌对ZKQPs最为敏感,ZKQPs对革兰阴性菌沙门菌和大肠杆菌也表现出一定的抑菌作用。由3种常见肠道致病菌生长曲线可见,ZKQPs降低了3种致病菌生长的平台期,缩短了其对数生长的时间,降低了致病菌的生长活性,并且这种影响具有剂量依赖性。体外抑菌试验在一定程度上反映了ZKQPs对常见腹泻相关致病菌具有较好的抑菌效果,但其对病原菌的抑制作用与仔猪湿热泄泻之间的关系有待进一步研究。肠道致病菌和益生菌的数量变化可作为维持肠道健康的重要指标[27],本试验检测了不同组别中仔猪肠道内两种具有代表性的细菌数量变化,以此初步反映肠道微生物结构的变化。结果表明,模型组仔猪肠道的大肠杆菌数量明显升高而乳酸杆菌数量及其比值明显降低,提示腹泻仔猪肠道菌群发生失调,从而使肠道抵抗病原菌的能力下降[28]。而ZKQPs 明显降低了腹泻仔猪肠道大肠杆菌数量,增加了乳酸杆菌数量,这可能是术苦芩总多糖有效防治湿热泄泻证的机制之一。
为进一步阐明肠道微生物与药物治疗腹泻疾病是否有关,试验采用了16S rDNA测序分析由湿热环境和饲养不当造成腹泻及用不同浓度ZKQPs治疗的仔猪肠道微生物丰度和多样性。OTU分析和α多样性表明腹泻仔猪肠道微生物丰度和多样性均降低,在ZKQPs治疗后,OTU数目、Shannon、Chao1和ACE指数均升高,表明肠道微生物的物种丰度增加,菌群丰度显著恢复[29],其中,ZKQPs中剂量组变化最为明显。PCoA分析也进一步显示,各组肠道菌群具有较高的稳定性,且在微生物结构上具有显著差异。本试验研究了肠道菌群在门、纲、属水平上的分布,拟杆菌、硬毛菌和变形杆菌是优势菌门,与报道一致[30]。在ZKQPs治疗后,仔猪肠道芽胞杆菌纲、梭状芽胞杆菌和乳酸杆菌属显著增加,梭菌纲显著下降,而芽胞杆菌、乳酸杆菌等已被证实在腹泻疾病的治疗中发挥有益作用,本试验结果与Yue等[31]的结论一致。
肠道作为机体最大的免疫器官,对肠道正常菌群结构的维持以及外来病原菌的防御起着至关重要的作用[32]。肠道免疫系统与肠道菌群相互作用,密切影响着免疫复合体的形成和炎症反应的发生,同时肠道菌群结构的改变可以诱导Th1和Th2免疫反应之间的竞争,如在Zhou等[33]的报道中,肠道感染后引起梭状芽胞杆菌、乳酸杆菌等菌群结构的改变,从而促进IL-4和IL-5(Th2免疫反应)的产生,同时使IL-2和IFN-γ(Th1免疫反应)降低。IL-2是维持肠道调节性T细胞和免疫稳态的关键调节剂[34],但IL-2的过表达会诱导肠道炎症的产生[31],IL-4、IL-5是维持肠道促炎与抗炎平衡的关键因子[35]。试验结果表明,湿热泄泻仔猪小肠各段IL-2 mRNA表达异常升高,造成了仔猪的肠道免疫失调,诱导炎症的发生,这与Feng等[36]的研究结果相一致,ZKQPs治疗后可以降低IL-2水平,同时促进Th2型抗炎因子IL-4和IL-5的表达,有效调节了腹泻仔猪肠道免疫反应,缓解了肠道炎症。
4 结 论
由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖等单糖组成的ZKQPs对肠道常见有害菌的生长具有抑制作用,能增加湿热泄泻仔猪肠道乳酸杆菌的数量,减少大肠杆菌定植,可能通过改善了湿热环境下腹泻仔猪肠道菌群结构及免疫反应,增强了仔猪对湿热环境的适应力和抵抗腹泻的能力。

