阿密茴素拮抗多柔比星组织毒性及其机制研究
周文娟, 王玓玥, 赵淼淼, 刘 岩
(四川大学生命科学学院, 成都 610065)
多柔比星(DOX)是蒽环家族中使用最广泛的化疗药物,被用于治疗急性白血病(淋巴细胞性和粒细胞性)、胃癌、肝癌等[1,2].
DOX被大量用于癌症治疗,但其在临床使用中会导致患者发生不同程度的心脏、肝脏、肾脏、血液损伤[3,4].临床数据表明,病人在DOX治疗过程中会出现心脏毒性的症状,例如心率不齐、血压偏低、心电图紊乱等[5,6];另外还有病人会出现肝毒性,例如胆管畸形增生、组织内病灶坏死等[7,8];除此之外,肾损伤现象也不可忽视,比如肾上皮细胞的退化进而引起肾小球恶化,最终导致肾小球硬化(肾病的标志之一),肾小管扩张、间质纤维化和炎症、蛋白尿、局灶性肾小球硬化等[9-11].目前为止,右丙亚胺(Dexrazoxane,DZR)是唯一被美国食品药品管理局(Food and Drug Administration,FDA)批准用于缓解蒽环化疗药诱发的心脏毒副作用的药物.但遗憾的是,此药不仅会影响化疗药的抗肿瘤效果,还有诱发二次癌症的风险.因此DZR在欧洲被禁止使用,在美国也仅限于特定的癌症治疗[12].基于此种情况,开发一种安全有效的佐剂具有重要意义.
本实验室前期利用DOX诱导产生心脏毒性的斑马鱼模型,筛选出以阿密茴素(VIS)为代表的化学小分子,发现VIS在小鼠和斑马鱼模型中均可减弱DOX诱发的心脏毒性,并且不会影响其抗肿瘤效果[13].VIS是一种从Ammivisnaga植物中提取的具有生物活性的化学小分子,属于γ-吡喃酮类化合物.在一些亚洲国家的古代药典中,VIS被用于肾结石、心绞痛等疾病的治疗,同时现代医学研究发现VIS具有舒缓平滑肌、降低血压、消炎的作用[14].
已有报道表明,DOX可通过稳定TOP2-DNA共价复合物致使细胞死亡:TOP2是细胞内高度保守的酶,在DNA复制、转录时负责切断并且重连DNA,释放超螺旋引起的张力[15].DOX存在时会稳定TOP2-DNA共价复合物结构,当细胞清除该复合物时会暴露出自由DNA末端,从而造成双链DNA断裂(double-strand DNA break;DSB)甚至细胞死亡[16].这一发现将为DOX佐剂的机制研究提供线索.
为了探究VIS是否可以保护其他组织器官及其保护机制,本课题通过构建DOX诱导产生肝、肾毒性的小鼠急/慢性模型,证实VIS对小鼠肝、肾损伤具有缓解作用;拟通过机制研究实验结果揭示VIS是否通过抑制TOP2-DNA共价复合物的形成发挥保护作用.
2 材料与方法
2.1 实验材料
2.1.1 实验动物 Balb/c小鼠购于达硕公司(成都,四川),均为6~8周龄,雄性,体重20±2 g,严格按照SPF级饲养标准饲养.
2.1.2 主要试剂 环糊精、DOX、VIS、阿佛丁均购于Innochem.
2.2 实验方法
2.2.1 小鼠实验 本实验所有小鼠饲养条件严格按照SPF级饲养标准,购回适应24 h以上再开展实验.
急性模型:适应环境后的小鼠随机分为Cont(对照)组、DOX(阿柔比星)组、DV(阿柔比星/VIS共处理)组,每组5只.对照组尾静脉注入20 mg/kg生理盐水及25 mg/kg环糊精溶液;DOX组尾静脉注入20 mg/kg DOX溶液及25 mg/kg环糊精溶液;DV组尾静脉注射20 mg/kg的DOX溶液以及25 mg/kg VIS溶液.给药24 h后麻醉小鼠收取肝组织及肾组织,并及时将组织置于4%甲醛中过夜固定.
慢性模型:15只小鼠随机分为Cont、DOX、DV组,每组5只.对照组尾静脉注入5 mg/kg生理盐水及25 mg/kg环糊精溶液,1 w 2次,连续注射2 w.DOX组尾静脉注入5 mg/kg DOX溶液及25 mg/kg环糊精溶液,1 w 2次,连续注射2 w.DV组尾静脉注入5 mg/kg DOX溶液及25 mg/kg VIS溶液,1 w 2次,连续注射2 w.给药结束后麻醉小鼠,眼球采取300 μL全血用于检测肝肾功能,肝肾组织用4%甲醛固定.
VIS安全性检测实验:随机将10只小鼠分为Cont组和VIS组,每组5只.对照组尾静脉注入25 mg/kg的40% 环糊精溶液,VIS组尾静脉注入25 mg/kg VIS溶液.1 w注射2次,持续2 w,注射安排及小鼠取样同上述慢性小鼠模型一致.
2.2.2 生化指标测定 小鼠血液送至成都华西海圻医药科技有限公司(成都,四川),做血液生化指标测定.
2.2.3 组织凋亡细胞检测 固定好的肝肾组织脱水包埋后进行TUNEL染色.在莱卡DM6B荧光显微镜下拍取照片,Image J软件计数TUNEL阳性细胞数及总细胞数,TUNEL/总细胞数比值为组织细胞凋亡比例.
2.2.4 RADAR实验 称取10 mg小鼠新鲜组织,使用2 mL M裂解液充分研磨.通过乙醇沉淀法去除DNA中的杂质,取相同量的DNA吸附于硝酸纤维膜上,孵育TOP2抗体检测TOP2-DNA共价复合物的形成情况.
2.2.5 统计分析 结果使用Prism软件进行t检验分析.每次独立实验的数据均以平均值±标准误差表示;***,P<0.001;**,P<0.01;*,P<0.1.
3 结果与分析
3.1 VIS减少急性小鼠模型中肝细胞和肾细胞死亡
小鼠被随机分为对照组(Cont)、DOX组、DV(DOX/VIS共处理)组.给药24 h后,收取小鼠的肝肾组织制作成石蜡切片进行TUNEL染色,计数TUNEL阳性(凋亡细胞)占总细胞比例.结果如图1所示:和对照组小鼠相比,DOX处理会导致小鼠肝组织和肾组织细胞凋亡率显著上升,同时VIS将DOX升高的细胞凋亡率降低到对照组水平,这说明VIS对DOX诱发的肝细胞和肾细胞凋亡具有显著保护作用.

图1 VIS减少DOX急性给药引起的肝组织和肾组织细胞凋亡
3.2 VIS减少慢性小鼠模型中肝细胞和肾细胞的凋亡
我们构建了为期14 d的DOX慢性小鼠模型(图2a),给药结束后,收取肝、肾组织制作切片,TUNEL染色并计算细胞凋亡率.统计每组5只小鼠的数据,结果如图2b,2c所示:在DOX组小鼠中,凋亡细胞比例明显上调,而VIS可以将细胞凋亡率降低到对照组水平,显著减少细胞凋亡.这表明同急性小鼠结果一致,VIS可以有效缓解DOX慢性给药造成的肝、肾细胞毒性.
3.3 VIS缓解DOX诱发的肝功能和肾功能损伤
在图2a实验的终点,我们收集了小鼠血液进行生化指标检测.实验结果如图3所示:与对照组相比,注射DOX的小鼠血浆中肝功能指标(AST、ALT)、肾功能指标(BUN、CREA)水平均显著上升,意味着DOX损害了小鼠肝、肾功能,而VIS共处理则有效地将AST、ALT、BUN、CREA水平均降低到对照组水平,揭示VIS可以显著改善DOX诱发的肝、肾功能损伤.由此进一步验证VIS除了可以拮抗DOX诱导的肝、肾细胞凋亡外,还可以维持肝、肾的正常功能.

图2 VIS减少DOX慢性给药引起的肝组织和肾组织细胞凋亡
3.4 VIS拮抗DOX引起的小鼠体重减轻
在实验过程中我们还发现VIS对小鼠的生存状态具有显著的改善作用.在上述14 d小鼠慢性模型中,我们选取第1、5、8、12、14 d称取小鼠体重,统计结果如图4所示:对照组小鼠的平均体重14 d内稳步上升,DOX组小鼠的体重则显著减轻,毛色暗淡,运动迟缓,而注射VIS则可以有效提升小鼠的体重及其生存状态.
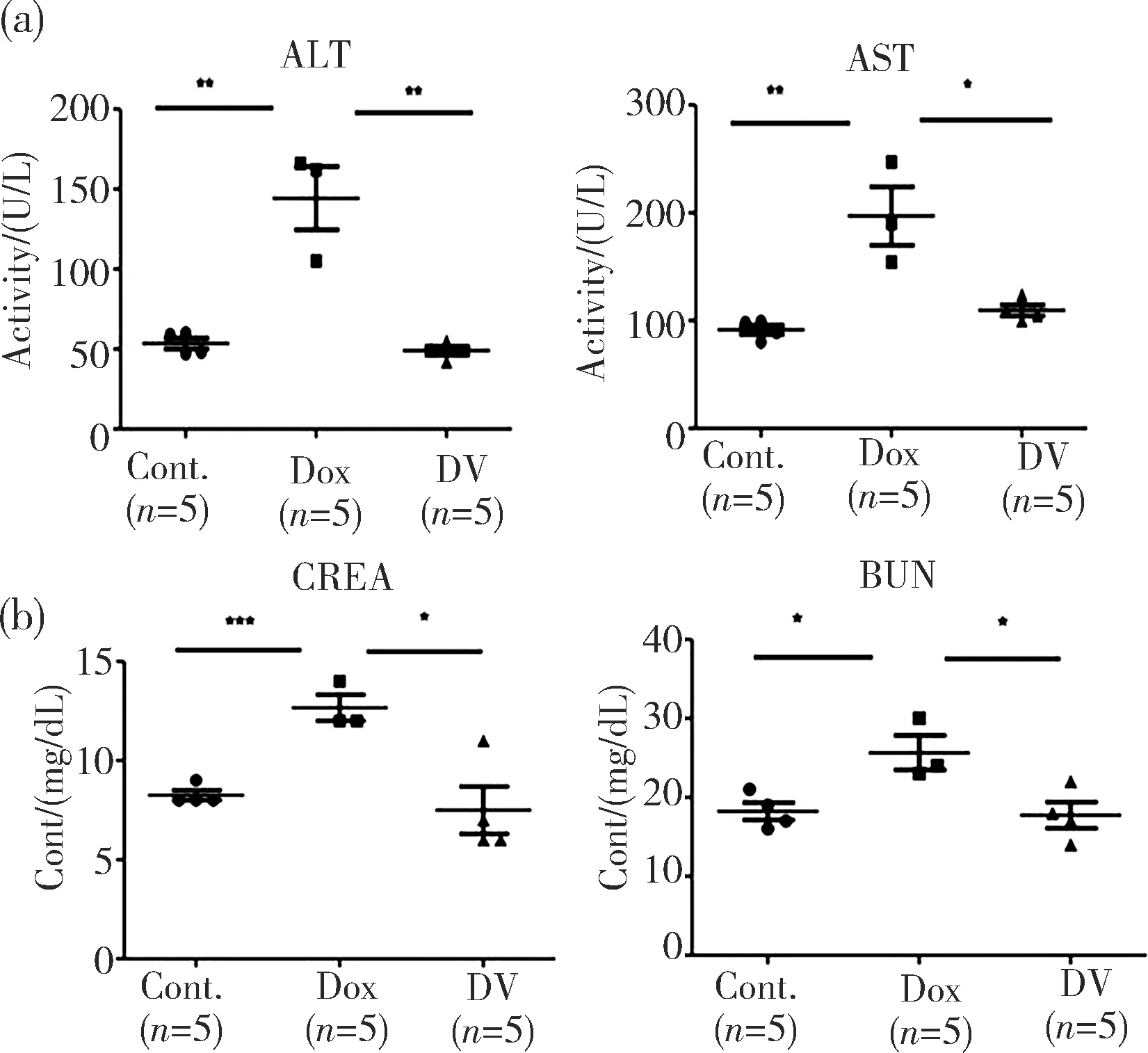
图3 VIS缓解DOX引起的肝肾功能损伤
3.5 VIS无肝毒性和肾毒性
采用上述慢性给药方式处理小鼠,设置对照组和VIS组,其中对照组注射40%环糊精溶液,VIS组小鼠只注射VIS溶液(VIS溶解于40%环糊精中).待给药完成后,抽取血液测肝、肾功能指标,统计结果如5所示:和对照组相比,VIS组小鼠的肝功能指标AST、ALT和肾功能指标BUN、CREA均无显著的变化,由此可说明VIS对小鼠肝、肾组织均无毒性,是一种潜在的安全用药.

图4 VIS缓解DOX引起的小鼠体重减轻

图5 VIS无肝毒性和肾毒性(a) 肝组织; (b) 肾组织Fig.5 VIS is free of liver and kidney toxicity(a) Liver statistics; (b) kidneystatistics
3.6 VIS抑制小鼠肝肾组织中DOX诱发的TOP2-DNA共价复合物形成
使用急性模型小鼠的肝、肾组织样品进行DNA复合物快速检测(RADAR)实验.RADAR实验原理主要是通过强裂解液去除掉DNA上非共价结合的TOP2蛋白,仅留下共价结合的TOP2蛋白,量取等量DNA吸附于硝酸纤维膜并孵育TOP2抗体,由此便可以通过TOP2信号强弱反映TOP2-DNA共价复合物的浓度.结果如图6a,6c所示:DOX组小鼠肝、肾组织内TOP2-DNA共价复合物水平显著升高,而DV处理组小鼠肝、肾内TOP2-DNA复合物水平则明显降低.三次独立实验结果统计如图6b,6d:VIS阻碍了DOX诱发的肝肾组织内TOP2-DNA共价复合物形成.已有报道表明,DOX可通过稳定TOP2-DNA共价复合物致使细胞死亡[14].以上数据支持VIS在小鼠体内通过抑制TOP2-DNA共价复合物形成发挥保护作用.

图6 VIS抑制小鼠组织内TOP2-DNA共价复合物形成
4 讨 论
DOX是临床上应用最广的化疗药之一,但其组织器官毒性极大限制了治疗效果[1].其中DOX诱发的剂量依赖性心脏毒性尤为严重,除此之外肝肾毒性也不可小觑[6,7].本实验室前期采用DOX诱导产生心脏毒性的斑马鱼模型,筛选出以VIS为代表的化学小分子,发现VIS在小鼠和斑马鱼模型中均可以减弱DOX诱发的心脏毒性,并且不会干扰DOX治疗癌症的效果.但VIS是否可以保护肝肾组织尚不知晓.为了模拟临床上DOX的给药方式,明确VIS对DOX诱发的肝肾毒性是否具有缓解作用,我们使用急性和慢性小鼠肝肾损伤模型,通过比较VIS处理后的各项指标变化评价其肝肾损伤程度.结果表明VIS可以有效减少DOX引起的肝肾组织细胞凋亡,并且缓解DOX造成的肝肾功能损伤.
细胞实验结果表明,达到相同的细胞保护作用,VIS所需浓度远远小于DZR:DOX处理细胞死亡率高达30%,而25 μmol/L的VIS溶液和100 μmol/L的DZR均可将细胞死亡率降低至5%,这也许暗示了VIS和DZR的作用机制及作用效力不同[17].
近年来越来越多的研究支持DOX可通过TOP2通路诱发组织毒性,特别是在心肌细胞中特异性敲除TOP2b后,小鼠心脏表现出了对DOX极大的抗性.TOP2负责释放DNA转录和复制时产生的超螺旋张力,DOX可以通过稳定TOP2催化过程中的中间产物TOP2-DNA共价复合物,从而引起DNA损伤及细胞死亡[14,15].我们的研究支持VIS通过抑制TOP2-DNA共价复合物形成拮抗DOX诱导的组织器官毒性.
综上,本研究结果揭示了VIS是一种可以有效拮抗DOX毒副作用的潜在安全佐剂,通过作用于TOP2蛋白发挥保护作用,但其具体作用机制还有待进一步的研究.

